第3讲 盐类的水解
- 格式:ppt
- 大小:5.52 MB
- 文档页数:91

第3讲 盐类的水解一、盐类的水解及其规律1.盐类的水解2.盐类水解规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性强酸强碱盐NaCl 、KNO 3⑩强酸弱碱盐 NH 4Cl 、Cu(NO 3)2弱酸强碱盐CH 3COONa 、Na 2CO 33.表示方法——水解离子方程式水解离子方程式的书写规律:谁弱写谁,都弱都写;阳离子水解生成弱碱,阴离子水解生成弱酸。
(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如Cu2++2H2O; N H4++H2O。
(2)若水解程度较大,书写时要用“”“↑”或“↓”,主要有:Al3+和HC O3-、C O32-、HS O3-、S O32-、HS-、S2-、Al O2-等的双水解,Fe3+和HC O3-、C O32-、Si O32-、Al O2-等的双水解。
如NaHCO3与AlCl3反应的离子方程式为。
(3)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na2CO3水解反应的离子方程式为(主要)、(次要);不能写成C O32-+2H2O H2CO3+2OH-。
(4)多元弱碱阳离子的水解简化成一步完成,如FeCl3溶液中:。
要将盐的电离方程式与盐类水解的离子方程式区别开来。
如:HS-+H2O S2-+H3O+是HS-电离的离子方程式,而HS-+H2O H2S+OH-是HS-水解的离子方程式。
二、影响盐类水解的因素1.内因——盐本身的性质2.外因(1)升高温度,水解平衡向方向移动,水解程度增大。
(2)增大浓度,水解平衡向水解方向移动,水解程度 。
加水稀释,水解平衡向方向移动,水解程度增大。
(3)增大c(H +)可促进 离子水解,抑制 水解;增大c(OH -)可促进 水解,抑制 离子水解。
(4)加入与水解有关的其他物质,符合化学平衡移动原理。




《第3讲 盐类的水解》训练1.下列事实不属于盐类水解应用的是 ( )A .明矾、氯化铁晶体常用于净水B .铵盐类氮肥和草木灰不宜混施C .泡沫灭火器的使用原理D .硫酸跟过量的锌片反应,加入数滴硫酸铜溶液,生成氢气速率加快【答案】D【解析】A 项明矾(Al 3+)、氯化铁晶体(Fe 3+)等在水中水解生成氢氧化铝、氢氧化铁胶体,可吸附水中污物;B 项铵盐类氮肥和碳酸钾不宜混施,如混施会发生双水解反应 2NH 4Cl+K 2CO 3=2KCl+H 2O+2NH 3↑+CO 2↑,造成有效成分损失;C 项碳酸氢钠与硫酸铝的双水解反应:Al(SO 4)3+6NaHCO 3=3Na 2SO 4+2Al(OH)3↓+6C CO 2↑,其中氢氧化铝为胶态沉淀,加上二氧化碳气体产生泡沫;D 项Zn 与置换出的Cu 在电解质溶液中构成原电池,加快反应速率。
2.下列粒子中,能促进水的电离平衡且使溶液的pH<7的是 ( )【答案】B【解析】首先判断4种粒子依次是HCl 、Fe 3+、Cl -、CH 3COO -。
它们进入水中后。
HCl 电离出H +抑制水的电离。
Cl -对水的电离无影响,Fe 3+和CH 3COO -均发生水解而促进水的电离.前者使溶液的pH<7,后者使溶液的pH>7。
答案为B 。
3.下列反应不属于水解反应或水解方程式不正确的是 ( )①HR -+H 2O R 2-+H 3O+ ②Zn 2++2H 2O=Zn(OH)2+2H +③CO 32-+2H 2O H 2CO 3+2OH -④Br -+H 2O HBr+OH -A .①②B .③④C .①②④D .全部【答案】D【解析】①不是水解反应,而是HR -的电离反应。
②不正确。
Zn 2+的水解是可逆的,应写“”号,不应写“=”号。
正确的写法是Zn 2++2H 2O Zn(OH)2+2H +。
③不正确。
多元弱酸根的水解是分步进行的,以第一步为主,可分步写,也可只写第一步。

第三节 盐类的水解一、盐类的水解(一)盐的分类1、按组成分:正盐:电离时生成的阳离子是金属离子(或铵根),阴离子为酸根离子的盐酸式盐:电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐。
碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH 4+)的盐。
2、按溶解性:易溶盐(NaCl );微溶盐(CaSO 4);难溶盐(BaCO 3)3、按形成盐的酸碱的强弱不同:强酸强碱盐(KNO 3)、强酸弱碱盐(NH 4Cl )、强碱弱酸盐(NaF )、弱酸弱碱盐(CH 3COONH 4)(二)盐溶液呈现不同酸碱性的原因——盐类的水解1、定义:在溶液中,盐电离出来的离子与水电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解2、实质:22()()H O H O OH c H c OH H -+-+⎧⎫−−−→⇒→→≠⎨⎬⎭⎩弱碱阳离子弱碱盐电离出来的离子破坏水的电离平衡促进水的电离弱酸阴离子弱酸→溶液呈酸性或碱性表示为:盐+H 2O酸+碱3、特点:(1)极其微弱,为可逆反应,存在水解平衡(2)是中和反应的逆反应,水解反应是吸热反应4、规律:有弱就水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性 注:(1)组成盐的酸越弱,水解程度越大。
例如:水解程度:Na 2CO 3 >CH 3COONa ,因为酸性:H 2CO 3 <CH 3COOH(2)同浓度的正盐比其酸式盐水解程度大。
例如:0.1mol/L 的Na 2CO 3 >0.1mol/L 的NaHCO 3(3)弱酸酸式盐的酸碱性,看电离与水解程度大大小。
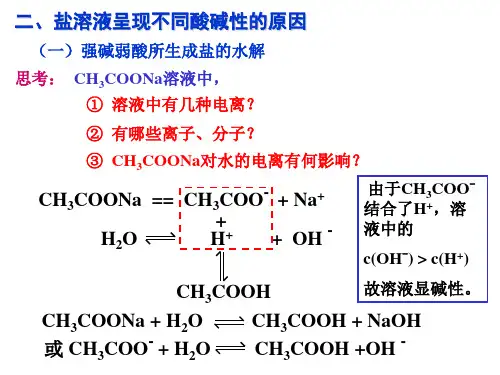
HCO 3-、HPO 42-、HS - 以水解为主→显碱性HSO 3-、H 2PO 4- 以电离为主→显酸性5、盐类水解方程式的书写 (1)一般原则:①必须写“”②不写“↑”“↓” ③H 2CO 3、H 2SO 3等不拆开④多元弱酸阴离子分步水解,分步书写,以第一步为主;多元弱碱阳离子水解方程式一步写完⑤遵守质量守恒、电荷守恒、客观事实(2)书写模式:盐的离子+ H2O弱酸(或弱碱)+OH-(或H+)举例:CH3COONa溶液:CH3COO-+ H2O CH3COOH+OH-NH4Cl溶液:NH4++ H2O NH3·H2O +H+Na2CO3溶液:CO32-+H2O HCO3-+ OH-(第一步水解)HCO3-+ H2O H2CO3+ OH-(第二步水解)FeCl3溶液:Fe3++3H2O Fe(OH)3+3H+(3)双水解——阴阳离子都水解①非彻底型:用“”连接例:CH3COONH4:CH3COO-+ NH4++H2O CH3COOH+NH3·H2O(CH3COONH4显中性)②彻底型:用“=”连接。

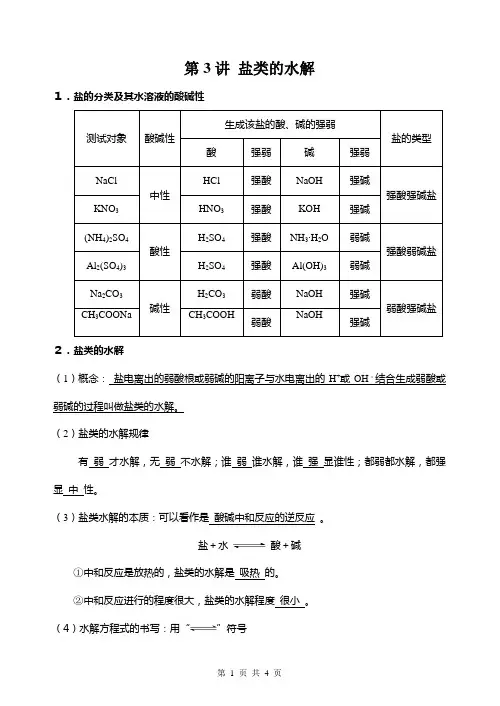
第3讲盐类的水解1.盐的分类及其水溶液的酸碱性测试对象酸碱性生成该盐的酸、碱的强弱盐的类型酸强弱碱强弱NaCl中性HCl 强酸NaOH 强碱强酸强碱盐KNO3HNO3强酸KOH 强碱(NH4)2SO4酸性H2SO4 强酸NH3〃H2O 弱碱强酸弱碱盐Al2(SO4)3 H2SO4强酸Al(OH)3 弱碱Na2CO3碱性H2CO3弱酸NaOH 强碱弱酸强碱盐CH3COONa CH3COOH 弱酸NaOH 强碱2.盐类的水解(1)概念:盐电离出的弱酸根或弱碱的阳离子与水电离出的H+或OH-结合生成弱酸或弱碱的过程叫做盐类的水解。
(2)盐类的水解规律有弱才水解,无弱不水解;谁弱谁水解,谁强显谁性;都弱都水解,都强显中性。
(3)盐类水解的本质:可以看作是酸碱中和反应的逆反应。
盐+水酸+碱①中和反应是放热的,盐类的水解是吸热的。
②中和反应进行的程度很大,盐类的水解程度很小。
(4)水解方程式的书写:用“”符号①化学方程式:盐+水酸+碱②离子方程式:弱酸根或弱碱阳离子+H2O弱酸或弱碱分子+OH-(或H+)③多元弱酸根的水解是分步的,第一步水解的程度远大于第二步水解。
如Na 2CO3溶液: CO32-+H2O HCO3-+OH-(主要)HCO 3-+H2O H2CO3+OH-(次要)④多元弱碱的阳离子水解复杂,看作一步水解。
如Fe3++3H2O Fe(OH)3+3H+例1.请预测下列盐溶液的酸碱性,若能发生水解反应,请写出水解反应的离子方程式。
硝酸铵溶液性,氯化铁溶液性,硫酸铝溶液性,碳酸钾溶液性,醋酸钠溶液性,【答案】酸性NH4++H2O NH3·H2O+H+酸性Fe3++3H2O Fe(OH)3+3H+酸性Al3++3H2O Al(OH)3+3H+碱性CO 32-+H2O HCO3-+OH-,HCO3-+H2O H2CO3+OH-碱性CH3COO-+H2O CH3COOH+OH-例2.实验测得NaHCO3溶液的pH>7,请从电离和水解两方面分析导致NaHCO3溶液显碱性的原因。

