第八章 配位化合物
- 格式:doc
- 大小:203.00 KB
- 文档页数:12


第八章络合物(配位化合物)化学基础【竞赛要求】配位键。
重要而常见的配合物的中心离子(原子)和重要而常见的配位(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。
螯合物及螯合效应。
重要而常见的络合剂及其重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。
配合物几何构型和异构现象基本概念。
配合物的杂化轨道理论。
八面体配合物的晶体的颜色。
路易斯酸碱的概念。
场理论。
Ti(H2O) 36【知识梳理】一、配合物基本知识1、配合物的定义由中心离子(或原子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。
[Co(NH3)6]3+,[Cr(CN)6]3–,Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
[Co(NH3)6]Cl3、K3[Cr(CN)6]、Ni(CO)4都是配位化合物。
[Co(NH3)6]、[Cr(CN)6] 也是配位化合物。
判断的关键在于是否含有配位单元。
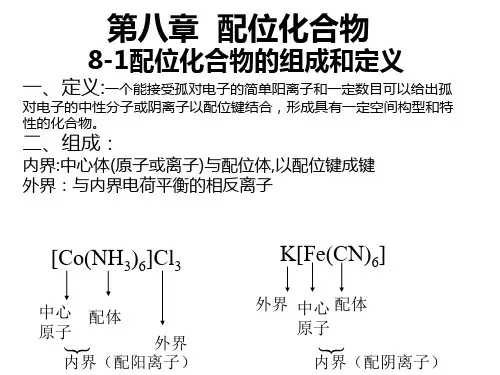
思考:下列化合物中哪个是配合物①CuSO4·5H2O ②K2P t Cl6 ③KCl·CuCl2④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O ⑥Cu(CH3COO)2注意:①配合物和配离子的区别②配合物和复盐的区别2、配合物的组成中心离子内界单齿配体配位体多齿配体配合物螯合配体外界(1)配合物的内界和外界以[Cu(NH3)4]SO4为例:[Cu(NH3)4]2+ SO 24内界外界内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6] 之中,内界是[Cr(CN)6]3–,外界是K+。
可以无外界,如Ni(CO)4。
但不能没有内界,内外界之间是完全电离的。
(2)中心离子和配位体中心离子:又称配合物的形成体,多为金属(过渡金属)离子,也可以是原子。






第八章配位化合物与配位滴定法【知识导航】本章知识在《中国药典》(2010年版)中主要应用于含金属离子药物的含量测定,以配位反应为基础的滴定分析法。
目前多用氨羧配位剂为滴定液,其中以乙二胺四醋酸(EDTA)应用最广。
《中国药典》中使用直接滴定法对葡萄糖酸钙、葡萄糖酸钙口服液、葡萄糖酸钙含片、葡萄糖酸钙注射剂、葡萄糖酸钙颗粒、葡萄糖酸锌、葡萄糖酸锌口服液、葡萄糖酸锌片、葡萄糖酸锌颗粒进行含量测定;使用间接滴定法对氢氧化铝、氢氧化铝片、氢氧化铝凝胶进行含量测定。
在历年执业药师考试中也有相关考题出现。
学好本章内容有利于掌握配位滴定法的原理、配位滴定法在药物分析中的应用以及备战执业药师考试。
【重难点】1.配位化合物(coordination compound)简称配合物,以具有接受电子对的空轨道的原子和离子为中心(中心离子),与一定数量的可以给出电子对的离子或分子(配体)按一定的组成和空间构型形成的化合物。
配位键的形成:中心离子(原子)提供空轨道,配位体上的配位原子提供孤对电子。
例如:[Cu(NH3)4]SO4、K3[Fe(NCS)6]等。
这些化合物与简单的化合物区别在于分子中含有配位单元,而简单化合物中没有这些配位单元。
以[Cu(NH3)4]SO4为例:[Cu (NH3)4 ] SO4↓ ↓↓内界配体外界配位体中提供孤电子对的,与中心离子以配位键结合的原子称为配位原子。
一般常见的配位原子是电负性较大的非金属原子。
常见配位原子有C、N、O、P及卤素原子。
由于不同的配位体含有的配位原子不一定相同,根据一个配位体所提供的配位原子的数......目.,可将配位体分为单齿配位体(unidentate ligand)和多齿配位体(multidentate ligand)。
只含有一个配位原子配位体称单齿配位体如H2O、NH3、卤素等。
有两个或两个以上的配位原子配位体称多齿配位体,如乙二胺NH2一CH2一CH2一NH2(简写为en),草酸根C2O42-(简写为ox)、乙二胺四醋酸根(简称EDTA)等。

第八章配位化合物思考题解析以下配合物中心离子的配位数为6假定它们的浓度均为0.001mol.L-1,指出溶液导电能力的顺序,并把配离子写在方括号内.(1)Pt(NH3)6Cl4(2)Cr(NH3)4Cl3(3)Co(NH3)6Cl3(4)K2[PtCl6]解:溶液导电能力顺序为Pt(NH3)6Cl4>Co(NH3)6Cl3>K2[PtCl6]>Cr(NH3)4Cl32. PtCl4和氨水反应, 生成化合物的化学式为)Pt(NH3)4Cl4。
将1mol此化合物用AgNO3处理,得到2molAgCl,试推断配合物内界和外界的组分, 并写出其结构式。
解:内界为[PtCl2 (NH3)4]2+、外界为2 Cl-,结构式为:[Pt Cl2 (NH3)4] Cl2。
3下列说法哪些说法不正确?说明理由。
配合物由内界和外界两部分组成。
(2)只有金属离子才能作为配合物的形成体。
(3)配位体的数目就是形成体的配位数。
(4)配离子的电荷数等于中心离子的电荷数。
(5)配离子的几何构型取决于中心离子所采用的杂化轨道类型。
解:(1)不正确。
有些化合物不存在外界,如[PtCl2 (NH3)2]、[CoCl3 (NH3)3]等。
不正确。
少数高氧化数的非金属元素离子也可作为形成体,如[BF4]-、[SiF6]2-中的B3+、Si4+等;另外,有些中性原子也可作形成体,如[Ni(CO)4]中的Ni原子。
不正确。
在多齿配体的螯合物中,配位体数目就不等于配位数,如[Cu(en)2]2+中。
不正确。
配离子电荷应是形成体和配位体电荷的代数和。
如[Fe(CN)6]3-。
正确。
4.实验测得下列配合物磁矩数据(B.M.)如下:[CoF6]3- 4.5 [Ni(NH3)4]2+ 3.0 [Ni(CN)4]2-0 [Fe(CN)6]4-0 [Cr(NH3)6]3+ 3.9 {Mn(CN)6}4- 1.8试判断它们的几何构型,并指出哪个属于内轨型,哪个属于外轨型配合物。
解:5.下列配离子中哪个磁矩最大?[Fe(CN)6]3-[Fe(CN)6]4- [Co(CN)6]3-[Ni(CN)4]2- [Mn(CN)6]3-解:可见, [Mn(CN)6]3-的磁矩最大。
6.下列配离子(或中性配合物)中,哪个为平面正方形构型?哪个为正八面体构型?哪个为正四面体构型?[PtCl4]2-[Zn (NH3)4]2+Fe(CN)6]3-[HgI4]2-[Ni(H2O)6]2+[Cu(NH3)4]2+解:10.试解释下列事实:用王水可溶解Pt、Au等惰性较大的贵金属,但单独用硝酸或盐酸则不能溶解。
[Fe(CN)6]4-为反磁性,而[Fe(CN)6]3-为顺磁性。
[Fe(CN)6]3-为低自旋,而[Fe(CN)6]4-为高自旋。
[Co(H2O)6]3+的稳定性比[Co(NH3)6]3+差得多。
解:(1)由于王水是由浓硝酸和浓盐酸组成,浓硝酸将Pt、Au氧化形成的金属离子可与浓盐酸提供的高浓度的氯离子形成稳定的[PtCl6]2-、[Au Cl4]-,使Pt4+、Au3+的浓度大大降低,从而使Pt、Au进一步被氧化。
(2)[Fe(CN)]4-中Fe2+(3d6)d电子分布方式为无成单电子,故为反磁性。
[Fe(CN)6]3-中Fe3+(3d5)d电子分布方式为有成单电子,故为顺磁性。
(3)因为CN-为强场,Δ0大,易形成低自旋配合物;而F-为弱场,Δ0小,易形成高自旋配合物。
由于配体NH3的场强比H2O的大的多,所以[Co(H2O)6]3+的晶体场稳定化能比[Co(NH3)6]3+的小的多,导致前者比后者稳定性差的多。
11.下列说法中哪些不正确?说明理由。
(1)某一配离子的K f值越小,该配离子的稳定性越差。
(2)某一配离子的K d值越小,该配离子的稳定性越差。
(3)对于不同类型的配离子,K f值大者,配离子越稳定。
(4)配合剂浓度越大,生成的配离子的配位数越大。
解:(1)正确。
(2)不正确。
K d值越小,说明该配离子越难离解,亦即稳定性越好。
(3)不正确。
不同类型配离子的配位数不相同,故其稳定性不能按K f值大小比较。
(4)不一定。
当配位剂浓度大小已经满足形成体的特征配位数后,配位物浓度即使再增大,对形成配离子的配位数已无大影响。
12.向含有[Ag(NH3)2]+的溶液中分别加入下列物质:(1)稀HNO3(2)NH3·H2O(3)Na2S溶液。
试问下列平衡的移动方向。
[Ag(NH3)2]+ ========= ==Ag++ 2 NH3解:(1)平衡向右移动。
(2)平衡向左移动。
(3)平衡向右移动。
13.AgI在下列相同浓度的溶液中,溶解度最大的是哪一个?KCN Na2S2O3KSCN NH3·H2O 解:AgI若在上述相同的配合剂中溶解,生成的配离子分别为[Ag(CN)2]-、[Ag(S2O3)2]3-、[Ag(SCN)2]-、[Ag(NH3)2]+, 它们的K f值分别为1.26×1021、2.88×1013、3.72×107、1.12×107,由此可得出AgI在KCN溶液中溶解度最大.14.根据配离子的K f(标准)值判断下列E(标准)值哪个最小?哪个最大?(1)E(标准)(Ag+/Ag)(2) E(标准)([Ag(NH3)2]+/Ag)(3) E(标准)([Ag(S2O3)2]3-/Ag)(4) E(标准)([Ag(CN)2]-/Ag)解:根据8-13题解数据可知:K f(标准)值(4)>(3)>(2),K f(标准)值越大,说明相应氧化型物质中c(Ag+)越小,导致其电对的标准电极电势值越小。
所以E(标准)(Ag+/Ag)最大,E(标准)([Ag(CN)2]-/Ag)最小。
15.判断下列转化反应能否进行。
(1)[Cu(NH3)4]2+ + 4H+Cu2+ + 4NH4+(2) AgI + 2 NH3 [Ag(NH3)2]+ + I-(3) Ag2S + 4CN-2[Ag(CN)2]- + S2-(4) [Ag(S2O3)2]3- + Cl-AgCl + 2 S2O32-解:(1)能。
(2)不能。
(3)不能。
(4)不能。
习题解答指出下列配离子的形成体、配体、配位原子及中心离子的配位数。
解:命名下列配合物,并指出配离子电荷数和形成体的氧化数。
解:写出下列配合物的化学式:三氯·一氨合铂(Ⅱ)酸钾高氯酸六氨合钴(Ⅱ)二氯化六氨合镍(Ⅱ)四异硫氰酸根·二氨合铬(Ⅲ)酸胺一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ)五氰·一羰基合铁(Ⅱ)酸钠解:(1)K[PtCl3(NH3)] (2) [Co(NH3)6](ClO4)2(3) [Ni(NH3)6]Cl2NH4[Cr(NCS)4(NH3)2(5) [Cr(OH)(C2O4)(H2O)(en)] (6) Na2[Fe(CN)5(CO)]有下列三种铂的配合物,用实验的方法确定它们的结构,其结果如下:根据上述结果,写出上列三种配合物的化学式。
解:三种配合物的化学式分别为(1)(2)(3)[Pt(NH3)6]Cl4[PtCl2(NH3)4]Cl2[PtCl4(NH3)2根据下列配离子中心离子未成对电子数及杂化类型,试绘制中心离子价电子层电子分布示意图。
解:[Cu(NH3)4]2+dsp2杂化3d 4s 4pNH3 NH3 NH3 NH3[CoF6]3-sp3d2杂化3d 4s 4p 4dF-F-F-F-F-F- [Ru(CN)6]4-d2sp3杂化4d 5s 5pCN- CN- CN- CN- CN- CN-[Co(NCS)4]2-sp3杂化3d 4s 4pSCN- SCN- SCN- SCN-已知[MnBr4]2-和[Mn(CN)6]3-的磁矩分别为5.9和2.8B.M.,试根据价键理论推测这两种配离子d电子分布情况及它们的几何构型。
解:已知[MnBr4]2-和μ=5.9B.M., [Mn(CN)6]3-μ=2.8B.M. 由μ=√n (n+2) 式求得[MnBr4]2- 中n =5 Mn2+(n=5),与相比较,可推测[Mn(CN)6]3- 中n =2 Mn3+(n=4)[MnBr4]2-价电子层分布为sp3杂化3d 4s 4pBr- Br- Br- Br-[MnBr4]2- 几何构型为正四面体。
[Mn(CN)6]3- 价电子层分布为d2sp3杂化3d 4s 4pCN- CN- CN- CN- CN- CN-[Mn(CN)6]3- 几何构型为正八面体。
在50.0mL0.20mol·L-1AgNO3溶液中加入等体积的1.00mol·L-1的NH3·H2O,计算达平衡时溶液中Ag+、[Ag(NH3)2]+ 和NH3·H2O 的浓度。
解:混合后尚未反应前: c (Ag +)=0.10mol.L -1 c (NH 3·H 2O)=0.50 mol.L -1又因K f Θ([Ag(NH 3)2]+)较大,可以认为Ag +基本上转化为[Ag(NH 3)2]+,达平衡时溶液中c (Ag +)、c (NH 3·H 2O)、c ([Ag(NH 3)2]+)由下列平衡计算:Ag + + 2 NH 3·H 2O ====== [Ag(NH 3)2]+ + 2 H 2O起始浓度/(mol ·L -1) 0.50-2×0.10 0.10 平衡浓度/(mol ·L -1) x 0.30+2x 0.10-x72023*********.1}/)(}{/)({}/)])(([{⨯=∙=++c O H NH c c Ag c c NH Ag c K f721012.1)230.0(10.0⨯=+-x x x K f 0较大,故x 很小,0.10-x ≈0.10,0.30+2x ≈0.30。
则721012.130.010.0⨯=xx =9.9×10-8即c (Ag +)=9.9×10-8 mol ·L -1, c ([Ag(NH 3)2]+)=( 0.10-x ) mol.L -1≈0.10mol.L -1 c (NH 3·H 2O)=(0.30+2x ) mol.L -1≈0.30mol.L -18.10mL0.10 mol.L -1CuSO 4溶液与10mL6.0 mol.L -1 NH 3·H 2O 混合达平衡,计算溶液中Cu 2+, NH 3·H 2O,[Cu(NH 3)4]2+的浓度各是多少?若向此混合溶液中加入0.010 mol.L -1NaOH 固体,问是否有Cu(OH)2沉淀生成?解:混合后未反应前:c (Cu 2+)=0.050 mol.L -1, c (NH 3)=3.0 mol.L -1,达平衡时: Cu 2+ + 4 NH 3·H 2O ====== [Cu(NH 3)4]2+ + 4 H 2O 平衡浓度/( mol.L -1) x 3.0-4×0.050+4x 0.050-x13440302024301009.2)48.2(050.0}/)(}{/)({/)])(([⨯=+-==++x x x c NH c c Cu c c NH Cu c K fx 很小,故2.8+4x ≈2.8, 0.050-x ≈0.050,134101.2)8.2(050.0⨯=x x =3.9×10-17 即c (Cu 2+)=3.9×10-17 mol.L -1, c ([Cu(NH 3)4]2+)≈0.050 mol.L -1, c (NH 3·H 2O)≈2.8 mol.L -1 若在此溶液中加入0.010 mol.L -1NaOH(s),即: c (OH -)(0.010×1000/20) mol.L -1 =0.50 mol.L -1,J=21720202)50.0(109.3)()}({)(⨯⨯=⨯--+c OH c c Cu c =9.8×10-18>K sp 0(Cu(OH)2)故有Cu(OH)2沉淀产生。