九年级化学 - 原子的结构(练习+答案)
- 格式:docx
- 大小:338.51 KB
- 文档页数:7

课题2?原子的结构第1课时(分层练习)-2023-2024学年九年级化学上册(原卷版+解析版)一、单选题1.(2023秋·九年级课时练习)下列对原子结构的认识错误的是A.原子核体积很小B.原子核带正电C.原子内部有很大的空间D.原子是实心的球体【答案】D【解析】略2.(2023秋·福建泉州·九年级校考阶段练习)下列关于科学家对原子结构的认识中,对应错误的是A.汤姆生发现原子中含有电子B.道尔顿提出原子学说C.拉瓦锡发现了质子D.卢瑟福发现了原子核【答案】C【详解】A、汤姆生发现原子中含有电子,正确;B、道尔顿提出原子学说,正确;C、拉瓦锡发现了空气的成分,证明了空气是一种混合物,错误;D、卢瑟福发现了原子核,正确;故选C。
3.(2023秋·九年级课时练习)原子是由A.电子和中子构成的B.质子和中子构成的C.质子和电子构成的D.原子核和电子构成的【答案】D【详解】A、原子是由原子核与电子构成,不是电子和中子构成的,错误;B、原子是由原子核与电子构成,不是质子和中子构成的,错误;C、原子是由原子核与电子构成,不是质子和电子构成的,错误;D、原子是由原子核与电子构成,正确。
故选D。
4.(2023秋·山东德州·九年级统考期中)2023年4月13日,倭国政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。
核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子A.含有2个质子B.核电荷数为1C.相对原子质量为4 D.核外电子数为2【答案】B【分析】本题考查原子结构。
【详解】A、由图可知,原子中有一个质子,故A不符合题意;B、原子结构中,质子数等于核电荷数,因此是1,故B符合题意;C、相对原子质量约等于质子数加中子数,因此为1+2=3,故C不符合题意;D、质子数等于核外电子数,因此电子数为1,故D不符合题意;故选B。
【分析】本题难度不大,结合原子结构进行辨析即可。

初中九年级上册化学原子的结构测试题(含答案)1.下列粒子中不能直接构成物质的是()A.原子 B.分子 C.电子 D.离子。
2.含有原子团的物质是()A.XXX。
3.下列我国著名科学家中,为相对原子质量的测定作出了卓越贡献的是()A.钱学森 B.屠呦呦 C.张青莲 D.侯德榜。
4.下列有关微粒的说法错误的是()A.一个氯原子失去一个电子成为阳离子 B.公园里花香四溢,说明分子在不断运动 C.要保持水的化学性质,就必须保持水分子不变 D.氢原子和氧原子是水分子中的最小微粒。
5.下列关于四种粒子结构示意图的说法正确的是()A.①③属于不同种元素 B.④属于离子,离子符号为Mg C.②③的化学性质相似 D.①④均达到相对稳定的结构。
6.下列物质中,由分子构成的是()A.镁 B.金刚石C.氯化钠 D.水。
7.1897年,英国科学家XXX发现了原子内有带负电的电子,而原子是电中性的,由此推测,原子内还有带正电的物质。
在此基础上,经过XXX、XXX等科学家的不断完善和修正,建立了现代原子结构模型。
如图是XXX整理的物质微观构成网络图,则XXX当年推测的“带正电的物质”相当于图中的()2- A、甲 B、乙 C、丙 D、丁。
8.如图是某元素的原子结构示意图,下列有关该原子的说法错误的是()A.质子数为11 B.易失去电子形成阳离子C.最外层有1个电子 D.该原子有三个电子层。
9.下列说法不正确的是()A.原子呈电中性 B.原子中一定含有质子 C.化学反应前后原子的种类不变 D.保持水的化学性质的微粒是氢原子和氧原子。
10.XXX同学撰写的“心目中的原子”短文中,阐述了以下观点,你认为不正确的是()A.原子可以转化为离子 B.原子是最小的微观粒子 C.有些物质是由原子构成的 D.原子可以“搭建”成分子。
11.铈(Ce)是一种常见的稀土元素,已知铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为()A.24 B.58 C.82 D.140.12.核电荷数多于核外电子数的粒子一定是()A.分子B.原子 C.阴离子 D.阳离子。
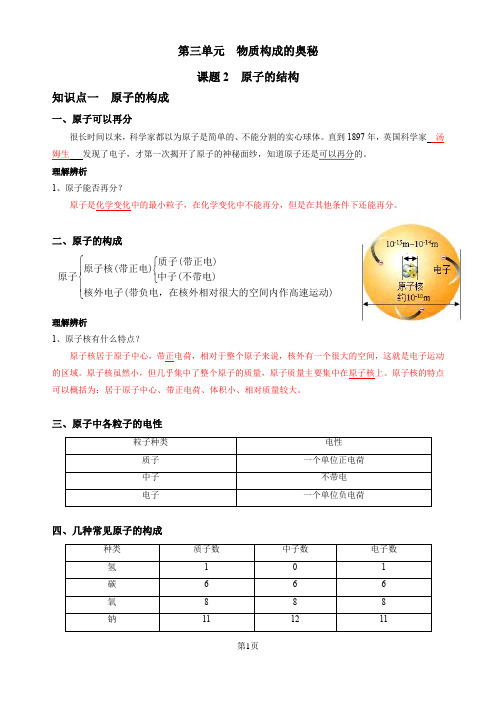
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。

初中化学原子的结构练习题(含答案)一、选择题1. 原子的结构是()A. 细胞B. 粒子C. 分子D. 质子答案:C2. 原子中组成原子核的粒子是()A. 电子B. 质子C. 中子D. 什么都不是答案:B3. 下列说法正确的是()A. 电子在原子核外绕行B. 质子和中子分别带正电和负电C. 原子核中的粒子数目不固定D. 原子核内质子质量大于中子答案:A4. 原子的结构是由()构成的。
A. 原子核和电子云B. 原子核和质子C. 原子核和中子D. 电子云和质子答案:A5. 原子核中所含的质子数决定了()。
A. 元素的化学性质B. 元素的物理性质C. 元素的放射性D. 元素的熔点答案:A6. 下列关于原子核的说法,正确的是()A. 原子核的直径是电子云的数千倍B. 原子核内质子和中子的质量几乎相等C. 原子核内质子和中子的数量相等D. 原子核是由正电质子组成的答案:B二、判断题1. 原子核由质子和电子组成。
答案:错2. 原子核的直径大约是原子的直径的万分之一。
答案:对3. 原子核的电子云中没含有电子。
答案:错4. 原子核中的质子数目决定了元素的原子序数。
答案:对5. 原子核内质子的质量大于中子。
答案:错三、填空题1. 原子核由________和________组成。
答案:质子,中子2. 原子核的直径约为________。
答案:10^-15米3. 原子核内质子与中子的数量差异称为________。
答案:中子过剩4. 原子的质子数称为________,用符号____表示。
答案:原子序数,Z5. 电子绕行的区域称为________。
答案:电子云四、简答题1. 请简要描述原子核的构成和性质。
答案:原子核是由质子和中子组成的,在原子中占据着非常小的体积空间,约占整个原子体积的10^-15倍。
原子核带有正电荷,质子和中子的质量几乎相等,质子的质量略大于中子。
此外,原子核还具有放射性。
2. 原子的质子数如何影响元素的性质?答案:元素的质子数,即原子核内质子的数量,决定了元素的原子序数。

3.2 原子的结构一.选择题(共19小题)1.碳12是指含6个中子的碳原子。
下列对氧16和氧18两种氧原子的说法正确的是()A.质子数相同B.质量相同C.电子数不相同D.16和18表示原子个数2.氚是氢的一种同位素,氚原子含有1个质子和2个中子。
下列示意图能正确表示氚原子结构的是()A.A B.B C.C D.D3.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c对应的是()A.原子、原子核、核外电子B.原子核、原子、核外电子C.原子、核外电子、原子核D.核外电子、原子核、原子4.绝大多数原子的原子核中含有()A.质子、中子、电子B.质子、电子C.中子、电子D.质子、中子5.最近,美国科学家宣布其发现的二种超重新元素是错误的;俄罗斯科学家则宣布发现了114号超重新元素,其相对原子质量为289,质子数为114.下列说法正确的是:(已知:相对原子质量=质子数+中子数)()A.114号元素原子的中子数为175B.114号元素原子的中子数为403C.科学家宣布自己的研究成果错误是可耻的D.科学研究成果是不可能有错误的6.核电荷数少于核外电子数的一定是()A.分子B.原子C.阳离子D.阴离子7.某微粒核内有n个质子,核外有(n﹣1)个电子,此粒子是()A.阳离子B.阴离子C.分子D.原子8.有A、B两种原子,已知A的原子的质子数为a,A3+和B n﹣的电子排布相同,则B原子的核电荷数为()A.a+3﹣n B.a﹣3+n C.a+3+n D.a﹣3﹣n9.下列关于钠原子和钠离子的说法中,正确的是()A.它们的核外电子数相同B.它们的性质完全相同C.钠原子的质量比钠离子大的多D.它们的质子数和中子数都相同10.某阴离子X2﹣的核外有18个电子,核内有18个中子,则X的相对原子质量为()A.54 B.38 C.36 D.3411.下列关于微观粒子的说法,正确的是()A.原子是由分子构成的B.原子中含有质子、中子和核外电子C.原子若失去核外电子,则会变成阴离子D.原子若得到核外电子,则会变成阳离子12.2010年2月19日德国重粒子研究中心宣布原子序数为112号的元素符号为Cn,其相对原子质量为277.下列有关112号元素的说法正确的是()A.该元素原子的核电荷数为277B.该元素原子的质子数为165C.该元素原子的中子数为112D.该元素原子的核外电子数为11213.某些花岗岩石材中含有放射性元素氡,会影响人体健康.一种氡原子的质子数为86,相对原子质量为222,这种氡原子的核外电子数为()A.50 B.86 C.136 D.22214.1991年,我国著名化学家张青莲教授与另一位科学家合作,测定了铟(In)元素的相对原子质量新值.铟元素的核电荷数为49,相对原子质量为115.铟原子的中子数为()A.164 B.115 C.66 D.4915.某元素的相对原子质量是31,原子核外有三个电子层,最外层有5个电子,则该元素原子核中的中子数是()A.12 个B.15 个C.16 个D.17 个16.牙膏中的含氟化合物对牙齿有保护作用。

第三单元物质构成的奥秘课题2 原子的结构★知识点一、原子的构成1、构成物质的三粒子:、、。
构成原子的三种粒子:、、。
原子由和两部分构成。
2、原子不显电性的原因:原子核带的。
3、原子的质量主要集中;原子的质量主要由决定。
4、不是所有原子都含有,如。
5、原子中的等量关系:= = 。
二、原子核外电子的排布1、核外电子是的。
2、核外电子排布的规律:第一层最多个;第二层最多个;最外层不超过(只有一层不超过2个)3、1-20号元素的原子结构示意图。
4、元素在周期表中的周期数等于原子的电子层数。
5、元素的主要取决于。
注:(1)稳定结构:。
(2)各类元素性质与原子结构的关系:三、离子1、离子:带电荷的或。
2、离子的分类阳离子;带正电荷的离子。
如:H+、Na+、Mg2+、Al3+、Ca2+、NH4+、Fe3+、Fe2+阴离子:带负电荷的离子。
O2-、S2-、Cl-、OH-、SO42-、CO32-、NO3-、3、离子符号的意义:Mg2+:;1个镁离子2Mg2+:4、离子的判断:质子数电子数的是阳离子。
质子数电子数的是阴离子。
5、离子与形成离子的原子在质量上,且。
四、相对原子质量1、概念:以一种碳原子质量的1/12为标准,其它原子的质量跟它相比较所得的比,就是相对原子质量。
2、计算式:某元素相对原子质量=()()kg1 12kg12⨯一个该原子的实际质量一种碳原子的实际质量3、相对原子质量=+ 。
注意:相对原子质量不是实际质量,单位是1,省略。
【教材知识点一】教材P53、P54页:例1.(2021·浙江衢州市·中考真题)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。
核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子()A.含有2个质子B.核电荷数为1C.相对原子质量为4D.质子数和中子数相等【教材知识点二】教材P54、P55页:例2.(2022山东聊城中考)如图是四种微粒的结构示意图。
九年级化学原子结构单元测试题及答案一、选择题1. 原子核由什么组成?- A. 质子和中子- B. 质子和电子- C. 电子和中子- D. 电子和质子- Answer: A2. 下列哪种粒子质量最轻?- A. 质子- B. 中子- C. 电子- D. 都一样重- Answer: C3. 质子的电荷为正电荷,电子的电荷为负电荷,那么中子的电荷是什么?- A. 正电荷- B. 负电荷- C. 无电荷- Answer: C4. 原子中的电子是处于哪个能级上的?- A. 布居能级- B. 价层能级- C. 单层能级- D. 最外层能级- Answer: D5. 原子核和电子轨道之间的距离很大,原子半径约为:- A. 10^-11m- B. 10^-10m- C. 10^-9m- D. 10^-8m- Answer: B二、判断题1. 质子和电子一样重。
- True/False: False2. 非金属元素中的离子是带正电荷的。
- True/False: False3. 电子在轨道上做椭圆形运动。
- True/False: True4. 一个原子中,质子数和中子数相等。
- True/False: False5. 电子的质量比质子的质量轻很多。
- True/False: True三、简答题1. 什么是元素?- Answer: 元素是由具有相同原子序数的原子组成的纯物质,是化学中最基本的物质单位。
2. 什么是原子核?- Answer: 原子核是原子的中心部分,由质子和中子构成,是原子的重要组成部分。
3. 什么是电子?- Answer: 电子是带负电荷的基本粒子,存在于原子的轨道中,参与化学反应和形成化学键。
4. 原子核和电子之间的相互作用力是什么?- Answer: 原子核和电子之间的相互作用力是电磁力。
5. 原子的半径是什么?- Answer: 原子的半径是指原子核与最外层电子轨道之间的距离。
四、计算题1. 一个元素的原子核中有12个中子和10个质子,该元素的原子序数是多少?- Answer: 原子序数 = 质子数 = 102. 一个原子的电子数为17,质子数为17,中子数为18,该元素的质量数是多少?- Answer: 质量数 = 质子数 + 中子数 = 17 + 18 = 353. 一个原子的质子数为26,电子数为23,中子数为30,该元素的质量数是多少?- Answer: 质量数 = 质子数 + 中子数 = 26 + 30 = 564. 一个元素的质子数为8,质量数为18,该元素的中子数是多少?- Answer: 中子数 = 质量数 - 质子数 = 18 - 8 = 105. 一个元素的质子数为32,质量数为75,该元素的中子数是多少?- Answer: 中子数 = 质量数 - 质子数 = 75 - 32 = 43以上是九年级化学原子结构单元测试题及答案。
课题2 原子的结构第1课时【基础达标】1.( 2023·永川区一模)在原子里质子数等于()A.电子数B.中子数C.中子数和电子数之和D.中子数和电子数之差【答案】A【解析】在原子中,核电荷数=核内质子数=核外电子数。
故选A。
2.氢原子核发生聚变时会释放一种不带电的微观粒子,这种微观粒子是()A.质子B.中子C.电子D.原子核【答案】B【解析】中子不带电,质子、电子、原子核都带电,因此氢原子核发生聚变时会释放一种不带电的微观粒子是中子。
故选B。
3.如图为氧的原子结构示意图,其中“x” 的数值是()A.2B.4C.6D.8【答案】D【解析】原子中,核内质子数等于核外电子数,则图中的x=2+6=8,故选D。
4.氦3是一种如今已被世界公认的高效、安全的核聚变原料,其原子核中质子数为2、中子数为1。
氦3的原子结构示意图是()【答案】A【解析】根据在原子中,质子数核外电子数,氦3原子中质子数为2,所以氦3核外电子数也是2,所以1个“氦3”原子中,含有2个质子、1个中子和2个电子,故其原子的结构示意图为,故选A。
5.对“原子的构成”同学们有以下认识,其中不正确...的是()A.原子核中质子数一定等于中子数B.核外电子在离核远近不同的区域中运动C.原子由居于中心的原子核和核外电子构成D.原子核的体积与整个原子的体积相比要小很多【答案】A【解析】A.原子核中质子数不一定等于中子数,例如普氢原子中,质子数为1,中子数为0,钠原子质子数为11,中子数为12,故A错误;B.核外电子具有的能量不同,核外电子在离核远近不同的区域中运动,能量低的电子离核较近,能量高的电子离核较远,故B正确;C.科学家研究发现,原子是由居于中心的原子核和核外电子构成的,故C正确;D.原子核的半径大约是原子半径的十万分之一,原子核的体积与整个原子的体积相比要小很多,故D正确。
故选A。
6.( 2023·中山市一模)如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子。
部编版九年级化学上册第三单元物质构成的奥秘《课题2 原子的结构》课时作业一、单选题1.下列物质由离子构成的是A.氢气B.氯化钾C.金刚石D.二氧化碳2.下列说法正确的是A.原子都是由质子、中子、电子三种粒子构成的B.分子与原子的主要区别是分子大,原子小C.不同种原子之间的本质区别是核电荷数不同D.在原子中,质子数等于中子数3.下列对分子、原子、离子的认识正确的是()A.同种分子排列方式不同,化学性质不同B.在干冰中,分子因相互作用而静止不动C.同种原子按不同方式结合,可以构成不同的物质D.原子得失电子形成离子后,原子核发生了变化4.下列物质由离子构成的是A.汞B.氧气C.氯化钠D.二氧化碳5.如下图是五种微粒的结构示意图,下列说法正确的是A.①①属于金属元素B.①的微粒符号是Al3+C.①①①属于阳离子D.①①位于元素周期表的同一周期6.如图为某粒子结构示意图,下列说法错误的是A.该粒子属于非金属元素B.该粒子核外电子数为17C.该粒子具有3个电子层D.在化学反应中,该元素原子易得电子形成Cl-7.关于分子和原子两种微粒的叙述正确的是A.分子可分,原子不可分B.分子大原子小C.同种原子可能构成不同的分子D.分子是保持物质化学性质的最小微粒8.某微粒M的结构示意图如下,关于该微粒的说法正确的是A.M的原子易失电子B.x只能为7C.M为金属元素D.x为8时,M为阴离子9.“宏观辨识与微观探析”是化学学科的核心素养之一,下列说法正确的是①化学变化中,原子核不发生改变①向气球吹气的过程中分子之间的间隔发生了变化①同种分子构成的物质是纯净物①表示的微粒都是离子A.①①①B.①①C.①①D.①①①①10.如图是五种微粒的结构示意图,下列说法不正确的是A.上述五种微粒只涉及四种元素B.①①①表示的微粒性质较稳定C.①①①属于原子,①①属于阴离子D.①①对应元素组成化合物的化学式为NaF二、课内填空11.构成物质的粒子有_____、___________和___________等。
原子的结构与离子练习一.选择题(共30小题)1.下列关于Na和Na+的叙述中,错误的是()A.它们相差一个电子层B.它们的化学性质相似C.钠原子,钠离子均为同一元素D.灼烧时,它们的焰色反应都呈黄色2.氚是氢的一种同位素,氚原子含有1个质子和2个中子.下列示意图能正确表示氚原子结构的是()A.A B.B C.C D.D3.关于原子、分子、离子的说法中,错误的是()A.原子不能直接构成物质B.分子可以保持物质的化学性质C.原子的质量主要集中在原子核上D.金属原子失去电子会形成阳离子4.下列各种粒子,不带电的是()A.原子核B.质子 C.中子 D.电子5.下列说法中正确的是()A.原子的质量几乎都集中在原子核中B.生活中常接触到的“高钙牛奶”、“碘盐”中的“钙”、“碘”指的是离子C.通常把PH<7的降水称为酸雨D.氯化铵可以与草木灰(含碳酸钾)混合施用6.一种元素的离子变成原子,这种离子发生的变化是()A.一定失去电子B.可能失去电子,也可能得到电子C.一定得到电子D.既不失去电子,也不得到电子7.某元素的一个原子失去1个电子后形成的粒子与Ne原子有相同的核外电子数,下列说法正确的是()A.该元素为非金属元素B.该粒子为阴离子C.该粒子核电荷数为10 D.该粒子为Na+8.运用推理、归纳、类比、对比的方法得出下列结论,其中正确的是()A.Na+、Mg2+、Cl﹣的最外层电子数均为8,所以离子的最外层电子数均为8B.催化剂可以改变化学反应速率,所以加入催化剂后,反应速率一定会加快C.氧化物中含有氧元素,所以含有氧元素的化合物就是氧化物D.构成一氧化碳和二氧化碳的分子不同,所以两者的化学性质不同9.如图形象地表示了氯化钠的形成过程.下列相关叙述中不正确的是()A.钠离子与钠原子的化学性质不同B.钠跟氯气反应生成氯化钠C.氯化钠是由离子构成的化合物D.钠原子得到一个电子形成阳离子,氯原子失去一个电子形成阴离子10.在下列微粒中带有电荷的是()A.分子B.中子 C.原子 D.离子11.下列计算正确的是()A.在Na+中,质子数为11,电子数为11B.Mr[CO(NH2)2]=12+16+14+2×2C.化工颜料普鲁士蓝Fe4[Fe(CN)6]中,Fe、C、N三元素原子个数比为5:6:6D.抗癌药物顺铂[Pt(NH3)2Cl2]中,氢元素和氯元素质量比为3:7112.科学家最近制造出第112号新元素,其原子的相对原子质量为277.关于该元素的下列叙述正确的是()A.其原子核内中子数和质子数都是112B.其原子核内中子数为277,核外电子数为112C.其原子质量是碳﹣12原子质量的277倍D.其原子质量与碳﹣12原子质量之比为277:1213.在化学反应2H2+O22H2O中的最小微粒是()A.H2O B.O2C.H2D.H和O14.已知氦﹣3的原子核是由一个中子和两个质子构成的,其一个原子中,电子数为()A.1 B.2 C.3 D.515.下列对分子、原子、离子的认识,正确的是()A.原子是最小的粒子,不可再分B.分子在化学变化中可以再分C.离子不能直接构成物质D.固体难压缩,说明固体分子间无间隔16.下列变化中,最小粒子是原子的是()A.氧气溶解于水 B.水受热后汽化C.水分解生成氢气和氧气 D.贮氮气的钢瓶受热爆炸17.化学知识中有许多的“一定”和“不一定”,下列有关说法正确的是()A.原子的最外层电子数相等,则元素化学性质一定相似B.同种元素组成的物质一定是单质C.10g甲和15g乙两物质恰好反应,生成物的总质量不一定为25gD.能保持物质化学性质的最小粒子不一定是分子18.1991年我国著名化学家,测定了铟(In)元素相对原子质量新值.铟元素的核电荷数为49,相对原子质量为115.铟原子的中子数为()A.115 B.49 C.66 D.16419.我国南海海底蕴藏着丰富的含有锰、铁、铜等金属的矿物.已知锰原子的核内质子数为25,相对原子质量为55,则锰原子的核内中子数为()A.25 B.55 C.30 D.8020.2006年度世界十大科技进展新闻之一是合成118号超重元素,全球学生所熟悉的元素周期表将需要作出更新.已知该元素原子的相对原子质量为293,核电荷数为118,其核内中子数和核外电子数分别为()A.118 175 B.118 118 C.193 118 D.175 11821.我国著名化学家张青莲教授与其他科学家合作测定了铟原子相对原子质量新值,铟原子核外有49个电子,相对原子质量为115,则铟原子的中子数为()A.164 B.115 C.49 D.6622.某一种原子的相对原子质量是32,这种原子的原子核内中子数和质子数相等,则它的中子数、质子数、核外电子数分别是()A.16、32、32 B.32、32、32 C.16、16、16 D.16、16、3223.碳﹣14是碳的一种具放射性的同位素,于1940年首被发现,它是透过宇宙射线撞击空气中的氮原子所产生.科学家曾通过测定古生物遗骸中的碳﹣14含量来推断古城年代.碳﹣14原子的核电荷数为6,相对原子质量为14.下列关于碳﹣14原子的说法中,错误的是()A.中子数为6 B.质子数为6C.电子数为6 D.质子和中子数之和为1424.金属钕是最活泼的稀土金属之一,钕元素(Nd)的到来活跃了稀土领域,在稀土领域中扮演着重要角色,并且左右着稀土市场,已知钕元素在元素周期表中的原子序数为60,则下列关于钕原子的说法不正确的是()A.其核电荷数为60 B.其核内质子数为60C.其相对原子质量为60 D.其核外电子数为6025.据悉,日本大地震导致核电站核泄漏的一些辐射物中,最主要的一种辐射物是I﹣131(即相对原子质量为131),I﹣131发射的β射线可杀伤甲状腺细胞,已知I是53号元素(即核电荷数为53),下列说法正确的是()A.I﹣131核内质子数为78B.I﹣131和I﹣127互为同位素关系C.“I”可以表示固态碘这种物质D.I﹣离子核外有53个电子26.科学家曾通过测定古生物遗骸的碳﹣14含量来推测古城年代.碳14原子的核电荷数为6,相对原子质量为14.下列关于碳14原子的说法中错误的是()A.中子数为6 B.质子数为6C.电子数为6 D.质子数与中子数之和为1427.居里夫人在1898年从几吨含铀废料中提炼出0.3g镭.镭元素的核电荷数为88,相对原子质量为226,镭原子的核外电子数为()A.226 B.88 C.138 D.31428.某阴离子X2﹣的核外有18个电子,核内有18个中子,则X的相对原子质量为()A.54 B.38 C.36 D.3429.物质是由原子所组成的,原子又由电子、质子与中子等更微小的粒子所构成.若以分别代表电子、质子与中子,则下列各示意图中,何者带负电?()A.B. C.D.30.如图是核聚变燃料氦的原子结构模型.该原子核外有2个电子,则其原子核内的质子数为()A.1 B.2 C.3 D.5九年级化学第三单元第三节原子的结构练习和答案参考答案一.选择题(共30小题)1.B 2.A 3.A 4.C 5.A 6.B 7.D 8.D 9.D 10.D 11.C 12.D 13.D 14.B 15.B 16.C 17.D 18.C 19.C20.D 21.D 22.C 23.A 24.C 25.BC 26.A 27.B 28.D29.D 30.B。
九年级化学- 原子的结构
1.原子是由居于原子中心的原子核和__核外电子__构成的,原子核是由__质子__和__中子__构成的。
2.由于原子核内质子所带电荷与核外电子的电荷数量__相等__,电性__相反__,因此原子不显电性。
3.在原子中,核电荷数=核内__质子数__=核外__电子数__。
4.原子中的核外电子是分层排布的,可以用__原子结构示意图__表示。
5.相对原子质量是以__一种碳原子质量的1/12__作为标准,其他原子的__质量__与它相比较所得到的比。
6.原子结构示意图的含义:小圆圈和圈内的数字表示__原子核__和__核电荷数__,弧线表示__电子层__,弧线上的数字表示该电子层上的__电子数__。
7.稀有气体最外层有__8__个(除氦外)电子,形成相对稳定的结构;金属的原子最外层电子一般少于__4__个,在化学反应中易__失去__电子;非金属的原子最外层电子一般多于__4__个,在化学反应中易__得到__电子。
9.构成物质的的粒子除了原子、分子之外,还有__离子__,__带电__的原子叫做离子。
其中带正电的原子叫做__阳__离子,带负电的原子叫做__阴__离子。
9.原子的质量主要集中在__原子核__上,因此相对原子质量≈__质子数__+__中子数__。
小节练习题
1.原子核中一定含有的粒子是(B)
A.中子B.质子C.电子D.质子和中子
2.锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)
A.1 B.3
C.4 D.7
3.下列粒子不显电性的是(D)
A.质子B.电子
C.原子核D.分子
4. 氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是(A)
A.离子B.分子
C.原子D.中子
5. 下列关于原子结构的认识错误的是(C)
A.原子内部有相对较大的空间
B.原子由原子核和核外电子构成
C.原子由质子和中子构成
D.原子核带有正电荷
6.下列有关离子的认识错误的是(D)
A.原子失去电子,形成了阳离子
B.原子得到电子,形成了阴离子
C.离子也是构成物质的粒子
D.原子失去电子后带负电荷
7.下列结构示意图中,表示阴离子的是(D)
8.下图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。
下列说法正确的是(D)
A.该原子核外有6个电子B.该原子的核电荷数为4
C.该原子带电D.该原子核由2个质子和2个中子构成
9. 作为相对原子质量标准的1个碳原子的质量是1.993×10-26kg,一种氢原子1个原子的质量为3.348×10-27kg,则该氢原子的相对原子质量为(B)
A.1 B.2 C.3 D.4
10.联合国把2019年定为“国际化学元素周期表年”。
俄国化学家门捷列夫对元素周期表的编
制作出巨大贡献,人们将101号元素命名为“钔”来纪念他。
钔原子的核电荷数为101,相对原子质量为258,则钔原子的质子数为(A)
A.101 B.157
C.258 D.359
11.下列关于原子、分子、离子的说法正确的是(A)
A.原子由原子核和核外电子构成
B.离子中核电荷数一定等于电子数
C.原子核的质量约等于电子的质量
D.分子是由原子、离子构成的
12.下图是钠(Na)与氯气(Cl2)反应生成氯化钠的模拟图。
从图中可知,下列说法中不正确的是(D)
A.该反应中1个钠原子转移1个电子给1个氯原子
B.该反应中氯气分子分解成氯原子
C.最外层电子数在化学反应中起着重要作用
D.氯化钠由氯化钠离子构成
13.关于下列四种粒子的结构示意图说法正确的是(D)
A.①、②的化学性质相似
B.②所示的粒子为阴离子
C.③在化学反应中易失去电子
D.④中x可能为8
14.(2019·江苏苏州工业园期中)爆炸性的高能N+5粒子(N的质子数为7)被美国加州爱德华空军基地研究高能材料的化学家合成。
关于N+5的说法正确的是(A)
A.该粒子的电子数为34
B.它是一种由5个氮原子构成的单质分子
C.该粒子由5个氮分子构成
D.该粒子的质子数为34
15.下列是几种粒子的结构示意图,有关说法错误的是(B)
A.粒子①易得到电子
B.粒子②和④核外电子排布相同,属于同种原子
C.粒子③易形成带1个单位正电荷的钠离子
D.粒子④带2个单位正电荷
16.已知某原子的核电荷数为a,原子核内有b个质子和c个中子,核外有d个电子,则(D) A.a=b=c B.b=c=d
C.a=c=d D.a=b=d
17.下图例为镁原子的结构示意图,下列所示粒子化学性质与其相似的是(D)
图例
18.下列叙述中错误的是(B)
①原子是化学变化中的最小粒子;
②原子是不能再分的粒子;
③一切物质都是由原子直接构成的;
④一切原子核都是由质子和中子构成的;
⑤原子不显电性;
⑥原子之间有间隔。
A.①②B.②③④
C.③⑤D.③⑥
19.下图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是(C)
A.该原子核外有4个电子
B.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同
D.a、b、c三种粒子构成了原子核
20.下图是部分原子的结构示意图:
(1)上述结构图中的x=__5__。
(2)硅原子的结构示意图为,上图中与其化学性质相似的原子是__C__(填字母)。
(3)根据图示信息,确定1个水分子(H2O)中所含电子总数为__10__。
21.下列粒子的结构示意图中,表示钠原子的是(A)
22.根据如图所示的原子结构示意图,不能确定的是(B)
A.最外层电子数
B.中子数
C.质子数
D.电子层数
23.下图为某原子的结构示意图,下列说法错误的是(C)
A.该原子有3个电子层
B.该原子的核电荷数为11
C.该原子属于非金属的原子
D.该原子在化学反应中容易失去电子
24.下图是A、B、C、D四种原子的结构示意图,回答下列问题:
(1)B原子的最外层有__1__个电子,在化学反应中易__失去__(填“失去”或“得到”)电子。
(2)上述四种原子中属于金属原子的是__B__,属于稀有气体原子的是__A__;化学性质相似的是__C和D__。
25.下图是A、B、C、D四种粒子的结构示意图,回答下列问题:
(1)A、B、C中属于离子的是__B__(填字母)。
(2)若D表示原子,则m=__7__,该原子在化学反应中容易__得到__(填“得到”或“失去”)电子形成__阴离子__(填“阴离子”或“阳离子”)。