2020届高考化学二轮复习 高考选择客观题:电解质溶液有关图像题型的专题复习
- 格式:ppt
- 大小:2.43 MB
- 文档页数:12

专题检测七 电解质溶液一、选择题(每小题6分,共60分)1.水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型见右图。
下列关于水的说法正确的是( )A .水是弱电解质B .可燃冰是可以燃烧的水C .氢氧两种元素只能组成水D .0 ℃时冰的密度比液态水的密度大解析:可燃冰是甲烷水合物,不是水,B 错误;氢氧两种元素除组成水外,还能组成H 2O 2,C 错误;水结成冰后密度减小,D 错误。
答案:A2.下列有关电解质溶液中粒子浓度关系正确的是( )A .pH =1的NaHSO 4溶液:c (H +)=c (SO 2-4)+c (OH -)B .含有AgCl 和AgI 固体的悬浊液:c (Ag +)>c (Cl -)=c (I -)C .CO 2的水溶液:c (H +)>c (HCO -3)=2c (CO 2-3)D .含等物质的量的NaHC 2O 4和Na 2C 2O 4的溶液:3c (Na +)=2[c (HC 2O -4)+c (C 2O 2-4)+c (H 2C 2O 4)]解析:因为NaHSO 4溶液中存在c (Na +)=c (SO 2-4),依据电荷守恒:c (Na +)+c (H +)=2c (SO 2-4)+c (OH -),可知c (H +)=c (SO 2-4)+c (OH -),A 项正确;AgCl 的溶解度比AgI 的大,所以c (Ag +)>c (Cl -)>c (I -),B 项错误;CO 2水溶液中存在:H 2CO 3++HCO -3,HCO -3++CO 2-3和H 2++OH -,H 2CO 3的第一步电离远大于第二步电离,所以c (H +)>c (HCO -3)>c (CO 2-3),C 项错误;假设NaHC 2O 4和Na 2C 2O 4均为1 mol ,则n (Na +)=3 mol ,依据物料守恒n (HC 2O -4)+n (C 2O 2-4)+n (H 2C 2O 4)=2 mol ,同一溶液中存在2c (Na +)=3[c (HC 2O -4)+c (C 2O 2-4)+c (H 2C 2O 4)],D 项错误。

热点专攻10 电解质溶液图像题1.(2019天津理综)某温度下,HNO 2和CH 3COOH 的电离常数的值分别为5.0×10-4和1.7×10-5。
将pH 和体积均相同的两种酸溶液分别稀释,其pH 随加水体积的变化如图所示。
下列叙述正确的是( )A.曲线Ⅰ代表HNO 2溶液B.溶液中水的电离程度: N 点>P 点C.从P 点到Q 点,溶液中保持不变(其中HA 、A -分别代表相应的酸和酸根离子)c (HA )·c (OH -)c (A -)M 点的两溶液分别与NaOH 恰好中和后,溶液中n (Na +)相同,酸性:HNO 2>CH 3COOH,pH 相同的两种酸稀释相同倍数,pH 变化大的是相对较强的酸,即曲线Ⅱ表示HNO 2溶液的稀释,A 项错误;pH 越小酸性越强,对水电离的抑制程度越大,因此溶液中水的电离程度:N 点<P 点,B 项错误;题给表达式可看作,K W K a 稀释时温度不变,则K W 、K a 均不变,C 项正确;起始pH 相同时c (CH 3COOH)大,则与NaOH 恰好中和时,CH 3COOH 溶液消耗氢氧化钠多,对应溶液中n (Na +)大,D 项错误。
2.已知t ℃时的K sp (AgCl)=1.6×10-10,K sp (AgBr)=7.8×10-13;在t ℃时,Ag 2CrO 4在水中的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )A.t ℃时,K sp (Ag 2CrO 4)=1×10-9B.t ℃时,在饱和Ag 2CrO 4溶液中加入AgNO 3可使溶液由Z 点到X 点C.t ℃时,溶解度的大小顺序为AgCl>Ag 2CrO 4>AgBrD.t ℃时,取一定量的KCl 和KBr 的混合溶液,向其中滴加AgNO 3溶液,当AgCl 开始沉淀时,c (Cl -)c (Br -)=K sp (AgCl )K sp (AgBr )℃时,K sp (Ag 2CrO 4)=(10-3)2×10-6=1×10-12,A 项错误;在饱和Ag 2CrO 4溶液中加入AgNO 3可使溶液由Z 点到Y 点,处于饱和状态,不能由Z 点到X 点,B 项错误;由K sp 可以计算AgCl 、Ag 2CrO 4、AgBr 在水中c (Ag +)的数量级是10-5、10-3、10-6.5,故溶解度的大小顺序为Ag 2CrO 4>AgCl>AgBr,C 项错误;t ℃时,取一定量的KCl 和KBr 的混合溶液,向其中滴加AgNO 3溶液,当AgCl 开始沉淀时,AgBr 已经沉淀,,D 项正确。
高考化学二轮复习难点专题电解质溶液曲线分析【命题规律】本专题的考查点主要是弱电解质的电离平衡和盐类水解相结合,进行综合考察。
为高考的中频考点,命题形式以选择题为主,试题难度中等。
考查的核心素养以证据推理与模型认知为主。
【备考建议】2020年高考备考应重点关注数形结合与分析推理型选择题。
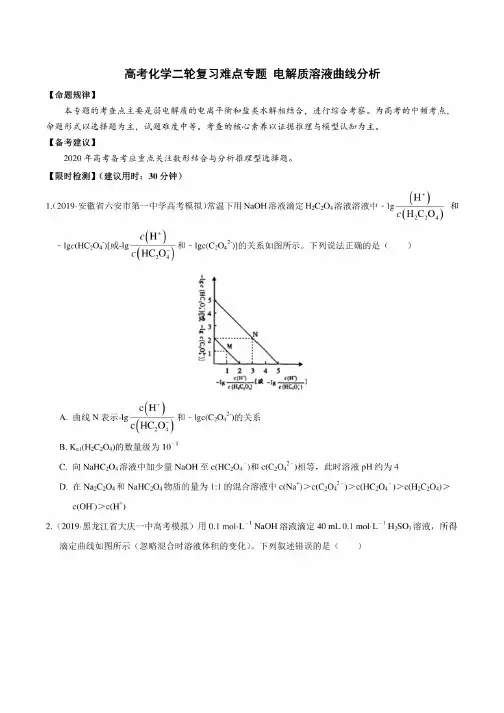
【限时检测】(建议用时:30分钟)1.(2019-安徽省六安市第一中学高考模拟)常温下用NaOH溶液滴定H2C2O4溶液溶液中和-lgc(HC2O4)[或-lgc(H')c(HC2O;)和-lgc(C2O42)]的关系如图所示。
下列说法正确的是('Mcxcqm'tgoth123458r(H/:,OJ*e(HC,OJc(H+)A.曲线N表示-lg—气和-lgc(C2O42_)的关系c(HC2O;)B.K al(H2C2O4)W数量级为101C.向NaHC2O4溶液中加少量NaOH至c(HC2O「)和c(C2O42-)ffl^.此时溶液pH约为4D.在Na2C2O4和NaHC2O4物质的量为1:1的混合溶液中c(Na+)>c(C2O42)>c(HC2O4)>c(H2C2O4)>c(OH)>c(H+)2.(2019-黑龙江省大庆一中高考模拟)用0.1mol-L1NaOH溶液滴定40mL0.1mol-L^1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。
下列叙述错误的是()A.K a2(H2SO3)的数量级为IO®B.若滴定到第一反应终点,可用甲基橙作指示剂C,图中Z点对应的溶液中:c(Na+)>c(SO32_)>c(HSO3_)>c(OH-)D,图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH^)3.(2019.东北育才学校科学高中部高考模拟)常温下向2OmLO.lmol/L氨水中通入HC1气体,溶液中由水电离出的氢离子浓度随通入HC1气体的体积变化如图所示。
2020届高考化学提分攻略题型13 电解质溶液图像题一、解题策略1.审题:弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的原点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率的大小及升降。
2.信息提取:挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。
3.答题:联想化学原理,根据选项内容,确定正确选项。
二、题型分析【典例1】【2019·课标全国Ⅱ,12】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。
硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。
下列说法错误的是()A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的K sp的关系为:K sp(m)=K sp(n)<K sp(p)<K sp(q)C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动【答案】B【解析】a、b分别表示温度为T1、T2时溶液中Cd2+和S2-的物质的量浓度,可间接表示对应温度下CdS在水中的溶解度,A项正确;K sp只受温度影响,即m、n、p三点对应的K sp相同,又T1→T2,c(S2-)、c(Cd2+)都增大,故K sp(m)=K sp(n)=K sp(p)<K sp(q),B项错误;向m点的溶液中加入少量Na2S固体,溶液中c(S2-)增大,温度不变,K sp不变,则溶液中c(Cd2+)减小,溶液组成由m点沿mpn线向p方向移动,C 项正确;温度降低时,CdS的溶解度减小,q点的饱和溶液的组成由q沿qp线向p方向移动,D项正确。
【典例2】【2018·课标全国Ⅲ,12】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线如图所示。

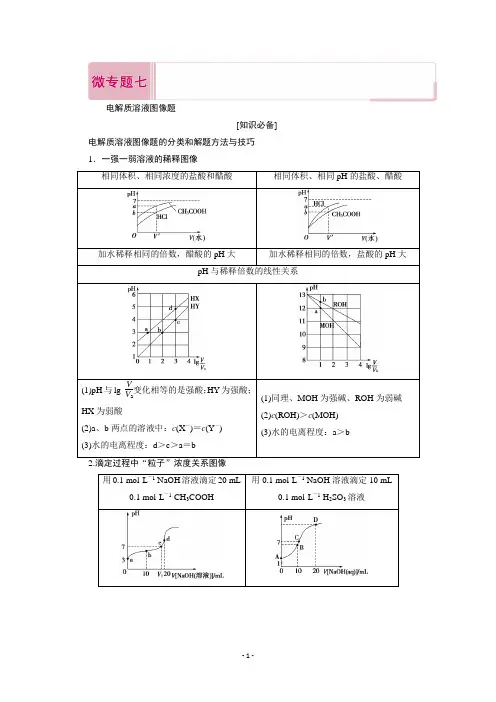
电解质溶液图像题[知识必备] 电解质溶液图像题的分类和解题方法与技巧1.一强一弱溶液的稀释图像相同体积、相同浓度的盐酸和醋酸相同体积、相同pH的盐酸、醋酸加水稀释相同的倍数,醋酸的pH大加水稀释相同的倍数,盐酸的pH大pH与稀释倍数的线性关系(1)pH与lgVV a变化相等的是强酸;HY为强酸;HX为弱酸(2)a、b两点的溶液中:c(X-)=c(Y-)(3)水的电离程度:d>c>a=b(1)同理、MOH为强碱、ROH为弱碱(2)c(ROH)>c(MOH)(3)水的电离程度:a>b用0.1 mol·L-1 NaOH溶液滴定20 mL0.1 mol·L-1 CH3COOH用0.1 mol·L-1 NaOH溶液滴定10 mL0.1 mol·L-1 H2SO3溶液(1)巧妙抓住“一半”“恰好”“中性”“过量”“二倍”点,突破“粒子”浓度关系(2)抓住“关键点”中以下问题:①参加反应溶质量的关系②溶质的成分③溶质中各成分量的关系④溶液的酸碱性等(3)正确使用电荷守恒和物料守恒解决问题3.分布系数与pH关系曲线图像一元弱酸(以CH3COOH为例) 二元酸(以草酸H2C2O4为例)δ0为CH3COOH分布系数,δ1为CH3COO-分布系数δ0为H2C2O4分布系数、δ1为HC2O-4分布系数、δ2为C2O2-4分布系数利用曲线的交点确定弱电解质每步的电离常数K1、K2、K3…根据图像确定不同pH点微粒间的关系H2Y与NaOH溶液的反应H2X与NaOH溶液的反应(1)识图像:观察横坐标、纵坐标含义,找到横坐标的零点,即lg c(HX-)c(H2X)=0和lgc(X2-)c(HX-)=0的点。
(2)找联系:二元弱酸H2X分步电离,H2X H++HX-,HX-H++X2-,第一步电离要远远大于第二步的电离,即K1>K2、c(H+)1>c(H+)2。
(3)思原理:涉及到电离平衡常数,写出K1(H2X)=c(H+)·c(HX-)c(H2X),K2(H2X)=c(H+)·c(X2-)c(HX-);横坐标在0点时,可以看出N曲线的pH小,酸性强,则曲线N表示pH与lgc(HX-)c(H2X)的关系,曲线M表示pH与lgc(X2-)c(HX-)的关系。


2020届高三化学高考专题复习——电解质溶液中的图像分析1、弱酸H2A 溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知δ(X) = ],下列说法不正确的是(图中:a=1.25、b=4.27)()A. 已知pK a=-lgK a,则pK a1=1.25B. 0.1mol·L-1的NaHA溶液显碱性C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+)D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-12、常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是()A. 当V( NaOH )= 20mL时,pH<7B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)3、25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
下列说法错误的是()A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)C. 25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)4、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是( )A. H2A的电离方程式为:H2A==H++HA-HA-A2-+H+C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)5、室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V[HCl(aq)]的变化关系如图所示。


2020届高三化学高考专题复习:电解质溶液中强碱滴定二元弱酸曲线分析电解质溶液1、常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示, 下列说法正确的是( )A.当V(NaOH溶液)< 10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)B.当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大C.当V(NaOH溶液) =15 mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)D.当V(NaOH溶液)=20mL时,溶液中存在:c(OH-) =2c(H2C2O4)+c(H+)+c(HC2O4-)2、已知:pKa=-lgKa,25℃时,H2A的pK a1=1.85,pK a2=7.19,用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示。
下列说法正确的是( )A.c点所得溶液中: c(A2-)=c(HA-)B.b 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)C.A2-水解平街常数K h(A2-)=10-7.19D.a点所得溶液中,V0=10mL3、常温下,向10mL 0.2mol·L-l草酸(H2C2O4)溶液中逐滴加入等浓度的NaOH溶液。
有关微粒的物质的量与混合溶液的pH有如右图关系,下列说法正确的是( )A.HC2O4-在溶液中水解程度大于电离程度B.当V (NaOH) =10 mL时溶液中存在:c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol·L-lC.当V (NaOH) =15mL时,溶液中存在:c(Na+)>c(HC2O4-)>c(C2O42-)>c (OH-)>c(H+)D.当V (NaOH) =20 mL时,溶液中存在:c(OH-) =c (HC2O4-)+c (H2C2O4)+c(H+)4、已知:常温下,H2CO3K a1=4.2×10-7,K a2=5.6×10-11;某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(a)随溶液pH 变化关系如下图所示,下列叙述错误的是( )A.在pH=4.4 的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-)B.向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R==2HCO3-+R2-C.等体积等浓度的NaOH 溶液与H2R溶液混合,所得溶液中水的电离程度比纯水大D.在pH=3 的溶液中,三种微粒的浓度满足关系式: c(R2-)c(H2R)/c(HR-)2=10-3.15、常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数随pH变化的关系如图所示.下列表述正确的是( )A.在含H2A、HA-、A2-的溶液中,通入少量HCl,HA-的物质的量分数一定变大B.将等物质的量的NaHA、Na2A溶于水中,所得溶液中存在:c(Na+)+c(H+)=c(HA-)+c(A2-)+c(OH-)C.在0.1mol/L NaHA 溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)D.将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.26、常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。
考前强化练14 电解质溶液图像题1.(2018安徽江淮十校高三联考)25 ℃时,用0.10 mol·L-1的氨水滴定10.00 mL a mol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。
已知N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法不正确的是( )A.图上四点离子种类相同B.a=0.108C.N、Q两点的:N>QD.M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+c(N)答案C解析盐酸与氨水混合后的溶液中只含有H+、N、OH-、Cl-四种离子,所以图上四点离子种类相同,故A项正确;N点溶液中存在的电荷守恒式为:c(H+)+c(N)=c(OH-)+c(Cl-),已知N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),联立得:c(NH3·H2O)+c(N)=c(Cl-),说明N点溶液中的溶质只有NH4Cl,即滴加10.8 mL氨水时恰好与盐酸完全中和,所得溶液为NH4Cl溶液,由NH3·H2O+HCl NH4Cl+H2O可知:0.10 mol·L-1×10.8×10-3L=a mol·L-1×10.00×10-3L,则a=0.108,故B项正确;,NH3·H2O的电离常数K b(NH3·H2O)只随温度的变化而变化,恒温下电离常数不变,即N、Q两点的值相等,故C项错误;M点滴加氨水5.4 mL,完全反应后所得溶液为等浓度的HCl和NH4Cl的混合溶液,溶液中存在电荷守恒c(H+)+c(N)=c(OH-)+c(Cl-)和物料守恒2c(NH3·H2O)+2c(N)=c(Cl-),联立可得c(H+)=c(OH-)+2c(NH3·H2O)+c(N),故D项正确。
2020届届届届届届届届届12届届届届届届届——沉淀溶解平衡曲线图形分析(大题专练)1.常温下,向10mL0.10mol/L CuCl2溶液中滴加0.10mol/L Na2S溶液,滴加过程中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。
下列说法正确的是()A. K sp(CuS)的数量级为10−21B. 曲线上a点溶液中,c(S2−)⋅c(Cu2+)>K sp(CuS)C. a、b、c三点溶液中,n(H+)和n(OH−)的积最小的为b点D. c点溶液中:c(Na+)>c(Cl−)>c(S2−)>c(OH−)>c(H+)2.已知pCa=−lgc(Ca2+),K sp(CaSO4)=9.0×10−6,K sp(CaCO3)=2.8×10−9,向10mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO2溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知lg3=0.48)A. Y值为3.48B. a与b两点c(Ca2+)之比为50:3C. 原CaCl2溶液浓度为1mol/LD. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分3.常温下,用0.100mol·L−1的NH4SCN溶液滴定25.00mL0.100mol·L−1AgNO3溶液,以NH4Fe(SO4)2·12H2O为指示剂,测得溶液中pSCN=‒lgc(SCN−)、pAg=‒lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。
已知:Ag++SCN−⇌AgSCN↓,K sp(Ag2SO4)=1.4×10−5。
下列说法错误的是()A. 滴定至终点时溶液颜色变为红色,且振荡后不褪色B. 该温度下AgSCN的溶度积常数K sp=1.0×10−12C. 为防止指示剂失效,溶液应维持酸性D. 当加入15.00mLNH4SCN溶液时,溶液中c(SO42−)=0.14mol·L−14.某温度下,向20mL0.1mol·L−1BaCl2溶液中滴加0.1mol·L−1Na2CO3溶液,滴加过程中−lgc(Ba2+)与Na2CO3溶液体积的关系如图所示[已知:lg2=0.3,K sp(MgCO3)=3.5×10−8]。