高三化学:强弱电解质的判断.
- 格式:ppt
- 大小:979.00 KB
- 文档页数:24

高三化学之电解质溶液什么是电解质溶液?电解质溶液是由电解质及其溶剂水组成的溶液,其中电解质能够在溶液中以离子形式存在。
在电解质溶液中,正负离子被水分子包围,并与周围水分子形成溶剂化层。
电解质溶液通常能够导电,因为溶液中的离子能够在电场的作用下迁移。
电解质的分类电解质可分为强电解质和弱电解质两种。
强电解质强电解质在溶液中完全电离,生成大量离子。
常见的强电解质有盐酸(HCl)、硫酸(H2SO4)和氯化钾(KCl)等。
在溶液中,这些电解质完全分解为阴离子和阳离子。
例如,HCl完全电离为H+(氢离子)和Cl-(氯离子)。
弱电解质弱电解质在溶液中只有部分离解,并生成少量离子。
弱电解质的离解度较低,溶液中大部分是以分子形式存在。
常见的弱电解质有乙酸(CH3COOH)、氨(NH3)和醋酸(CH3COONa)等。
在溶液中,这些电解质只部分分解为阴离子和阳离子。
电解质溶液的导电性由于电解质溶液中存在离子,它们能够在电场的作用下迁移,因此电解质溶液是良好的导电体。
电解质溶液的导电机理电解质溶液的导电机理可以用离子迁移解释。
当外加电场施加在电解质溶液中时,正离子被电场推向负电极,负离子被电场推向正电极。
电解质溶液的导电性主要取决于以下因素:1.电解质的浓度:电解质的浓度越高,溶液中的离子数量越多,导电性越强。
2.电解质的离子价数:离子价数越高,电解质的导电性越好。
因为离子价数越高,每个离子携带的电荷越多。
3.温度:温度越高,电解质溶液的导电性越好。
因为高温能够促进离子迁移,并降低电解质溶液的电阻。
电解质溶液的电导率电解质溶液的导电性程度可以用电导率来表示。
电导率是指单位长度和单位截面积的溶液在单位电压下的电流强度。
电导率的单位是西门子/米(S/m)。
电导率越高,溶液的导电性越强。
电解质溶液的影响因素电解质溶液的性质可以受到一些因素的影响,以下是一些常见的影响因素:1.温度:随着温度的升高,电解质溶液的离子迁移速度加快,导电性增强。

2022-2023学年安徽省滁州市天长第二中学高三化学摸底试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 判断下列有关化学基本概念的依据正确的是()A. 氧化还原反应:元素化合价是否变化B. 共价化合物:是否含有共价键C . 强弱电解质:溶液的导电能力大小D. 金属晶体:晶体是否能够导电参考答案:答案:A考点:本题考查的是基本概念。
解析:只含共价键的化合物是共价化合物,而单质也可以有共价键如氯气,故B错;强弱电解质的判断依据是在水溶液中的电离程度而非导电性,溶液的导电能力与溶液中可自由移动离子浓度及离子所带电荷数有关,强电解质的稀溶液导电性也可能会很弱,而弱电解质的浓溶液导电性也可能会较强,故C错。
某些非金属晶体也可导电,如:石墨、硅等,故D错。
2. 下列离子方程式错误的是()A.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH ̄=Al(OH)↓+AlO2 ̄+2H2O3B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2OC.少量二氧化硫通入次氯酸钠溶液:SO2+2ClO﹣+H2O=SO32﹣+2HClOD.硫化亚铁加入稀硫酸:FeS+2H+=H2S↑+Fe2+参考答案:C考点:离子方程式的书写..专题:离子反应专题.分析:A.将2mol/L AlCl3溶液和7mol/L NaOH溶液等体积混合,3<n(Al3+):n(OH  ̄)<4,所以产物中既有Al(OH)3又有AlO2 ̄;B.醋酸溶液与水垢中的CaCO3反应生成醋酸钙和二氧化碳和水;C.次氯根具有强氧化性能够氧化亚硫酸根离子;D.稀硫酸的酸性强于氢硫酸.解答:解:A.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合,离子方程式为:2Al3++7OH ̄=Al(OH)3↓+AlO2 ̄+2H2O,故A正确;B.醋酸溶液与水垢中的CaCO3反应,离子方程式:CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O,故B正确;C.少量二氧化硫通入次氯酸钠溶液,离子方程式:SO2+3ClO﹣+H2O=2HClO+SO42﹣+Cl﹣,故C错误;D.硫化亚铁加入稀硫酸,离子方程式:FeS+2H+=H2S↑+Fe2+,故D正确;故选:C.点评:本题考查离子方程式的书写,题目难度不大,明确反应的实质是解题关键,注意从化学式、离子符号、电荷守恒以及反应物用量对反应的影响,选项A为易错选项.3. 下列表示对应化学反应的离子方程式正确的是A.用浓盐酸酸化的K M n O4溶液与H2O2反应,证明H2O2具有还原性:2MnO + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2OB.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2N a+ + 2O H- + O2↑C.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+D.向NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O=2Al(OH)3↓+CO2参考答案:C略4. 2006年10月16日,美国劳伦斯·利弗莫尔国家实验室宣布,美、俄科学家合作,用大量钙-48离子轰击人造元素锎-249,合成了3个新原子,其存在时间只有0.9毫秒。

高三化学复习:离子反应(一)电解质与非电解质,强电解质与弱电解质:1、电解质和非电解质a)在水溶液中或熔化状态能导电的化合物叫电解质,在水溶液中和熔化状态都不能导电的化合物叫非电解质。
b)电解质有酸、碱、盐、水、活泼金属氧化物等,其它化合物一般均为非电解质。
酸在水溶液中导电,强碱、大多数盐在熔化状态和水溶液中都导电,活泼金属氧化物只在熔化状态导电。
电解质导电靠自由移动的离子,自由移动的离子浓度越大、所带电荷越多则导电能力越强。
2、强电解质和弱电解质a)在水溶液中能全部电离不存在电离平衡的电解质为强电解质,强电解质有强碱、强酸和大多数盐。
它们的电离方程式写“===”号,多元强酸电离不分步,如:NaOH==Na++OH-Ca(OH)2===Ca2++ 2OH-H2SO4===2H++ SO42-Fe2(SO4)3===2Fe3++3SO42-b)在水溶液中部分电离存在电离平衡的电解质为弱电解质,弱电解质有弱酸、弱碱和水等。
它们的电离方程式写“可逆”号,多元弱酸电离分步,每步电离出一个H+,以第一步电离为主,如:NH3·H2ONH4++OH-CH3COOH CH3COO-+ H+H2CO3H++ HCO3-(为主),HCO3-H++CO32-H2O+H2O H3O++OH-(或简单写为H2O H++OH-)3、某些类型电解质电离的表示方法:两性氢氧化物:H+ + AlO2-+H2O Al(OH)3Al3+ + 3OH-强酸的酸式盐:NaHSO4Na+ + H+ + SO42-弱酸的酸式盐:NaHCO3Na+ + HCO3-复盐:KAl(SO4)2K+ + Al3+ + 2SO42-络合物:Ag(NH3)2OH Ag(NH3)2++OH-Na3AlF63Na++ AlF63-说明:1、电解质溶液导电的原因与金属导电的原因不同:电解质溶液导电是由于电离产生自由移动的阴、阳离子在外加电场作用下定向移动而导电,而金属导电则是由于金属晶体内部的自由电子在外加电场作用下的定向移动。

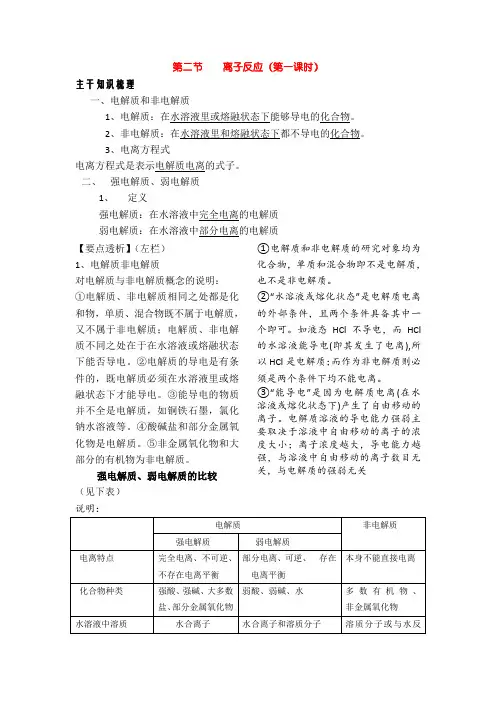
第二节离子反应(第一课时)主干知识梳理一、电解质和非电解质1、电解质:在水溶液里或熔融状态下能够导电的化合物。
2、非电解质:在水溶液里和熔融状态下都不导电的化合物。
3、电离方程式电离方程式是表示电解质电离的式子。
二、强电解质、弱电解质1、定义强电解质:在水溶液中完全电离的电解质弱电解质:在水溶液中部分电离的电解质【要点透析】(左栏)1、电解质非电解质对电解质与非电解质概念的说明:①电解质、非电解质相同之处都是化和物,单质、混合物既不属于电解质,又不属于非电解质;电解质、非电解质不同之处在于在水溶液或熔融状态下能否导电。
②电解质的导电是有条件的,既电解质必须在水溶液里或熔融状态下才能导电。
③能导电的物质并不全是电解质,如铜铁石墨,氯化钠水溶液等。
④酸碱盐和部分金属氧化物是电解质。
⑤非金属氧化物和大部分的有机物为非电解质。
强电解质、弱电解质的比较(见下表)说明:①电解质和非电解质的研究对象均为化合物,单质和混合物即不是电解质,也不是非电解质。
②“水溶液或熔化状态”是电解质电离的外部条件,且两个条件具备其中一个即可。
如液态HCl不导电,而HCl 的水溶液能导电(即其发生了电离),所以HCl是电解质;而作为非电解质则必须是两个条件下均不能电离。
③“能导电”是因为电解质电离(在水溶液或熔化状态下)产生了自由移动的离子。
电解质溶液的导电能力强弱主要取决于溶液中自由移动的离子的浓度大小;离子浓度越大,导电能力越强,与溶液中自由移动的离子数目无关,与电解质的强弱无关1.为什么说酸、碱、盐是电解质?从电离角度看,酸、碱、盐在一定条件下都能够电离而导电,所以说它们都是电解质。
2.SO2、SO3、NH3的水溶液可以导电,为什么它们不是电解质?电解质与非电解质的本质区别是在水溶液或熔融状态下自身能否电离,而其水溶液是否导电只是这个本质决定的一种性质而已。
SO2、SO3、NH3的水溶液可以导电,是因为它们与水反应生成的物质能电离而导电,而SO2、SO3、NH3它们自身不电离,所以它们不是电解质。

高三化学电解质试题答案及解析1.向盛有一定量的Ba(OH)2的溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示),近似地用如右图曲线表示,应为【答案】C【解析】溶液的导电能力与溶液中离子的浓度有关。
氢氧化钡是强电解质,向其中加入硫酸,则会生成硫酸钡沉淀和水,硫酸钡是难溶电解质,水是弱电解质,离子浓度减小所以溶液的导电能力减小,当二者恰好完全反应生成硫酸钡、水时。
此时溶液的导电能力为0,继续加入硫酸,溶液中的离子浓度增大,溶液的导电能力又增大,所以选择C。
【考点】考查溶液导电能力的判断2.下列叙述中正确的是 ()。
A.物质的溶解过程,实质上就是其电离过程B.三氧化硫的水溶液能导电,所以三氧化硫是电解质C.1 L 0.1 mol·L-1的H2SO4溶液中含有0.2 mol H+D.1 L 0.1 mol·L-1的H2SO3溶液中含有0.2 mol H+【答案】C【解析】非电解质溶解时不存在电离的过程,A错误;三氧化硫本身不能电离出离子,SO3是非电解质,B错误;H2SO4是强电解质,能完全电离,而H2SO3是弱电解质,只能部分电离,C正确,D错误。
3.下列物质属于电解质的是()A.NaCl溶液B.SO3C.Na2O D.Cu【答案】C【解析】NaCl溶液属于混合物,SO3属于非电解质,Cu属于单质。
4.下列有关化学用语的表示正确的是A.中子数为20的氯原子符号为B.乙烯的结构简式为CH2CH2C.C60和石墨互为同位素D.NaHCO3的电离方程式为NaHCO3=Na++ HCO3-【答案】D【解析】A、中子数为20的氯原子质量数为37,左上角为37,错误;B、乙烯的结构简式为CH2=CH2,错误;C、C60和石墨互为同素异形体,错误;D、NaHCO3为强电解质,完全电离,电离方程式为:NaHCO3=Na++ HCO3-,正确。
【考点】本题考查化学用语。

强弱电解质的判断方法一、选择题1、下列说法正确的是( )A.弱电解质溶液的导电能力一定比强电解质溶液弱B.将等体积、等浓度的NaOH溶液和氨水各稀释一倍后,两者中和等浓度盐酸的能力氨水强于NaOH溶液C.物质的量浓度相同的磷酸钠溶液和磷酸溶液所含PO43-浓度也相同D.如果盐酸中c(H+)是醋酸溶液中c(H+)的2倍,则c (HCl) <2c (CH3COOH)2、室温下将l0mL c(H+)=0.00lmol/L的醋酸溶液加水稀释10倍后,下列说法正确的是( )A.醋酸的电离程度增大,c(H+)亦增大B.C.溶液中导电粒子的数目增多D.再加入l0mL c(OH-)=0.00lmol/L的NaOH溶液,混合液呈中性3、在相同温度时,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比较,下列数值中,前者大于后者的是()A.H+的物质的量B.醋酸的电离常数C.中和时所需NaOH的量D.CH3COOH的物质的量下列判断不正确的是A.0.1 mo1·L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/LB.c1一定大于0.2 mo1·L-1C.甲反应后的溶液中:HA占含A微粒总数的0.02%D.乙反应后的溶液中:c(Na+)<c(HA)+c(A一)5、室温下,不能比较H2CO3与H2SO3酸的强弱的是A.相同条件下,比较H2CO3溶液与H2SO3溶液的导电能力B.相同条件下,比较Na2CO3溶液与Na2SO3溶液的碱性C.相同条件下,比较H2CO3与H2SO3溶液消耗同一碱溶液的体积D.相同条件下,比较Na2CO3与Na2SO3溶液的pH6、不能证明乙酸是弱酸的实验事实是A.相同温度下,Zn粉分别与同浓度的CH3COOH溶液、盐酸反应,与醋酸反应生成H2的速率慢B.0.1 mol/L CH3COONa溶液的pH大于7C.CH3COOH溶液与NaCO3反应生成CO2D.pH 为2的CH3COOH溶液1mL,加水稀释到10mL时pH大于2小于37、室温下,下列事实不能说明NH3·H2O为弱电解质的是()A.0.1 mol·L-1NH3·H2O的pH小于13B.0.1 mol·L-1NH4Cl溶液的pH小于7C.相同条件下,浓度均为0.1 mol·L-1NaOH溶液和氨水,氨水的导电能力弱D.0.1 mol·L-1NH3·H2O能使无色酚酞溶液变红色8、pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积V的关系如图所示。

高三化学电解质知识点总结电解质是指在水溶液或熔融状态下能够导电的化合物,可以根据其电离程度的不同分为强电解质和弱电解质。
在高三化学中,电解质是一个重要且基础的知识点,下面将对电解质的性质、分类和相关概念进行总结。
1. 电解质的性质电解质在溶液中能够导电,这种导电现象是由于其分子或离子在溶液中的电离产生的。
电解质可以分为强电解质和弱电解质。
强电解质在溶液中的电离程度较高,能够完全电离,产生大量的离子。
而弱电解质在溶液中的电离程度较低,只有部分分子能够电离,并且产生的离子比较少。
2. 电解质的分类根据电解质所产生的离子种类的不同,电解质可以分为无机电解质和有机电解质。
其中,无机电解质是由无机化合物形成的,包括酸、碱和盐。
有机电解质是由有机化合物形成的,特点是分子中含有离子化的官能团。
3. 酸、碱和盐酸是一类能够在水溶液中产生H+离子的物质。
酸的性质包括酸味、腐蚀性和电离性。
碱是一类能够在水溶液中产生OH-离子的物质。
碱的性质包括碱味、腐蚀性和电离性。
盐是酸和碱反应生成的物质,可以通过酸碱中和反应得到。
4. 强电解质和离子反应强电解质在溶液中完全电离,产生大量的离子。
离子之间可以发生各种化学反应,例如,沉淀反应、酸碱中和反应和氧化还原反应等。
这些反应是物质的化学性质表现,对深入理解电解质的特性具有重要意义。
5. 电解质在电解过程中的应用电解质具有良好的导电性和电解性质,因此在电解过程中扮演着重要角色。
一个典型的例子是电池,电池通过电解质在两个电极之间传递离子来产生电能。
此外,电镀、电解析和电渗析等过程中,电解质也发挥了关键作用。
6. 电解质的应用领域电解质的应用领域非常广泛。
在生活中,电解质被用于制作肥皂、玻璃和化妆品等。
在工业上,电解质的应用包括金属的电镀和金属的提取等。
此外,电解质还在环境保护、医学以及农业等领域发挥着重要作用。
总结:电解质是高三化学中的重要知识点,涉及到电离和导电等基本概念。
理解电解质的性质、分类和相关概念,对于深入理解化学反应和应用具有重要意义。

如何判断一个物质是否是电解质?在水溶液里或熔融状态下能导电的化合物叫电解质。
化合物导电的前提:其内部存在着自由移动的阴阳离子。
离子化合物在水溶液中或熔化状态下能导电;共价化合物:某些也能在水溶液中导电(如HC,其它为非电解质)导电的性质与溶解度无关,强电解质一般有:强酸强碱,大多数盐;弱电解质一般有:(水中只能部分电离的化合物)弱酸(可逆电离,分步电离<多元弱酸>。
另外,水是极弱电解质。
注:能导电的不一定是电解质判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其晶体结构和化学键的性质等因素。
例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质。
硫酸钡难溶于水(20 ℃时在水中的溶解度为2.4×10-4 g),溶液中离子浓度很小,其水溶液不导电,似乎为非电解质。
但溶于水的那小部分硫酸钡却几乎完全电离(20 ℃时硫酸钡饱和溶液的电离度为97.5%)。
因此,硫酸钡是电解质。
碳酸钙和硫酸钡具有相类似的情况,也是电解质。
从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,也是电解质。
氢氧化铁的情况则比较复杂,Fe3+与OH-之间的化学键带有共价性质,它的溶解度比硫酸钡还要小(20 ℃时在水中的溶解度为9.8×10-5 g);而落于水的部分,其中少部分又有可能形成胶体,其余亦能电离成离子。
但氢氧化铁也是电解质。
判断氧化物是否为电解质,也要作具体分析。
非金属氧化物,如SO2、SO3、P2O5、CO2等,它们是共价型化合物,液态时不导电,所以不是电解质。
有些氧化物在水溶液中即便能导电,但也不是电解质。
因为这些氧化物与水反应生成了新的能导电的物质,溶液中导电的不是原氧化物,如SO2本身不能电离,而它和水反应,生成亚硫酸,亚硫酸为电解质。
金属氧化物,如Na2O,MgO,CaO,Al2O3等是离子化合物,它们在熔化状态下能够导电,因此是电解质。
可见,电解质包括离子型或强极性共价型化合物;非电解质包括弱极性或非极性共价型化合物。

电解质的强弱和电离程度电解质是指在溶液中能够电离生成离子的物质。
根据电解质的强弱程度和电离程度的不同,可以将其分为强电解质和弱电解质。
强电解质是指在溶液中能够完全电离解离,生成大量的离子。
强电解质的电离程度非常高,可以达到100%。
典型的强电解质包括强酸和强碱,如盐酸(HCl)、硫酸(H2SO4)、氢氧化钠(NaOH)等。
当这些物质溶解在水中时,它们会快速而完全地分解成对应的离子,而这些离子则能与溶液中的其他物质发生化学反应。
与强电解质相比,弱电解质的电离程度较低。
在溶液中,只有一小部分弱电解质会电离解离成离子。
大部分的弱电解质仍然以分子形式存在。
弱电解质的电离程度通常在1%以下,甚至更低。
典型的弱电解质包括弱酸和弱碱,如乙酸(CH3COOH)、碳酸氢根(HCO3-)等。
电离程度与电解质的强弱程度密切相关。
弱电解质的电离程度较低,主要是由于溶解度和离解度较小所致。
强电解质的离解度高,溶解度大,因此能够电离生成大量离子。
而弱电解质的溶解度和离解度较小,只有一小部分能够电离,所以其电离程度较低。
电离程度的大小可以通过电离度常数来表示。
电离度常数(K)是指在给定温度下,电解质溶液中电离产生的离子浓度与初始电解质浓度之比。
对于强电解质来说,其电离度常数非常大,接近1或很接近。
而弱电解质的电离度常数则远小于1,通常在很小的范围内变化。
电离程度的大小对电解质的溶液性质和化学反应有着重要的影响。
强电解质能够迅速与其他物质反应,产生明显的化学变化,而弱电解质反应相对缓慢且不明显。
这也是为什么强酸和强碱可以在化学实验中常用于溶液的中和反应和酸碱中和反应。
总的来说,电解质的强弱程度和电离程度是电解质的基本特性。
强电解质具有较高的电离程度,能够完全电离生成大量离子;而弱电解质的电离程度较低,只有一小部分能够电离。
电离程度的大小对电解质在溶液中的化学性质和反应性质有着重要的影响。
理解电解质的强弱程度和电离程度对于化学研究和实验具有重要的指导意义。

高三化学强弱电解质★☆巧思巧解:1、电解质与非电解质、强电解质与弱电解质的比较:电解质溶液其中:①电解质和非电解质的研究对象均为化合物;单质和混合物即不是电解质;也不是非电解质。
②“水溶液或熔化状态”是电解质电离的外部条件;且两个条件具备其中一个即可。
如液态HCl不导电;而HCl的水溶液能导电(即其发生了电离);所以HCl是电解质;而作为非电解质则必须是两个条件下均不能电离。
③“能导电”是因为电解质电离(在水溶液或熔化状态下)产生了自由移动的离子。
电解质溶液的导电能力强弱主要取决于溶液中自由移动的离子的浓度大小;离子浓度越大;导电能力越强;与溶液中自由移动的离子数目无关;与电解质的强弱无关。
2、电离平衡与水解平衡的比较3、影响水电离的因素水的电离是电离平衡的一种具体表现形式;所以可以上承下延;从电离平衡的影响因素来思考和理解具体的水的电离平衡的影响因素。
(1)温度:由于水的电离过程吸热;故升温使水的电离平衡右移;即加热能促进水的电离;c(H+)、c(OH―)同时增大;K w增大;pH值变小;但c(H+)与c(OH―)仍相等;故体系仍显中性。
(2)酸、碱性:在纯水中加入酸或碱;酸电离出的H+或碱电离出OH―均能使水的电离平衡左移;即酸、碱的加入抑制水的电离。
若此时温度不变;则K w不变;c(H+)、c(OH―)此增彼减。
即:加酸;c(H+)增大;c(OH―)减小;pH变小。
加碱;c(OH―)增大;c(H+)减小;pH变大。
(3)能水解的盐:在纯水中加入能水解的盐;由于水解的实质是盐电离出的弱酸根或弱碱阳离子结合水电离出的H+或OH―;所以水解必破坏水的电离平衡;使水的电离平衡右移。
即盐类的水解促进水的电离。
(4)其它因素:向水中加入活泼金属;由于与水电离出的H+直接作用;因而同样能促进水的电离。
4、关于溶液pH值的计算(1)总思路:根据pH的定义:pH=-lg{c(H+)};溶液pH计算的核心是确定溶液中c(H+) pH=-lg{c(H+)}的相对大小。
考点41 弱电解质的电离平衡一、强电解质和弱电解质1.电解质和非电解质电解质:在水溶液中或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下均以分子形式存在,因而不能导电的化合物。
2.强电解质和弱电解质(1)实验探究盐酸和醋酸的电离程度取相同体积、0.1 mol·L-1的盐酸和醋酸,比较它们pH 的大小,试验其导电能力,并分别与等量镁条反应。
观察、比较并记录现象。
酸0.1 mol·L-1盐酸0.1 mol·L-1醋酸pH 较小较大导电能力较强较弱与镁条反应的现象产生无色气泡较快产生无色气泡较慢实验结论实验表明盐酸中c(H+)更大,说明盐酸的电离程度大于醋酸的电离程度(2)强电解质弱电解质概念在水溶液中能全部电离的电解质在水溶液中只能部分电离的电解质电解质在溶液中的存在形式只有阴、阳离子既有阴、阳离子,又有电解质分子化合物类型离子化合物、部分共价化合物共价化合物实例①多数盐(包括难溶性盐);②强酸,如HCl、H2SO4等;③强碱,如KOH、Ba(OH)2等①弱酸,如CH3COOH、HClO等;②弱碱,如NH3·H2O等;③水1.电离平衡状态(1)概念:在一定条件(如温度、浓度)下,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
(2)建立过程(3)电离平衡的特征2.电离方程式的书写(1)强电解质完全电离,在写电离方程式时,用“===”。
(2)弱电解质部分电离,在写电离方程式时,用“”。
①一元弱酸、弱碱一步电离。
如CH3COOH:CH3COOH CH3COO-+H+,NH3·H2O:NH3·H2O NH+4+OH-。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如H2CO3:H2CO3H++HCO-3(主),HCO-3H++CO2-3(次)。
高三化学电解质试题答案及解析1.(14分) I、(1)下列物质中属于强电解质的是;(2)属于弱电解质的是;(3)属于非电解质的是。
(填序号)①氨气②氨水③盐酸④醋酸⑤硫酸钡⑥银⑦氯化钠⑧二氧化碳⑨醋酸铵⑩氢气II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。
已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(要求配平)(2)反应中,被还原的物质是,Cr2(SO4)3是剂。
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为。
【答案】Ⅰ⑴⑤⑦⑨;④;①⑧Ⅱ⑴7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7⑵K2S2O8还原剂⑶3:1【解析】Ⅰ⑴混合物(②③)、单质(⑥⑩)既不是电解质也不是非电解质;强酸、强碱、绝大数盐(⑤⑦⑨)属于强电解质;弱酸(④)、弱碱、水等属于弱电解质;其余(①⑧)为非电解质。
Ⅱ根据“K2S2O8的氧化性比K2Cr2O7强” 可确定该反应的氧化剂是K2S2O8,还原剂是K2Cr2O7;还原产物是H2SO4和K2SO4,氧化产物是K2Cr2O7,然后根据氧化还原的配平方法将其配平得7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7;据此可回答⑴⑵小题;⑶根据得失电子守恒得还原剂与氧化剂之间的系数关系为:3H2C2O4~1K2Cr2O7;则还原剂与氧化剂物质的量之比为3:1。
【考点】考查氧化还原反应原理。
2.一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )A.次磷酸的电离方程式为H3PO23H++PO23-B.次磷酸中P的化合价为+1C.NaH2PO2是酸式盐D.NaH2PO2溶液显弱酸性【答案】B【解析】A、次磷酸属于一元酸,所以应电离产生1个氢离子,错误;B、根据化合价的原则,次磷酸分子中H是+1价,O是-2价,所以P的化合价是+1价,正确;C、因为次磷酸是一元酸,所以NaH2PO2是正盐,错误;D、次磷酸是中强酸,所以NaH2PO2溶液显弱碱性,错误,答案选B。
强、弱电解质与水的电离本讲教学主要内容1.电解质的强弱、电离度的大小、溶液导电能力的大小2.水的电离(酸、碱、盐对溶液中水电离程度的影响)(一)强电解质、弱电解质1.相互关系3.电解质溶液导电能力的强弱与电解质强弱影响溶液导电能力的因素:①自由移动离子浓度的大小.(主要决定因素)温度一定,离子浓度越大,导电能力越强.②温度:温度越高,导电能力越强.(与金属导电相反)③离子电荷数:电荷数越高,导电能力越强.由此可知:强电解质溶液的导电能力不一定比弱电解质强.如较浓醋酸的导电能力可比极稀HCl溶液强.CaCO3虽为强电解质,但溶于水所得溶液极稀,导电能力极差.例下列各种溶液中通入或加入少量物质,对溶液导电能力有何影响(1)盐酸中通入少量NH3(2)氨水中通入少量HCl(3)醋酸中通入少量NH3(4)盐酸中加入少量AgNO3解析 4种情况均发生了化学变化,由于加入(或通入)的是固体(或气体),可忽略体积变化.分析溶液中自由移动离子浓度有无明显变化.(1)HCl+NH3=NH4ClCl-不变,NH4+代替了H+,离子浓度几乎不变,故导电能力基本不变.(2)虽然也发生(1)的反应,但因原来的氨水是弱电解质溶液,离子浓度较小,导电能力较弱;当转变成NH4Cl时,因NH4Cl完全电离,离子浓度明显增大,故导电能力增强.(3)醋酸是弱电解质,当通入NH3发生化学反应生成NH4Ac,则完全电离,前后体积不变,离子浓度增大,导电能力增强.(4)HCl+AgNO3=AgCl↓+HNO3虽发生反应且有沉淀生成,但本质上H+未参与反应,NO3-代替了已反应转化成沉淀的Cl-,自由移动的离子浓度不变.故导电能力不变.(三)、水的电离及其平衡的移动水的电离虽然仅是《电解质》一章中的一小节,但它却是整章的灵魂.从水的电离引出溶液的PH值,到盐的水解实质,再到电解质溶液等知识均与水的电离有关.因此不仅要学会定性分析电离程度的变化,还应掌握在酸、碱,盐较浓溶液中水电离的定量计算.现列表如下:。
高三化学电解质知识点电解质是指在溶液或熔融状态下能够导电的物质。
根据其溶解度和导电能力的不同,电解质可分为强电解质和弱电解质两类。
一、强电解质强电解质在水溶液中完全离解,形成离子,并能导电。
强电解质的常见例子包括盐类和强酸、强碱。
1. 盐类盐类是由阳离子和阴离子组成的化合物。
在水中,阳离子和阴离子会完全解离,并形成离子水合物。
这些离子能够在溶液中自由移动,从而导电。
例如,氯化钠(NaCl)在水中会完全分解成钠离子(Na+)和氯离子(Cl-)。
2. 强酸强酸是指能够完全解离产生H+离子的酸。
强酸的溶液能够导电,因为其中存在大量的离子。
例如,盐酸(HCl)在水中会完全解离为氯离子(Cl-)和氢离子(H+)。
3. 强碱强碱是指能够完全解离产生OH-离子的物质。
强碱的溶液也能够导电,因为其中存在大量的离子。
例如,氢氧化钠(NaOH)在水中完全解离为钠离子(Na+)和氢氧根离子(OH-)。
二、弱电解质弱电解质在水溶液中只部分离解,并不能完全形成离子。
因此,弱电解质溶液的导电能力比较弱,导电程度取决于其分子的离解度。
弱电解质的典型代表是弱酸和弱碱。
1. 弱酸弱酸只在水溶液中部分离解,生成少量的H+离子。
弱酸溶液的导电能力较强酸溶液弱。
例如,乙酸(CH3COOH)在水中只部分解离产生一部分乙酸离子(CH3COO-)和少量的氢离子(H+)。
2. 弱碱弱碱也只在水溶液中部分离解,生成少量的OH-离子。
弱碱溶液的导电能力较强碱溶液弱。
例如,氨水(NH3·H2O)在水中部分解离产生少量的氨离子(NH4+)和氢氧根离子(OH-)。
总结:电解质是指在溶液或熔融状态下能够导电的物质。
根据离解的程度不同,电解质可分为强电解质和弱电解质。
强电解质在溶液中完全离解,形成离子,能够导电;弱电解质只部分离解,产生少量离子,导电能力较弱。
了解电解质的性质和分类对于理解溶液的电导性是非常重要的。
电解质的知识不仅在化学学科中有广泛的应用,还涉及到生活中诸多的方面,如饮食中的营养成分和药物的作用等。
2021高三全国统考化学(经典版)一轮学案:第2章第2节离子反应离子方程式含答案第2节离子反应离子方程式[考试说明]1。
了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水溶液中的电离以及电解质溶液的导电性。
3。
了解离子反应的概念、发生的条件。
4.能正确书写离子方程式,并能进行有关计算。
[命题规律]离子反应是高中化学的重点内容,是考查元素化合物知识的一种重要形式,高考对本节知识的考查保持一定的稳定性和连续性,选择题主要考查离子方程式的正误判断和离子大量共存问题,非选择题主要考查离子方程式的书写,特别是和工农业生产、生活相关的或与化工流程相结合的新情境下氧化还原型离子方程式的书写等.考点1电解质及其电离知识梳理1.电解质和非电解质前提条件实验条件现象实质实例电解质化合物错误!水溶液中或错误!熔融状态下错误!能导电自身错误!电离出离子HCl、CH3COOH、NaOH、BaSO4、2.强电解质和弱电解质续表活泼金属氧化物:错误!Na2O、MgO等绝大部分盐:NaCl等H2O 极少数盐3.电离(1)概念:电解质在水溶液中或熔融状态下,产生了错误!自由移动的离子的过程。
(2)电离条件:酸等共价化合物的电离条件是错误!溶于水,盐和碱等离子化合物的电离条件是错误!溶于水或熔融。
4.电离方程式的书写(1)强电解质:完全电离,用错误!===表示.如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为错误!H2SO4===2H++SO错误!、错误! NaOH===Na++OH-、错误!(NH4)2SO4===2NH错误!+SO错误!。
(2)弱电解质:部分电离,用错误!表示.①多元弱酸分步电离,且电离程度逐步减弱,电离方程式分步写,一般只写第一步。
如H2S的电离方程式为□,06H2S H++HS-。
②多元弱碱分步电离,但一步写出。
如Cu(OH)2Cu2++2OH-。
③两性氢氧化物双向电离。
如Al(OH)3的电离方程式:错误!H++AlO错误!+H2O Al(OH)3Al3++3OH-。