药物毒理学-动物实验基本知识与技术
- 格式:ppt
- 大小:3.95 MB
- 文档页数:56



动物实验的基本操作技术实验报告实验报告一、实验目的1.学习毒理学实验中有关动物实验的基本操作技术2.掌握健康小鼠的外观检查方法、性别鉴定、捉拿和固定方法、小鼠灌胃给药与小鼠腹腔注射给药等技术3.掌握小鼠颈椎脱臼法处死方法、小鼠脏器系数的概念及其测定方法、病理学意义4.熟悉小鼠的标记、小鼠解剖步骤及正常脏器观察5.了解实验动物的被毛去除方法、实验动物粪、尿的收集、小鼠血液样本采集方法二、实验材料和器材1.动物:小鼠2.器材:鼠笼、天平、注射器、灌胃针、止血钳、手术剪、平皿、托盘、烧杯若干。
三、实验方法1.对小鼠进行观察观察的指标主要包括:小鼠的体型、发育情况;毛发是否清洁浓密有光泽,是否顺贴不蓬乱;行动是否迅速,反应是否灵敏;眼睛是否明亮有神,瞳孔是否清晰等圆;天然孔道是否干净、有无分泌物。
2.小鼠的捉拿右手提起鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉,小白鼠则将前肢固定于粗糙面上。
此时迅速用左手拇指和食指捏任小白鼠颈背部皮肤,并以小指与手掌尺侧夹持其尾根部,固定于手中。
3.小鼠性别鉴定主要观察肛门与生殖器之间的距离。
雄性大鼠的距离较大,雌性的距离较小,且成年雄鼠尾部可见睾丸,成年雌鼠可见乳头。
4.小鼠称重打开电子天平,待读数显示稳定后,将平皿置于天平上,去皮;将小鼠置于平皿中,待读数显示稳定后,读数得25.95g。
5.小鼠灌胃1)准备灌胃针头,将注射器针头拔下,更换为灌胃针头;根据小鼠的体重,按0.1ml/10g 灌胃量计算:V=25.950*0.1/10=0.26ml用注射器取0.26ml液体(自来水);2)按“三-2-1)”的方法抓住小鼠,使其头、颈和身体呈一直线;3)灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后即可推注药液,然后原方向将灌胃针抽出。
6. 腹腔注射1)吸取液体(自来水),将针头向上,吸取一段气体后,再缓慢排除气体,以达到取出气泡的效果。


七、毒理学实验(一)、急性毒性试验的定义、目的和意义急性毒性试验,又称单次给药急性毒性实验,是指在24h内一次或多次给予动物受试物后,所产生的毒性反应。
(二)、基本内容和技术要求1、实验动物可根据不同情况选用不同的实验动物,例如大鼠、小鼠、犬。
本实验随机选用健康成年的12只大鼠和12只小鼠,要求雌雄分别对半,动物初始体重不超过或低于平均体重的20%。
2、给药途径由于本品为浓缩丸,因此选用口服进行实验。
给药前将实验动物禁食24h。
3、给药剂量将大鼠和小鼠分别两只一组,分大鼠6组,小鼠6组。
然后编号。
分剂量0g/kg,1g/kg,2g/kg,3g/kg,4g/kg,5g/kg对小鼠和大鼠进行灌胃口服,20ml/kg。
然后观察小鼠反应。
一般认为口服5g/kg时未见急性毒性或死亡,可不必提高剂量进行实验。
4、观察时间及指标给药后几小时内应严密观察动物反应,之后每天上下午各观察一次,至少连续观察14d。
5、在口服给药24h后,如果没有实验动物死亡,则每组各选一只动物进行病理组织学检查;如果有动物死亡,则将死亡动物和未死亡的动物小组中选一只动物进行病理学检查。
6、实验动物临床表现与器官系统的关系急性毒性试验一般指征观察参考表(三)、长期毒性实验实验要求和内容1、实验药品要求选用符合相关制剂要求的同一批药品。
2、实验动物选用正常、健康、雌雄各半和动物体重应在平均体重的20%之内的成年各20只大鼠和小鼠。
将每种动物平均分四组,分别为高、中、低、和对照组。
3、实验动物饲养按照动物室正常标准进行饲养。
4、药物剂量根据相应动物急性毒性的最大无症状剂量(MTD)、1/3MTD、1/10MTD 分别设高中低三个剂量。
对照组为空白对照。
5、给药方法将药物加入到饲料中,依据确定的量进行。
6、给药时间给药6个月。
7、观察指标(1)一般指标实验动物的体重,和解剖后相关脏器的重量。
每周固定时间测1次大鼠体重及摄食量,试验期间详细观察大鼠一般状况,包括外观体征、行为活动、腺体分泌、呼吸、粪便等,必要时应测定大鼠饮水量。

实验报告一、实验目的1.学习毒理学实验中有关动物实验的基本操作技术2.掌握健康小鼠的外观检查方法、性别鉴定、捉拿和固定方法、小鼠灌胃给药与小鼠腹腔注射给药等技术3.掌握小鼠颈椎脱臼法处死方法、小鼠脏器系数的概念及其测定方法、病理学意义4.熟悉小鼠的标记、小鼠解剖步骤及正常脏器观察5.了解实验动物的被毛去除方法、实验动物粪、尿的收集、小鼠血液样本采集方法二、实验材料和器材1.动物:小鼠2.器材:鼠笼、天平、注射器、灌胃针、止血钳、手术剪、平皿、托盘、烧杯若干。
三、实验方法1.对小鼠进行观察观察的指标主要包括:小鼠的体型、发育情况;毛发是否清洁浓密有光泽,是否顺贴不蓬乱;行动是否迅速,反应是否灵敏;眼睛是否明亮有神,瞳孔是否清晰等圆;天然孔道是否干净、有无分泌物。
2.小鼠的捉拿右手提起鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉,小白鼠则将前肢固定于粗糙面上。
此时迅速用左手拇指和食指捏任小白鼠颈背部皮肤,并以小指与手掌尺侧夹持其尾根部,固定于手中。
3.小鼠性别鉴定主要观察肛门与生殖器之间的距离。
雄性大鼠的距离较大,雌性的距离较小,且成年雄鼠尾部可见睾丸,成年雌鼠可见乳头。
4.小鼠称重打开电子天平,待读数显示稳定后,将平皿置于天平上,去皮;将小鼠置于平皿中,待读数显示稳定后,读数得25.95g。
5.小鼠灌胃1)准备灌胃针头,将注射器针头拔下,更换为灌胃针头;根据小鼠的体重,按0.1ml/10g 灌胃量计算:V=25.950*0.1/10=0.26ml用注射器取0.26ml液体(自来水);2)按“三-2-1)”的方法抓住小鼠,使其头、颈和身体呈一直线;3)灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后即可推注药液,然后原方向将灌胃针抽出。
6. 腹腔注射1)吸取液体(自来水),将针头向上,吸取一段气体后,再缓慢排除气体,以达到取出气泡的效果。
2)按“三-2-1)”的方法捉拿小鼠,并使小鼠腹腔向上;3)事先吸取好液体的注射器针尖平面朝上,平行扎入皮内后,注射器与腹腔呈45度角刺入腹腔,感觉针尖部分可以移动,将注射针向后抽出一点,注射样品。
动物实验基础知识系列之一:剂量换算关于剂量换算的问题最近不少战友询问关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的问题。
这个问题对学习药理的战友来讲,可能是非常熟悉了。
但对于非药理专业但又需做药理实验的战友来说,仍然是令人困扰的问题。
下面我们分以下几点来探讨这个问题。
第一、等效剂量系数折算法换算第二、体表面积法换算第三、系数折算法与体表面积法的比较第四、系数折算法的相对误差第五、小孩与成人的剂量换算第六、少常用实验动物剂量间的换算第七、不同给药途径间的剂量换算第八、LD50与药效学剂量间的换算下面我来简单说一下这个问题。
我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径:一是查文献,参考别人使用的剂量。
有时有现成的,可直接用。
有时没有我们所用动物的剂量,但有其它实验动物的。
也有的是有临床用量的,但没有实验动物的。
这样,我们就得进行换算。
这是我们今天要谈的这种方法。
另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。
一般参考数据是LD50。
至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。
这个我们再另题讨论。
下面我来说一说用第一种方法进行如何换算。
目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。
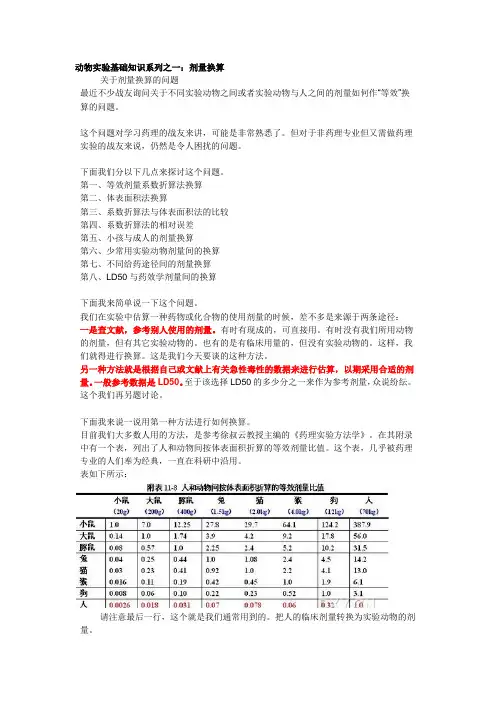
在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。
这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。
表如下所示:请注意最后一行,这个就是我们通常用到的。
把人的临床剂量转换为实验动物的剂量。
试着换算一个。
如:人的临床剂量为X mg/kg ,换算成大鼠的剂量:大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg=6.3 X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。



药理学动物实验的基本知识和技术作者:李铁铮来源:《科技资讯》2016年第23期摘要:在药理学动物实验中,要根据实验目的和要求选用不同实验动物。
学生要严格掌握青蛙、蟾蜍、小鼠、大鼠、豚鼠、家兔、狗等实验动物的捉持方法,严格掌握各类实验动物的不同给药方法,保证自身安全,获得相应实验结果。
在此过程中,可以训练学生客观地观察、比较、分析、综合和解决实际问题的能力,培养学生严谨的科学态度、严密的工作方法和实事求是的作风,达到实验目的。
摘要:药理学;动物实验;基本知识;基本技术中图分类号:G420 文献标识码:A 文章编号1672-3791(2016)08(b)-0000-00实验是药理学教学的一个重要组成部分。
通过动物实验不仅可以验证理论知识,而且可以训练学生客观地观察、比较、分析、综合和解决实际问题的能力,培养学生严谨的科学态度、严密的工作方法和实事求是的工作作风。
1实验动物的选择和用途1.1实验动物的选择青蛙、蟾蜍、小鼠、大鼠、豚鼠、家兔、狗等为药理实验常用动物。
动物对药物反应具有种属差异性,应根据实验目的和要求选用不同的实验动物。
实验动物可分为4个级别,药理教学实验可选用一级普通动物,科研实验必须用二级以上实验动物,分别为二级清洁动物、三级无特定病原体的动物和四级无菌动物。
1.2实验动物的用途在离体情况下,青蛙和蟾蜍心脏节律性搏动保持时间较长,可观察药物对心脏的作用,药物对周围神经、横纹肌或神经肌肉接头作用的观察可选用坐骨神经腓肠肌标本。
小鼠易大量繁殖,是最常用实验动物,适用于需要大量动物的实验。
大鼠用途与小鼠基本相同,主要用于一些用小鼠不便进行的实验。
大鼠对炎症反应较为灵敏,其踝关节炎模型常用于观察药物的抗炎作用。
豚鼠对组胺特别敏感,是筛选平喘药和抗组胺药最理想的动物。
家兔性情温顺易饲养,常用于观察药物对心脏、血压、呼吸的影响。
狗易于通过驯养与人合作,适于慢性实验。
2实验动物的捉持方法2.1青蛙和蟾蜍用左手的食指和中指夹住左前肢,大拇指压住右前肢,下肢用右手拉直并在无名指和小指之间予以固定。

动物医学专业的兽医药物毒理学与检测动物医学是一门研究动物健康与疾病的学科,而兽医药物毒理学与检测则是其中的重要分支。
兽医药物毒理学与检测旨在研究动物体内外药物的吸收、分布、代谢和排泄等方面,并评估这些药物对动物身体的毒性作用。
本文将介绍兽医药物毒理学与检测的概念、研究内容和重要性。
一、兽医药物毒理学与检测的概念兽医药物毒理学是指研究动物体内外对药物的吸收、分布、代谢和排泄以及药物对动物产生的病理学、生理学和生化学效应的科学。
兽医检测则是通过实验室技术和方法,对动物体内服用的药物进行定量、定性分析,在临床实践中起到指导诊疗和药物应用的作用。
二、兽医药物毒理学与检测的研究内容1. 药物吸收的研究:兽医药物毒理学与检测需要了解药物在动物体内的吸收过程,包括药物通过消化系统、呼吸系统、皮肤和黏膜等途径进入动物体内的机制和影响因素。
2. 药物分布的研究:了解药物在动物体内的分布情况,包括药物在组织和器官中的积累程度、与血液蛋白的结合情况,以及药物在体内的半衰期等。
3. 药物代谢的研究:兽医药物毒理学与检测需要了解药物在动物体内的代谢过程,包括药物在肝脏和其他组织中的代谢途径和酶系统的作用。
4. 药物排泄的研究:了解药物从动物体内的排除方式,包括通过尿液、粪便、呼吸和乳汁等渠道的排泄情况。
5. 药物的毒性研究:兽医药物毒理学与检测需要评估药物在动物体内的毒性作用,包括急性毒性、亚急性毒性和慢性毒性等,并探讨毒性发生的机制和影响因素。
6. 兽医检测方法的研究:兽医药物毒理学与检测需要开发和改进实验室技术和方法,以提高药物检测的准确性、可靠性和灵敏度。
三、兽医药物毒理学与检测的重要性兽医药物毒理学与检测在兽医临床实践和药物研发中起到重要的作用。
1. 指导兽医临床实践:兽医药物毒理学与检测可以评估兽药对动物的毒性作用,指导兽医在临床治疗中的合理用药,避免药物滥用和不良反应的发生。
2. 药物研发的参考依据:兽医药物毒理学与检测为新药的研发提供了重要的参考依据,可以评估药物的安全性和有效性。
药理学实验详悉一、动物实验动物实验是根据研究目的,恰当地选用标准的符合实验要求的实验动物,在设计的条件下,进行各种科学实验、观察、记录动物的反应过程或反应结果,以探讨或检验生命科学中未知因素的专门活动。
动物实验是人类生存和发展的必要手段。
动物实验方法是进行动物实验时的各种实验手段、技术、方法和标准化操作程序。
也探讨实验动物科学中的减少、替代、优化问题。
实验动物的选择:首先应从生物医学研究的目的和实验要求来选择实验动物,进而考虑实验动物是否容易获得、是否经济、是否容易饲养。
一切实验动物应具有个体间的均一性,遗传的稳定性和容易获得三个基本要求。
标准化原则:根据对实验质量的要求选择标准化的实验动物。
动物实验中选择和使用与研究内容相匹配的标准化的实验动物标准化动物:是指遗传背景明确或来源清楚的,对其携带的微生物和寄生虫实行控制,模型性状显著且稳定的动物。
在精确试验中,鉴于动物体内外的微生物和寄生虫会干扰试验的结果,最好选择无菌动物或悉生动物,至少也应SPF级动物。
规格化原则:选择与实验要求一致的动物规格。
实验动物年龄与体重一般呈正相关性,可按体重推算年龄。
一般来说,实验动物年龄、体重应尽可能一致,相差不得超过10%。
不同性别的动物对同一药物的敏感程度是有差异的,如实验无特殊要求应选择雌雄各半做实验,以避免因性别差异所造成的结果误差。
特殊的生理状态下,如发情、妊娠及哺乳期,机体对实验的反应性发生改变。
★实验动物的选择应用应注意有关国际规范:GLP、SOP、“3R”(Replacement替代 Reduction减少 Refinement优化)(一)实验动物:系指遗传背景明确、来源清楚、对其携带的微生物、寄生虫实行控制,经科学方法人工培育用于科学实验的动物。
(二)实验动物的分类方法1、按遗传学控制分类*近交系:杂种动物经过相当于20代全同胞兄弟单纯连续繁殖,各条染色体上的基因趋于纯合,品系内个体差异趋于零。
一、常用实验动物染毒技术在进行毒理学动物实验时要使动物经一定的途径接触毒物,染毒的途径(Route of administration)要依实验目的并结合人类的实际接触方式,毒物的多少及理化性质和具体设备条件等来决定。
食品毒理学中最常用的染毒方式有经消化道染毒(Gastrointestinal tract exposure),在特殊需要时也使用注射染毒。
(一)经消化道染毒方法经消化道染毒方法主要有灌胃法、喂饲法和吞咽胶囊三种。
为防止胃纳充盈影响化合物的吸收及毒性,经消化道染毒要求实验动物空腹。
依动物生活习性的不同,禁食的时间也不同,白天进食的动物(如兔、猫、狗等)可在白天动物进食前给毒,夜间进食的动物(如大鼠、小鼠等)应隔夜禁食。
1 .灌胃法 1 )大鼠、小鼠及豚鼠灌胃法灌胃针头连接注射器,吸取受试物。
左手抓住动物背部皮肤,将动物固定,要使动物的消化道为自然垂直位。
右手持注射器,针头由动物嘴角插入,沿咽后壁缓缓插入食道。
进针过程应没有阻力,若遇阻力,应调整方向,不要强行进针。
进针后先回抽针芯,如无气泡抽出,并有一定负压,说明位置在胃中,可进药。
否则应重新进针。
一般灌胃针插入深度小鼠约34cm,大鼠、豚鼠约46cm。
灌胃量小鼠0.2 l ml,大鼠l4ml,豚鼠l5ml。
2 )免、猫、狗等较大动物灌胃法通常以胃管或导尿管为灌胃导管。
先将动物固定,保持伸直的体位。
在动物上、下门牙间放一开口器,并固定之。
开口器可用本料或金属制成,梭形,宽度依动物口腔大小而定,中间钻一小孔,以使灌胃导管能通过。
灌胃导管经开口器中心圆孔插入,沿咽后壁经食道插入胃中。
如遇阻力应拔出,稍等片刻后重新插入,不可强行插管,以免造成创伤或误入肺部。
为检查导管插入是否正确,将导管外口通人一盛水的烧杯中,如不发生气泡,即认为在食道中,若不断出现气泡,则可能误人肺内,应拔出重插。
确认插入胃中后,用注射器吸取受试物,经导管注入。
注入速度不要太快,以免引起呕吐。
药物毒理学实验方法与技术
药物毒理学实验方法与技术是用于研究药物的安全性和有效性的
重要手段。
它旨在了解药物如何在人类体内和动物体内影响生物标记物、细胞和分子水平,从而促进新药的发展。
实验方法可以分为两类:生物学和定量分析。
一般来说,在进行药物毒理学实验之前,需要使用许多先进的实
验技术,以确定实验目标、指导实验过程和分析实验结果,并评估实
验的安全性和质量。
生物学技术包括免疫荧光技术、电镜(TEM)技术、杂交实验、RNA和DNA克隆等。
其中,最常用的实验技术是药物动力学(PK)和药物代谢(XB)实验。
以PK实验为例,主要通过测定新药在体内的吸收率和消除率,
预测其在体外的有效性和有害影响。
与PK实验类似,XB实验旨在探讨药物及其代谢产物在内部环境下如何进行代谢和分解,以及它们是如
何影响有效活性和毒性的。
除了上述技术外,非定量分析技术也是药物毒理学实验的关键工
具之一。
这些技术可以帮助科学家了解复杂生物系统如何应对外来物质,从而揭示药物给患者带来的有效性和毒性。
综上所述,药物毒理学实验需要运用大量先进的实验技术,如生
物学技术、药物动力学和药物代谢实验、非定量分析等技术,以有效
地评估新药剂的安全性和有效性。
这些实验方法是药物开发过程中不
可缺少的一部分,能够帮助医疗行业更好地了解药物的不良作用。
生殖毒性试验:所用药物至少应有二至三种剂量并设对照组,高剂量可产生轻度毒性反应,低剂量应为拟议中的治疗量的某些倍量。
给药途径原则上与推荐临床应用的给药途径相同,口服制剂应用灌胃法。
(1)一般生殖毒性试验动物:一种或一种以上试验动物,如用小鼠或大鼠每组雌雄各20只以上。
给药时期:选择性成熟的动物,交配前雄性动物连续给药60天以上,雌性动物连续给药14天。
雌性动物在确定已经交配后继续给药至多数胚胎器官发生期。
检查:给药的雌性动物与给药的雄性动物同笼交配过夜后,以适当方法检查其交配成功与否(阴栓或精子的有无)。
同笼饲养期限最多两周。
必要时给药动物可以和非给药动物分别交配,已交配的雌性动物,推定其妊娠末期及时解剖,观察妊娠的确立、胎儿的吸收和死亡及子宫内活胎的发展情况,并进行形态学检查(性别、外表及内部器官的形态学观察及骨骼透明染色标本的检查),必要时进行组织学和组织化学的详细检查。
给药的雄性动物及未交配上的雌鼠均作剖检,必要时进行病理组织学检查。
(2)致畸胎试验动物:至少一种动物,一般采用小鼠或大鼠,每组15—20只孕鼠,家兔每组8—12只孕兔。
剂量:至少有二至三种剂量,并另设对照组,高剂量可有轻度毒性反应,低剂量应为拟议中的治疗量的某些倍量。
给药途径:原则上与推荐临床应用的给药途径相同,口服制剂应用灌胃法。
给药时期:胚胎的器官形成期。
检查:全部动物在妊娠末期剖检,观察妊娠的确立,有无死胎和吸收胎及子宫内活胎的发育情况,并进行形态学检查(性别、外表及内部器官的形态学观察及骨骼透明染色标本的检查),必要时进行组织学和/或组织化学的详细检查。
某些新药需要观察其对子代的影响。
动物数应相应增加孕鼠10只,使其自然分娩,观察其下一代直至成年。
检查新生动物的存活、生长及发育情况,包括行为、生殖功能及其他异常症状。
必要时还可对给药的雌性动物长期观察其生殖、受孕、分娩及次子代的情况。
结果处理:将数据汇总成表,尽量将全部观察的结果采用恰当的统计学方法分析及评价。