动物实验的基本技术上
- 格式:ppt
- 大小:12.69 MB
- 文档页数:41

动物实验基本操作技术动物实验作为一种科学研究手段,常用于医学、生物学等领域的实验研究。
为了确保实验的可靠性和安全性,研究人员需要正确掌握基本的动物实验操作技术。
下面将介绍一些常用的动物实验基本操作技术。
首先,动物实验前,需要对动物进行适当的饲养管理,确保其健康状态。
这包括提供适宜的饲料和饮水,保持合适的环境温度和湿度,以及定期清洁和消毒动物饲养环境。
此外,研究人员还需对动物进行身体检查,以排除可能影响实验结果的健康问题。
其次,对于需要进行手术的实验,研究人员需要具备相关的手术技术。
例如,动物麻醉技术是必不可少的,可以采用静脉注射麻药、局部麻醉或气管插管麻醉等方法。
在动物手术过程中,需要准确切割皮肤或组织,处理血管、神经和器官,以及进行缝合和止血等操作。
因此,研究人员需要熟练掌握相关手术技术,确保手术过程的顺利进行。
此外,动物实验中还常使用动物注射技术。
注射技术包括口服给药、皮下注射、肌肉注射和静脉注射等。
研究人员需要准确计量给药剂量,选择合适的注射部位和注射器具,并注意注射速度和注射途径的选择。
在实验中,研究人员还需要掌握注射后的观察和记录技巧,及时发现和处理可能的不良反应。
另外,动物实验还涉及到采集和处理生物样本的技术。
例如,研究人员需要采集血液、组织或其他体液样本,以进行生化分析、细胞培养或组织学检查等。
采样时需要注意卫生与无菌操作,避免交叉污染。
采样后,研究人员需要合理保存和处理样本,以保证实验结果的可靠性。
此外,动物实验中的数据记录与分析也是十分重要的。
研究人员需要仔细记录实验过程的各种参数,包括实验开始时间、操作步骤、药物剂量、实验结果等。
此外,研究人员还需要进行数据分析,以得出科学合理的结论。
在数据分析过程中,研究人员可以使用统计学方法,如平均值、标准差、方差分析等。
最后,动物实验的伦理与法规也是非常重要的。
研究人员需要遵守相关的伦理规范和动物保护法律法规,保证动物实验的道德性和合法性。

第二章动物实验的基本操作与技术动物实验方法是多种多样的,在医学的各个领域内都有其不同的应用,其中一些基本方法都是共同性的,如动物的选择、抓取、固定、麻醉、脱毛、给药、采血、采尿、急救、处死、尸检等,不管是从事何种课题的医学研究都要用这套基本方法,因此,动物实验基本方法,已成为医学科技工作者必须掌握的一项基本功。
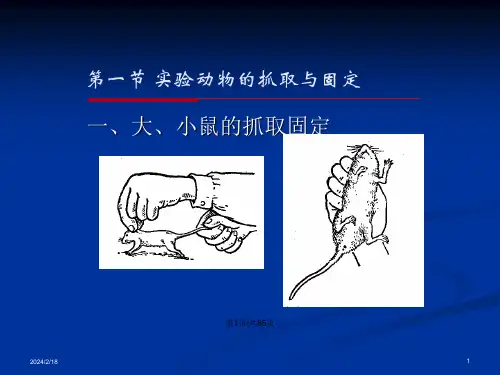
第一节实验动物的抓取固定方法一、小鼠抓取固定方法小鼠温顺,一般不会咬人,抓取时先用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤(见图2-1之一),将鼠体置于左手心中,把后肢拉直,以无名指按住鼠尾,小指按住后腿即可(图2-1之二)。
有经验者可直接用左手小指钩起鼠尾,迅速以拇指和食指、中指捏住其耳后颈背部皮肤亦可。
这种在手中固定方式,能进行实验动物的灌胃、皮下、肌肉和腹腔注射以及其他实验操作。
如进行解剖、手术、心脏采血和尾静脉注射时,则需将小鼠作一定形式的固定,解剖手术和心脏采血等均可使动物先取背卧位(必要时先行麻醉),再用大头针将鼠前后肢依次固定在腊板上。
尾静脉注射时,可用小鼠尾静脉注射架固定(图2-2),先根据动物大小选择好合适的固定架,并打开鼠筒盖,手提鼠尾巴,让动物头对准鼠筒口并送入筒内,调节鼠筒长短合适后,露出尾巴,固定筒盖即可进行尾静脉注射或尾静脉采血等操作。
图2-1 小鼠的抓取固定方法图2-2 小鼠尾静脉注射方法二、大鼠的抓取固定方法大鼠的抓取方法基本同小鼠,只不过大鼠比小鼠牙尖性猛,不易用袭击方式抓取,否则会被咬伤手指。
抓取时为避免咬伤,可带上帆布手套。
如果进行腹腔、肌肉皮下等注射和灌胃时,同样可采用左手固定法,只是用拇指和食指捏住鼠耳,余下三指紧捏鼠背皮肤,置于左掌心中,这样右手即可进行各种实验操作。
也可伸开左手之虎口,敏捷地从后一把抓住。
若做手术或解剖等,则需事先麻醉或处死,然后用细棉线绳活结缚腿,背卧位绑在大鼠固定板上;尾静脉注射时的固定同小鼠(只需将固定架改为大鼠固定盒)。

动物实验的基本操作技术实验报告实验报告一、实验目的1.学习毒理学实验中有关动物实验的基本操作技术2.掌握健康小鼠的外观检查方法、性别鉴定、捉拿和固定方法、小鼠灌胃给药与小鼠腹腔注射给药等技术3.掌握小鼠颈椎脱臼法处死方法、小鼠脏器系数的概念及其测定方法、病理学意义4.熟悉小鼠的标记、小鼠解剖步骤及正常脏器观察5.了解实验动物的被毛去除方法、实验动物粪、尿的收集、小鼠血液样本采集方法二、实验材料和器材1.动物:小鼠2.器材:鼠笼、天平、注射器、灌胃针、止血钳、手术剪、平皿、托盘、烧杯若干。
三、实验方法1.对小鼠进行观察观察的指标主要包括:小鼠的体型、发育情况;毛发是否清洁浓密有光泽,是否顺贴不蓬乱;行动是否迅速,反应是否灵敏;眼睛是否明亮有神,瞳孔是否清晰等圆;天然孔道是否干净、有无分泌物。
2.小鼠的捉拿右手提起鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉,小白鼠则将前肢固定于粗糙面上。
此时迅速用左手拇指和食指捏任小白鼠颈背部皮肤,并以小指与手掌尺侧夹持其尾根部,固定于手中。
3.小鼠性别鉴定主要观察肛门与生殖器之间的距离。
雄性大鼠的距离较大,雌性的距离较小,且成年雄鼠尾部可见睾丸,成年雌鼠可见乳头。
4.小鼠称重打开电子天平,待读数显示稳定后,将平皿置于天平上,去皮;将小鼠置于平皿中,待读数显示稳定后,读数得25.95g。
5.小鼠灌胃1)准备灌胃针头,将注射器针头拔下,更换为灌胃针头;根据小鼠的体重,按0.1ml/10g 灌胃量计算:V=25.950*0.1/10=0.26ml用注射器取0.26ml液体(自来水);2)按“三-2-1)”的方法抓住小鼠,使其头、颈和身体呈一直线;3)灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后即可推注药液,然后原方向将灌胃针抽出。
6. 腹腔注射1)吸取液体(自来水),将针头向上,吸取一段气体后,再缓慢排除气体,以达到取出气泡的效果。

动物实验基本技术1.实验动物的分组:①分组原则:实验动物分组应严格按照随机分组的原则进行,使每只动物都有同等机会被分配到各个实验组中去,尽量避免人为因素对实验造成的影响。
②建立对照组:空白对照:指在对照组不加任1可处理的"空白"条件下进行观察、研究;实验对照:指在一定实验条件下所进行的观察、对比;标准对照:是以正常值或标准值作为对照,在所谓标准条件下进行观察的对照;自身对照:在观察的不同时期接受不同疗法,然后比较它们的差异,这种方法也称自身交叉对照;相互对照:各实验相互对照。
2.目前实验动物学常用的标记编号方法有染色法、耳孔法、烙印法、挂牌法等。
此外还有针刺法、断趾编号法、剪尾编号法、被毛剪号法、笼子编号:去等。
3∙常用的实验动物被毛去除方法有拔毛法、剪毛法、剃毛法、脱毛法4种。
4.实验动物的给药和采血:小鼠:给药方法:灌胃给药、注射给药【皮下注射给药、皮内注射给药、肌内注射给药、静脉注射给药、腹腔注射给药;采血:剪尾采血、摘除眼球采血、心脏采血、断头采血。
大鼠:给药方法:灌胃给药、注射给药【皮下注射给药、皮内注射给药、肌内注射给药、静脉注射给药、腹腔注射给药;采血:剪尾采血、割尾静脉取血、眼眶静脉丛(窦)取血、摘除眼球采血、心脏采血、断头采血。
5.实验动物麻醉方法:对实验动物进行麻醉的目的是,消除实验过程中引起的痛苦和不适,确保实验动物的安全和动物实验的顺利进行。
①全身麻醉药:常用的包括非挥发性和挥发性两大类,非挥发性麻醉药如戊巴比妥钠、异戊巴比妥钠、硫喷妥钠、乌拉坦、氯胺酮等,以及挥发性麻醉药入乙酶氯仿等。
全身麻醉方法:有吸入麻醉法和注射麻醉法两种途径,吸入麻醉法用挥发性麻醉药,注射麻醉法用非挥发性麻醉药。
其中,麻醉药经呼吸道吸入而产生麻醉者称吸入麻醉法,动物实验大都采用开放吸入法。
而注射麻醉法,在动物实验中比较常用,麻醉药物中使用频率最高的是戊巴比妥钠;家兔、猫、犬、猴等实验动物常用腹腔注射或静脉注射戊巴比妥钠进行全麻,啮齿类实验动物则仅用腹腔注射戊巴比妥钠麻醉。

实验报告一、实验目的1.学习毒理学实验中有关动物实验的基本操作技术2.掌握健康小鼠的外观检查方法、性别鉴定、捉拿和固定方法、小鼠灌胃给药与小鼠腹腔注射给药等技术3.掌握小鼠颈椎脱臼法处死方法、小鼠脏器系数的概念及其测定方法、病理学意义4.熟悉小鼠的标记、小鼠解剖步骤及正常脏器观察5.了解实验动物的被毛去除方法、实验动物粪、尿的收集、小鼠血液样本采集方法二、实验材料和器材1.动物:小鼠2.器材:鼠笼、天平、注射器、灌胃针、止血钳、手术剪、平皿、托盘、烧杯若干。
三、实验方法1.对小鼠进行观察观察的指标主要包括:小鼠的体型、发育情况;毛发是否清洁浓密有光泽,是否顺贴不蓬乱;行动是否迅速,反应是否灵敏;眼睛是否明亮有神,瞳孔是否清晰等圆;天然孔道是否干净、有无分泌物。
2.小鼠的捉拿右手提起鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉,小白鼠则将前肢固定于粗糙面上。
此时迅速用左手拇指和食指捏任小白鼠颈背部皮肤,并以小指与手掌尺侧夹持其尾根部,固定于手中。
3.小鼠性别鉴定主要观察肛门与生殖器之间的距离。
雄性大鼠的距离较大,雌性的距离较小,且成年雄鼠尾部可见睾丸,成年雌鼠可见乳头。
4.小鼠称重打开电子天平,待读数显示稳定后,将平皿置于天平上,去皮;将小鼠置于平皿中,待读数显示稳定后,读数得25.95g。
5.小鼠灌胃1)准备灌胃针头,将注射器针头拔下,更换为灌胃针头;根据小鼠的体重,按0.1ml/10g 灌胃量计算:V=25.950*0.1/10=0.26ml用注射器取0.26ml液体(自来水);2)按“三-2-1)”的方法抓住小鼠,使其头、颈和身体呈一直线;3)灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后即可推注药液,然后原方向将灌胃针抽出。
6. 腹腔注射1)吸取液体(自来水),将针头向上,吸取一段气体后,再缓慢排除气体,以达到取出气泡的效果。
2)按“三-2-1)”的方法捉拿小鼠,并使小鼠腹腔向上;3)事先吸取好液体的注射器针尖平面朝上,平行扎入皮内后,注射器与腹腔呈45度角刺入腹腔,感觉针尖部分可以移动,将注射针向后抽出一点,注射样品。

动物实验的基本技术和方法动物实验是科学研究中常用的一种手段,通过对动物进行实验,可以了解生物体的生理、病理、药理等信息,对人类疾病的预防和治疗起到重要作用。
下面将介绍动物实验的基本技术和方法。
1.动物选择:选择适合进行实验的动物是进行动物实验的首要任务。
常用的实验动物有小鼠、大鼠、兔子、猪、狗等。
根据研究目的的不同,可以选择不同品种、不同年龄、不同性别的动物进行实验。
2.动物养护:对于实验动物的养护是确保实验结果可靠的重要环节。
动物应在适宜的温度、湿度和光照条件下饲养,并提供适宜的饲料和水源。
为了防止交叉感染,需要实施严格的无菌操作和动物消毒。
3.动物注射:动物注射是常用的动物实验技术之一、通过针筒和注射器将药物或其他物质注射到动物体内,以研究其作用机制。
常见的注射方式有皮下注射、肌肉注射和静脉注射。
4.动物手术:动物手术是进行生理、病理研究的重要手段。
常见的动物手术包括造模手术、器官移植手术和腹腔镜手术等。
在进行动物手术时,需要注意术前麻醉、手术操作的细节和术后的护理。
5.动物观察:动物观察是动物实验中重要的实验方法之一、通过观察动物行为、体征和疾病发展等,了解其生理和病理状态。
动物观察可以采用直接观察和间接观察的方法,比如记录动物的活动情况、进食量、体重变化等。
6.动物取样和检测:在动物实验中,需要采集动物的组织、血液、尿液等样本进行检测。
常用的动物取样方式有穿刺、切片、摘取组织等。
取样后,可以进行生化分析、免疫表型分析等检测方法进行进一步研究。
7.数据统计和分析:对于动物实验的结果,需要进行数据统计和分析,以得出科学的结论。
常用的统计分析方法有t检验、方差分析、回归分析等。
通过数据的处理和分析,可以确定实验结果的可靠性和显著性。
8.动物伦理:在进行动物实验时,需要遵循动物伦理原则,确保动物的福利和权益。
包括动物的合理饲养和管理、注重动物的生理和心理健康、减少动物的痛苦和不适等。
同时,需要通过伦理审查机构的审批,确保实验符合伦理要求。

三、动物实验的基本技术(一)实验动物的捉持方法1.青蛙和蟾蜍通常用左手握持,以食指和中指夹住左前肢,大拇指压住右前肢,右手将下肢拉直并固定于无名指和小指之间。
毁脑和脊髓时,左手食指和中指夹持青蛀或蟾蜍的头部,右手将探针经枕骨大孔向前刺入颅腔,左右摆动探针捣毁脑组织。
如需破坏脊髓,毁脑后退回探针刺入椎管即可。
2.小鼠右手提起鼠尾,放在鼠笼(或其它粗糙面)上,向后轻拉其尾,小鼠即固定于鼠笼上,迅速用左手拇指和食指捏住小鼠头颈部皮肤,并以左手小指、无名指压其尾部于手掌尺侧。
另一方法是只用左手,先用食指和拇指抓住小鼠尾巴后用手掌尺侧和小指夹住尾根部,然后用左手拇指和食指捏住头颈部皮肤。
3.大鼠捉持方法与小鼠相似。
因大鼠容易被激怒咬人,捉持时左手应戴防护手套。
右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与手掌握住脊部和腹部。
注意不要捏其颈部,以防用力过大、过久,造成窒息死亡。
4.豚鼠以左手直接从背侧握持前部躯干,右手托住臀部或抓住两后肢。
体重小者,可用单手捉持。
5.家兔一只手抓住兔颈背部皮肤,将兔轻轻提起,另一只手托住臀部,使兔呈蹲坐姿势。
切不可用手握持双耳提起兔子。
(二)实验动物的性别辨认、标记和去毛方法1.性别辨认鼠类:雄性小鼠和大鼠性器官与肛门距离较远,其间有被毛,阴囊明显可见。
雌性小鼠和大鼠性器官与肛门距离较近,其间无被毛,腹部乳头明显可见。
豚鼠性别辨认方法与小鼠和大鼠相同;家兔:雄兔泄殖孔附近,可见阴囊,用拇指和食指挤压泄殖孔部位,可露出阴茎。
雌兔腹部5对乳头明显可见。
2.标记小鼠、大鼠和兔多采用染色法,一般用1%的苦味酸溶液(黄色)或5%中性红溶液(红色)涂于动物体表不同部位的皮毛处,代表不同号码。
编号原则是先左后右,自前到后。
例如1号涂左前肢;2号涂左侧腹部;本号涂后肢;4号涂右前肢;5号涂右侧腹部;6号涂右后肢;7号涂头部;8号涂背部;9号涂尾部;10号不涂色。
如10只以上动物作标记时,可用两种不同颜色溶液,一种颜色作为个位数,另一种颜色作为十位数,涂在不同部位。

动物实验基本操作一、实验动物的抓取与固定。
(一)小鼠。
1. 抓取。
- 用右手拇指和食指捏住小鼠尾巴中部将其提起,放在鼠笼盖或其他粗糙表面上。
当小鼠向前挣扎时,用左手的拇指和食指迅速捏住小鼠两耳后颈背部皮肤,无名指和小指夹住小鼠尾巴根部,将小鼠固定成头部略向上的姿势。
- 原因:捏住尾巴提起小鼠可以避免小鼠咬伤操作人员,将其放在粗糙表面上是利用小鼠的本能反应(向前挣扎),便于后续准确抓取其颈背部皮肤。
而固定成头部略向上的姿势有利于进行诸如灌胃、注射等操作,并且能防止小鼠咬伤操作人员脸部等部位。
2. 固定。
- 如需进一步固定,可将小鼠放在特制的小鼠固定器内,将其身体和四肢固定好。
也可以将小鼠固定在泡沫板上,用大头针固定其四肢(这种方法常用于解剖实验)。
- 原因:使用固定器可以确保小鼠在实验过程中保持稳定,减少因挣扎而影响实验操作的准确性,同时也能保障操作人员的安全。
对于解剖实验,在泡沫板上用大头针固定四肢可以充分暴露小鼠的身体结构,便于进行精细的解剖操作。
(二)大鼠。
1. 抓取。
- 先用右手抓住大鼠尾巴中部,将大鼠提起,放在粗糙平面上。
然后用左手戴防护手套(大鼠体型较大且可能会激烈挣扎,容易咬伤操作人员),从大鼠背部绕到其胸前,拇指和食指捏住大鼠两耳后颈背部皮肤,其余手指握住大鼠身体,将其提起固定。
- 原因:与小鼠抓取类似,先抓住尾巴提起是为了初步控制大鼠,放在粗糙平面上利用其向前挣扎的本能便于后续抓取。
戴防护手套是因为大鼠的咬合力较强,为了防止操作人员受伤。
2. 固定。
- 可将大鼠放入大鼠固定器中固定。
对于需要进行手术等操作的大鼠,也可将其麻醉后固定在手术台上,用绑带固定其四肢。
- 原因:固定器和手术台固定都能保证大鼠在实验过程中保持稳定,使实验操作能够顺利进行,尤其是在进行需要精细操作的手术时,稳定的固定是确保手术成功的关键因素之一。
二、实验动物的给药操作。
(一)口服给药。
1. 灌胃法(以小鼠为例)- 准备好灌胃针(一般为特制的金属针具)和相应的药物溶液。


动物实验基本操作技术1. 什么是动物实验?动物实验,顾名思义,就是用动物来做实验。
这可是个很有争议的话题,有人觉得这是科学进步的必要步骤,有人则认为这样对小动物太不公平。
其实,动物实验在医学、心理学、毒理学等领域都扮演着重要角色,就像是科学界的小伙伴,帮助我们找到很多问题的答案。
它让我们在研发新药、测试产品之前,先看看这些东西对生命的影响。
嘿,谁会愿意拿自己去试验呢,对吧?2. 动物实验的基本操作2.1 准备工作开始实验前,咱们得做好充分的准备工作。
想象一下,你准备去野外露营,得先把帐篷、食物、睡袋全都备齐,动物实验也是一样。
首先,你得了解实验的目的,确保你知道自己要干嘛。
接着,选好实验动物,常见的有小鼠、大鼠、兔子等。
它们可是咱们的实验小明星哦!要确保动物的健康状况良好,毕竟,咱们可不能让小动物们在实验中受苦。
2.2 操作过程好了,准备工作都做好了,咱们就可以开始操作了。
在实验过程中,保持冷静和专注是关键。
比如说,给小动物打针的时候,手一定要稳,不然就像大厨切菜时不小心切到手一样,得不偿失。
此外,注意观察动物的反应,如果它们表现得很不舒服,那可得立即停止实验。
记住,咱们不是要折磨它们,而是要让它们帮助我们获取知识。
3. 实验后的处理3.1 数据记录实验结束后,别急着松一口气,咱们还有一项重要工作——记录数据。
好比你考试后要整理笔记,数据记录能帮助咱们分析实验结果。
确保每一个细节都被记录下来,包括动物的状态、实验条件等等,这些都是今后研究的重要参考。
没有记录,实验就像是没吃过的榴莲,香味全无,完全没办法享受。
3.2 动物的安置最后,咱们得考虑动物的安置问题。
根据实验的性质,有些动物可能需要被安乐死,而有些则可以继续观察一段时间。
无论怎样,处理动物的时候一定要尊重它们。
动物也有生命,它们的价值不仅仅在于实验数据,更在于它们是这个地球上的一部分。
我们得对它们负责,尽量给它们一个体面的归宿。
4. 总结动物实验虽然重要,但这并不意味着我们可以随意对待小动物。
第十一章 动物实验基本技术内容提要:动物实验是生命科学研究的基本手段,是药物安全性评价的必要途径。
熟练的动物实验操作技术和技巧,是顺利完成动物实验并取得准确、可靠结果的保证。
本章详细介绍了实验动物的保定技术、麻醉方法、给药途径和方法、样本的采集方法以及试验结束如何人性化处理实验动物等技术措施,旨在为从事动物实验相关人员提供系统的良好操作规范。
关键词:保定;标记;麻醉;采血;安乐死。
动物实验是根据研究目的,恰当地选用标准的实验动物品种、品系,进行各种科学实验,观察和记录动物的反应过程或反应结果, 以探讨或检验生命科学中未知因素的专门活动。
生物医学的每一次重大发展与进步,几乎都与动物实验息息相关。
现代医学各领域中许多最重要的进步都是以动物实验研究与探索为基础的。
对新药进行药效和安全性评价时,需要借助动物实验;对新出现的疾病需要做出对策时,动物实验有时是关键的决定因素。
因此动物实验已成为医学、药学、生物学、畜牧学、兽医学等生命科学研究的基本手段之一,尽管在不同领域有不同的目的和应用,但其中所涉及的动物实验基本操作技术和实验方法是相通的。
因此研究人员掌握基本的动物实验技能是实验成功的前提与保证。
第一节 动物实验前的准备一、 实验动物的编号与标记编号与标记通常是动物实验开始时需要进行的第一项工作。
编号的目的是使个体易于识别,便于实验者观察每个动物的变化,并为下一步进行的分组工作做好准备。
无论何种编号方法,良好的标记方法都应满足号码清晰、耐久、简便和适用的要求。
(一)染色法染色法是使用化学药品在动物明显体位被毛上进行涂染以识别动物的方法。
染色法一般适用于白色大鼠、白色小鼠、豚鼠和白色家兔等动物的短期实验。
常用的染液有3%-5%的苦味酸溶液(黄色)、2%的硝酸银溶液(咖啡色)、0.5%的中性品红溶液(红色)。
标记时,用棉签或卷着纱布的玻璃棒或止血钳等蘸取少量上述溶液,在动物体的相应部位逆毛流方向涂上有色斑点。
动物实验是一项敏感和复杂的工作,必须在合乎伦理的前提下进行,且需要遵循相关法规和指南。
以下是一个基本的动物实验操作技术手册大纲,但请注意,实施动物实验前,确保已经获得了合适的伦理批准和遵循当地法规。
1. 实验前准备:-获取伦理委员会的批准。
-确保实验室和设备符合标准。
-训练实验人员,确保其了解实验目的和操作流程。
2. 动物选择和养护:-选择适当的实验动物种类。
-确保动物的健康状况和遗传背景。
-提供适当的饲料、水和住房条件。
3. 实验设计:-制定明确的实验计划和协议。
-随机分组和安排实验。
-控制实验变量,确保结果的可靠性。
4. 麻醉和手术技术:-使用适当的麻醉剂和疼痛缓解措施。
-实施外科手术时,保持严格的无菌操作。
-确保手术室环境符合标准。
5. 实验操作和数据收集:-严格遵循实验方案的步骤。
-使用精确的测量工具。
-记录和存储实验数据。
6. 动物监测:-定期监测实验动物的生理指标。
-观察动物行为和外观。
-确保动物福祉和及时干预。
7. 实验结束和处理:-完成实验后,安全地结束动物的参与。
-对实验动物进行适当的处置或重返饲养环境。
-清理和消毒实验设备和环境。
8. 数据分析和报告:-使用统计工具对数据进行分析。
-撰写实验报告,详细描述实验设计、方法和结果。
-提交实验结果给相关的科研机构或期刊。
9. 废弃物处理:-安全处理动物实验产生的废弃物。
-符合相关环境法规,确保废弃物不对环境造成污染。
10. 纪录保存和档案管理:-确保实验记录和数据的安全存储。
-遵循机构和法规的档案保存要求。
11. 反馈和改进:-定期进行实验室审核和评估。
-根据实验结果和经验,改进实验设计和操作流程。
请注意,这只是一个基本的手册大纲,具体的操作流程和技术要求可能根据实验的具体内容和动物种类而有所不同。
在进行任何动物实验之前,请确保阅读并遵循相关法规和伦理指南,以确保实验的合法性和伦理性。
动物实验的基本操作技术-25.非纯系动物(no-sheer series)一般是指任意交配繁殖的杂种动物。
此类动物具有生命力旺盛、适应性强、繁殖率高、生长快、易于饲养管理等优点。
其缺点是个体差异大、反应性不规则、实验结果的重复性差。
由于其中包含有最敏感的与最不敏感的两种极端的个体,因此适用于筛选性实验。
杂种动物比较经济、教学实验中最常用。
(二)按微生物控制分类根据实验动物所携带其它生命体的情况,目前我国将实验动物分为四个等级,即一级:普通动物;二级:清洁动物;三级:无特定病原体动物(SPF动物);四级:无菌动物(GF动物)和悉生动物(GN动物)。
1.普通动物(common animals):饲养在开放环境中,未经积极的微生物控制,不携带人兽共患病和动物烈性传染病病原体的动物。
2.清洁动物(clearing animals):是除一级动物应排除的病原外,不携带对动物危害大和对科学研究干扰大的病原体的动物。
3.无特定病原体动物(SPF动物)无特定病原体动物简称SPF动物:是指除一、二级动物应排除的病原外,不携带主要潜在感染或条件致病和对科学实验干扰大的病原体实验动物。
4.无菌动物(GF)是指体表、体内任何部位均检不出微生物、寄生虫的实验动物。
此种动物系在无菌条件下剖腹取出。
在无菌、恒温、恒湿的条件下饲养。
食物与饮料全部无菌。
5.悉生动物(GN)是指在无菌动物体内,移入一种或几种已知微生物后的动物。
悉生动物繁殖饲养条件复杂、价格昂贵,故不适用于教学,但对某些生物医学研究具有重要的意义。
普通动物和清洁动物因价格较低,常常用于教学实验。
实验动物的选择一、种属的选择( genus excerpt)根据不同的实验目的,选择相应的种属。
不同种属的动物对于同一疾病的刺激是有不同的反应程度的。
例如在进行过敏反应或变态反应实验时,应首选豚鼠,而做发热、热原检定、解热药的实验时应选择家兔、犬。
家免、大白鼠常用于高血压研究、小白鼠则宜进行各类肿瘤的实验研究。