标准电极电位表与电偶序
- 格式:doc
- 大小:12.00 KB
- 文档页数:2



《材料腐蚀与防护》课程笔记第一章绪论1.1 材料腐蚀学科特点材料腐蚀学科是研究材料在环境作用下性能退化的一门科学,它具有以下特点:- 多学科交叉:腐蚀现象涉及化学反应、电化学过程、材料科学、物理学、生物学等多个领域,因此材料腐蚀学科是一门典型的交叉学科。
- 实践性强:腐蚀问题无处不在,从日常生活到工业生产,都存在着材料腐蚀的问题,这要求腐蚀学科的研究具有很强的实践性和应用性。
- 复杂性:腐蚀过程往往受多种因素的影响,如环境条件、材料性质、应力状态等,这些因素的相互作用使得腐蚀问题非常复杂。
- 经济影响大:材料腐蚀会导致设备损坏、结构失效,从而造成巨大的经济损失和安全风险。
1.2 材料腐蚀学科的发展材料腐蚀学科的发展可以分为以下几个阶段:- 古代认知阶段:在古代,人们就已经意识到金属会随着时间的推移而腐蚀,但由于科学技术的限制,只能采取一些简单的防护措施,如涂油、包裹等。
- 近代科学阶段:19世纪末到20世纪初,随着化学和物理学的发展,科学家们开始系统地研究腐蚀现象,提出了电化学腐蚀理论。
- 现代技术阶段:20世纪中叶,随着电子技术、材料科学和电化学技术的进步,腐蚀学科得到了快速发展,出现了许多新的腐蚀防护技术和方法。
- 当代综合管理阶段:21世纪初,腐蚀学科进入了综合管理阶段,强调腐蚀控制的系统性和科学性,发展了腐蚀监测、风险评估和管理信息系统。
1.3 腐蚀的定义腐蚀是材料在环境介质的化学、电化学或物理作用下,其表面或内部发生变质,从而导致材料性能下降、结构破坏的过程。
这个过程通常伴随着能量的变化。
1.4 腐蚀的分类腐蚀可以根据不同的标准进行分类:- 按照腐蚀机理分类:化学腐蚀、电化学腐蚀、物理腐蚀。
- 按照腐蚀环境分类:大气腐蚀、水腐蚀、土壤腐蚀、高温腐蚀等。
- 按照腐蚀形态分类:均匀腐蚀、局部腐蚀(如点蚀、缝隙腐蚀、晶间腐蚀等)、应力腐蚀开裂、腐蚀疲劳等。
1.5 腐蚀速度表示方法腐蚀速度是衡量材料腐蚀程度的重要参数,常用的表示方法有:- 质量损失法:通过测量材料在一定时间内的质量损失来计算腐蚀速度,单位通常是毫克/平方厘米·小时(mg/cm²·h)。

标准电极电位和电动序标准电极电位和电动序是电化学中重要的概念,用来描述化学反应中电子转移的方向和速率。
本文将从以下几个方面详细介绍标准电极电位和电动序的相关知识。
一、标准电极电位的概念标准电极电位是指在标准状态下,与参考电极(一般为标准氢电极)相接触时,一个电极产生的电势。
标准状态指温度为25℃,压力为1 atm,溶液浓度为1 mol/L。
标准电极电位可以用下式表示:Eo(A/B)= Eo(A) - Eo(B)其中,Eo(A/B)表示A相对于B的标准电极电势,Eo(A)表示A的标准电极电势,Eo(B)表示B的标准电极电势。
标准电极电势的单位为伏特(V)或者毫伏(mV)。
二、电动序的概念电动序是指在标准条件下,不同金属电极与标准氢电极之间的标准电极电势的排列顺序。
电动序可以帮助我们判断化学反应中的电子转移方向,即当一个金属电极的电势高于另一个电极时,电子将从高电势电极流向低电势电极,进行氧化还原反应。
反之,则反应不会发生。
三、标准电极电势的测量方法标准电极电势是由于氧化还原反应发生时电子转移引起的电位差产生的。
因此,测量标准电极电势需要通过电池进行。
电池是由两个电极和一个电解质组成的装置,两个电极之间的电势差就是电池的电动势。
对于标准电极电势的测量,我们一般使用三电极法,即在溶液中将待测电极、参比电极和工作电极三个电极同时插入,测量待测电极相对于参比电极的电位差。
四、标准电极电势的影响因素标准电极电势受到很多因素的影响,例如温度、浓度、物质状态等等。
其中,温度是最为重要的因素之一。
标准电极电势与温度的变化存在一定的关联,一般情况下,随着温度的升高,电极电势也会增大。
此外,离子浓度和物质状态也会对标准电极电势产生一定的影响。
通常情况下,离子浓度越高,标准电极电势就越大。
对于气态物质来说,标准电极电势的大小则会受到压强的影响。
总的来说,标准电极电位和电动序是化学反应中电子转移方向和速率的重要概念。
了解标准电极电位的概念、测量方法、影响因素以及电动序能够帮助化学工作者更好地理解化学反应的机理和判断化学反应的可能性。

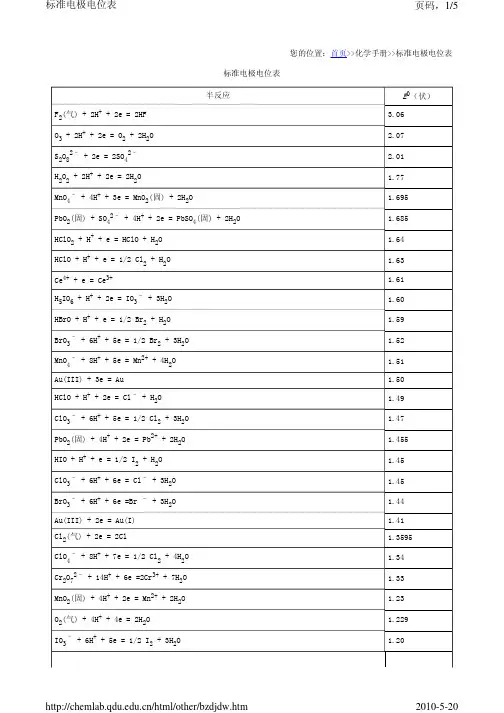
标准电极电位表与电偶序标准氢电极的电极电位人为地规定为零,其他电极的标准电极电位通常用氢标电位表示。
按氧化还原能力大小把各种可逆电极的标准平衡电极电位排列成表,此即所谓的标准电极电位表,也被称为电动序。
若干电极在二十五摄氏度的标准电极电位及其温度系数。
在一些文献和手册中对电极电位的正负号规定可能不一致,应该予以注意。
电位的正负反映了该电极体系与标准氢电极相比较的氧化还原能力。
对于金属电极来说,电位越负说明这个电极金属的还原能力越强,而对应的金属离子的氧化能力则越弱。
反而亦然。
因此,若将标准电极电位表中任意两个电极半电池组成原电池,其电极电位高低就可以表征孰为阳极,孰为阴极。
可以从倾向性上判断哪种金属可能被加速腐蚀,那种金属可能受到阴极性保护。
此外,标准电极电位别还可用来判断一定条件下金属的活泼性,氧化还原反应的方向,溶液中各种金属离子阴极析出的先后次序等。
但是,标准电极电位表在实际条件下应用的时候存在着重大的局限性。
其一,在某些情况下,由于金属盐的溶解度限制,金属离子的活度不可能等于一;其二,离子活度随着介质而变。
以至于实际的金属介质体系一般不能处于严格意义上的平衡态,更不可能是标准态;其三,对于合金材料目前尚没有标准电极电位可言。
因此,在实际应用中往往采用电偶序,这是一种按照金属和合金在制定介质中所实测的稳定电位而排列的电位序列表。
金属和合金分别在海水中和土壤中的电偶序。
有的金属在电偶序中可能占有两个位置,分别由金属的活化态和钝化态所决定的。
电偶序是一种非平衡的稳定电极电位表,它随介质而变。
根据电偶序可预示金属或者合金在该种介质中的活泼性和腐蚀反应的倾向,可以预测异种金属在该介质中接触的时候发生电偶腐蚀的可能性、电偶电池中金属的极性和反应方向。
当然,电偶腐蚀的程度和速度不仅取决于两种相接触的金属在电偶序中的位置,而且还决定于金属的极化性质和它们的相对面积比等许多因素。
标准电极电位表与电偶序
标准氢电极的电极电位人为地规定为零,其他电极的标准电极电位通常用氢标电位表示。
按氧化还原能力大小把各种可逆电极的标准平衡电极电位排列成表,此即所谓的标准电极电位表,也被称为电动序。
若干电极在二十五摄氏度的标准电极电位及其温度系数。
在一些文献和手册中对电极电位的正负号规定可能不一致,应该予以注意。
电位的正负反映了该电极体系与标准氢电极相比较的氧化还原能力。
对于金属电极来说,电位越负说明这个电极金属的还原能力越强,而对应的金属离子的氧化能力则越弱。
反而亦然。
因此,若将标准电极电位表中任意两个电极半电池组成原电池,其电极电位高低就可以表征孰为阳极,孰为阴极。
可以从倾向性上判断哪种金属可能被加速腐蚀,那种金属可能受到阴极性保护。
此外,标准电极电位别还可用来判断一定条件下金属的活泼性,氧化还原反应的方向,溶液中各种金属离子阴极析出的先后次序等。
但是,标准电极电位表在实际条件下应用的时候存在着重大的局限性。
其一,在某些情况下,由于金属盐的溶解度限制,金属离子的活度不可能等于一;其二,离子活度随着介质而变。
以至于实际的金属介质体系一般不能处于严格意义上的平衡态,更不可能是标准态;其三,对于合金材料目前尚没有标准电极电位可言。
因此,在实际应用中往往采用电偶序,这是一种按照金属和合金在制定介质中所实测的稳定电位而排列的电位序列表。
金属和合金分别在海水中和土壤中的电偶序。
有的金属在电偶序中可能占有两个位
置,分别由金属的活化态和钝化态所决定的。
电偶序是一种非平衡的稳定电极电位表,它随介质而变。
根据电偶序可预示金属或者合金在该种介质中的活泼性和腐蚀反应的倾向,可以预测异种金属在该介质中接触的时候发生电偶腐蚀的可能性、电偶电池中金属的极性和反应方向。
当然,电偶腐蚀的程度和速度不仅取决于两种相接触的金属在电偶序中的位置,而且还决定于金属的极化性质和它们的相对面积比等许多因素。