材料科学基础第2章-4
- 格式:ppt
- 大小:3.74 MB
- 文档页数:58

《材料科学基础》总结及重点第一章 材料的结构与键合1、金属键、离子键、共价键、分子键(范德华力)、氢键的特点,并解释材料的一些性能特点。
2、原子间的结合键对材料性能的影响。
用金属键的特征解释金属材料的性能—①良好的延展性;②良好的导电、导热性;③具有金属光泽。
3、比较金属材料、陶瓷材料、高分子材料、复合材料在结合键上的差别。
本章重要知识点: 1. 金属键、离子键、共价键、分子键、氢键的特点。
第二章 固体结构1、晶体与非晶体(在原子排列上的区别)2、空间点阵、晶格、晶胞及选取晶胞的的原则、七大晶系及各自的特点,布拉菲点阵(14种) 、晶格常数、晶胞原子数。
3、晶面指数、晶面族、晶向指数、晶向族、晶带和晶带定理、晶面间距、配位数、致密度、八面体间隙、四面体间隙。
各向同性与各向异性、实际晶体的伪各向异性、同素异构转变(重结晶、多晶型性转变) 。
(1)指数相同的晶向.和晶面必然垂直。
如[111]⊥(111)(2)当一晶向[uvw]位于或平行某一晶面(hkl )时,则必然满足晶带定理:h ·w+k ·v+l ·w =04、能绘出三维的体心、面心立方和密排六方晶胞,根据原子半径计算出金属的体心和面心立方晶胞的晶胞常数。
三种典型晶体结构的特征(包括:晶胞形状、晶格常数、晶胞原子数、原子半径、配位数、致密度、各类间隙尺寸与个数,最密排面(滑移面)和最密排方向的指数与个数,滑移系数目等);即:bcc 、fcc 、hcp 的晶格特征及变形能力(结合塑性变形一章的内容你必须知道常用金属材料的滑移面与滑移系的指数)。
给画出晶胞指出滑移面和滑移方向。
能标注和会求上述三种晶胞的晶向和晶面指数。
晶向和晶面指数的一些规律。
求晶面间距d (hkl )、晶面夹角。
5、晶面间距:d (hkl ) 的求法:(1)立方晶系:222)(l k h ad hkl ++= (2)正交晶系:222)(1⎪⎭⎫ ⎝⎛+⎪⎭⎫ ⎝⎛+⎪⎭⎫ ⎝⎛=c l b k a h d hkl (3)六方晶系:2222)()(341⎪⎭⎫ ⎝⎛+++=c l a k hk h d hkl (4)四方晶系:2222)()/(/)(1c l a k h d hkl ++=以上公式仅适用于简单晶胞,复杂晶胞要考虑其晶面层数的增加。


《材料科学基础》课后习题答案第一章材料结构的基本知识4. 简述一次键和二次键区别答:根据结合力的强弱可把结合键分成一次键和二次键两大类。
其中一次键的结合力较强,包括离子键、共价键和金属键。
一次键的三种结合方式都是依靠外壳层电子转移或共享以形成稳定的电子壳层,从而使原子间相互结合起来。
二次键的结合力较弱,包括范德瓦耳斯键和氢键。
二次键是一种在原子和分子之间,由诱导或永久电偶相互作用而产生的一种副键。
6. 为什么金属键结合的固体材料的密度比离子键或共价键固体为高?答:材料的密度与结合键类型有关。
一般金属键结合的固体材料的高密度有两个原因:(1)金属元素有较高的相对原子质量;(2)金属键的结合方式没有方向性,因此金属原子总是趋于密集排列。
相反,对于离子键或共价键结合的材料,原子排列不可能很致密。
共价键结合时,相邻原子的个数要受到共价键数目的限制;离子键结合时,则要满足正、负离子间电荷平衡的要求,它们的相邻原子数都不如金属多,因此离子键或共价键结合的材料密度较低。
9. 什么是单相组织?什么是两相组织?以它们为例说明显微组织的含义以及显微组织对性能的影响。
答:单相组织,顾名思义是具有单一相的组织。
即所有晶粒的化学组成相同,晶体结构也相同。
两相组织是指具有两相的组织。
单相组织特征的主要有晶粒尺寸及形状。
晶粒尺寸对材料性能有重要的影响,细化晶粒可以明显地提高材料的强度,改善材料的塑性和韧性。
单相组织中,根据各方向生长条件的不同,会生成等轴晶和柱状晶。
等轴晶的材料各方向上性能接近,而柱状晶则在各个方向上表现出性能的差异。
对于两相组织,如果两个相的晶粒尺度相当,两者均匀地交替分布,此时合金的力学性能取决于两个相或者两种相或两种组织组成物的相对量及各自的性能。
如果两个相的晶粒尺度相差甚远,其中尺寸较细的相以球状、点状、片状或针状等形态弥散地分布于另一相晶粒的基体内。
如果弥散相的硬度明显高于基体相,则将显著提高材料的强度,同时降低材料的塑韧性。




第一章原子结构与键合1. 主量子数n、轨道角动量量子数l i、磁量子数m i和自旋角动量量子数S i。
2. 能量最低原理、Pauli不相容原理,Hund规则。
3. 同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强;同一主族元素核外电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低,失电子能力增加,得电子能力降低,金属性增加,非金属性降低;4. 在元素周期表中占据同一位置,尽管它们的质量不同,然它们的化学性质相同的物质称为同位素。
由于各同位素的含中子量不同(质子数相同),故具有不同含量同位素的元素总的相对原子质量不为正整数。
5. 52.0576. 73% (Cu63); 27% (Cu65)8. a:高分子材料;b:金属材料;c:离子晶体10.a) Al2O3的相对分子质量为M=26.98×2+16×3=101.961mm3中所含原子数为1.12*1020(个)b) 1g中所含原子数为2.95*1022(个)11. 由于HF分子间结合力是氢键,而HCl分子间结合力是范德化力,氢键的键能高于范德化力的键能,故此HF的沸点要比HCl的高。
第2章固体结构1.每单位晶胞内20个原子2.CsCl型结构系离子晶体结构中最简单一种,属立方晶系,简单立方点阵,Pm3m空间群,离子半径之比为0.167/0.181=0.92265,其晶体结构如图2-13所示。
从图中可知,在<111> 方向离子相接处,<100>方向不接触。
每个晶胞有一个Cs+和一个Cl-,的配位数均为8。
3.金刚石的晶体结构为复杂的面心立方结构,每个晶胞共含有8个碳原子。
金刚石的密度(g/cm3)对于1g碳,当它为金刚石结构时的体积(cm3)当它为石墨结构时的体积(cm3)故由金刚石转变为石墨结构时其体积膨胀4.]101[方向上的线密度为1.6. 晶面族{123}=(123)+(132)+(213)+(231)+(321)+(312)+)231(+)321(+)132(+)312(+)213(+)123(+)321(+)231(+)312(+)132(+)123(+)213(+)312(+)213(+)321(+)123(+)132(+)231(晶向族﹤221﹥=[221]+[212]+[122]+]212[+]122[+]221[+]122[+]212[+]221[+]122[+]221[+]212[7. 晶带轴[uvw]与该晶带的晶面(hkl)之间存在以下关系:hu+kv+lw=0;将晶带轴[001]代入,则h×0+k×0+l×1=0;当l=0时对任何h,k取值均能满足上式,故晶带轴[001]的所有晶带面的晶面指数一般形式为(hk0)。

中南大学材料科学基础课后习题答案(总12页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第一章 原子排列与晶体结构1. [110], (111), ABCABC…, , 12 , 4 , a r 42=; [111], (110) , , 8 , 2 , a r 43= ; ]0211[, (0001) , ABAB , , 12 , 6 , 2a r =。
2., 4 , 8 。
3.FCC , BCC ,减少 ,降低 ,膨胀 ,收缩 。
4.解答:见图1-1 5. 解答:设所决定的晶面为(hkl ),晶面指数与面上的直线[uvw]之间有hu+kv+lw=0,故有:h+k-l=0,2h-l=0。
可以求得(hkl )=(112)。
6 解答:Pb 为fcc 结构,原子半径R 与点阵常数a 的关系为a r 42=,故可求得a =×10-6mm 。
则(100)平面的面积S =a 2=×0-12mm 2,每个(100)面上的原子个数为2。
所以1 mm 2上的原子个数s n 1==×1012。
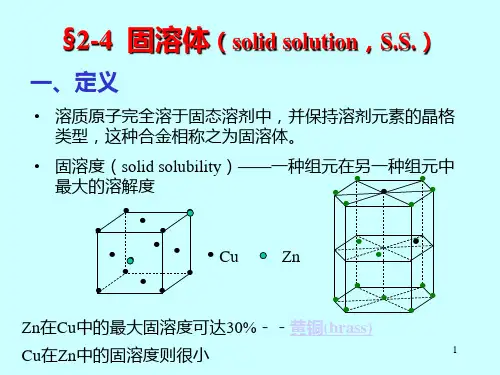
第二章 合金相结构一、 填空1) 提高,降低,变差,变大。
2) (1)晶体结构;(2)元素之间电负性差;(3)电子浓度 ;(4)元素之间尺寸差别3) 存在溶质原子偏聚 和短程有序 。
4) 置换固溶体 和间隙固溶体 。
5) 提高 ,降低 ,降低 。
6) 溶质原子溶入点阵原子溶入溶剂点阵间隙中形成的固溶体,非金属原子与金属原子半径的比值大于时形成的复杂结构的化合物。
二、 问答1、 解答: -Fe 为bcc 结构,致密度虽然较小,但是它的间隙数目多且分散,间隙半径很小,四面体间隙半径为,即R =,八面体间隙半径为,即R =。
氢,氮,碳,硼由于与-Fe 的尺寸差别较大,在-Fe 中形成间隙固溶体,固溶度很小。
-Fe 的八面体间隙的[110]方向R= Ra ,间隙元素溶入时只引起一个方向上的点阵畸变,故多数处于-Fe 的八面体间隙中心。


附:习题答案0 绪论一、填空题1. 结构,性能2. 原子结构、原子的空间排列、显微组织3.结构材料,功能材料;金属材料,无机非金属材料(陶瓷),高分子材料(聚合物)。
第1章一、填空题1、金属键,离子键、共价键,分子键、共价键2、金属键、离子键、共价键,_范德华键_、氢键。
3、共价键4、共价键5、共价键,氢键二、判断题(1)错。
离子键没有方向性和饱和性。
(2)对。
(3)错。
改为:S原子轨道的角度分布图为一个从原子核为球心的球面,而s电子云图是一个球体,其剖面图是个圆。
P轨道的角度分布图为两个在原点相切的球面。
而p电子云图像或几率分布是一个哑铃形体,其剖面图是∞字型。
(4)错。
改为:若用小黑点的疏度表示几率密度的大小,则黑点密的地方,表示|Ψ|2数值大,电子出现的几率大;黑点稀的地方表示|Ψ|2数值小,电子出现的几率小。
(5)错。
改为:主量子数为4时,有4s、4p、4d、4f四个亚层。
共16条轨道。
(6)错。
改为:多电子原子轨道能级与氢原子能级不同。
三、简答题1. H>He;Ba>Sr;Sc<Ca;Cu>N;Zr≈Hf;La>Gd;S2->S;Na>Al3+;Fe2+>Fe3+;Pb2+>Sn2+2.(1)金属性:Ge>Si>As (2) 电离能:As>Si>Ge(3) 电负性:As>Si≈Ge (4) 原子半径:Ge>As>Si3.因氢原子核外只有一个电子,核外运动的电子能量由主量子数n决定,n相同时能量相同。
而氯原子中核外有17个电子,核外运动的电子能量不仅与主量子数n有关,而且也与角量子数L有关,3s的穿透能力大于3p,故3s能级低于3p能级。
第2章综合习题----基础练习 一、填空题1、基元(原子团)以周期性重复方式在三维空间作有规则的排列的固体 。
2、是否在三维空间作周期性重复规则排列( 晶体原子排布长程有序,非晶体是长程无序短程有序) 。
第三版胡赓祥材料科学基础的知识点总结及课后答案第一章材料科学基础概念知识点总结1. 材料的定义与分类:材料是制造各种结构和器件的物质基础,可分为金属材料、无机非金属材料、有机高分子材料和复合材料等。
2. 材料的性能:包括力学性能、热性能、电性能、磁性能等,是评价材料性能好坏的重要指标。
3. 晶体结构:晶体是由原子、离子或分子按照一定的空间点阵排列成的周期性结构,常见的晶体结构有金属晶体、离子晶体、共价晶体和分子晶体等。
4. 材料的制备方法:包括合成、加工、处理等,如熔炼、铸造、轧制、挤压、拉伸、热处理、腐蚀等。
5. 材料的设计与性能调控:根据材料的使用性能要求,进行结构、组成和制备工艺的设计,以实现性能的优化。
课后答案1. 材料是什么?请举例说明。
答案:材料是制造各种结构和器件的物质基础,如钢铁、水泥、塑料、玻璃等。
2. 材料的性能有哪些?它们对材料的用途有何影响?答案:材料的性能包括力学性能、热性能、电性能、磁性能等,不同的性能影响材料在不同领域的应用。
例如,塑料的具有良好的柔韧性和耐腐蚀性,广泛应用于包装、建筑等领域;金属材料具有良好的导电性和导热性,广泛应用于电子、能源等领域。
3. 晶体结构有哪些类型?请简要介绍。
答案:晶体结构有金属晶体、离子晶体、共价晶体和分子晶体等类型。
金属晶体是由金属原子按照一定的空间点阵排列成的结构,具有较高的强度和韧性;离子晶体是由正负离子按照一定的空间点阵排列成的结构,具有较高的熔点和硬度;共价晶体是由共价键连接的原子按照一定的空间点阵排列成的结构,具有较高的硬度和脆性;分子晶体是由分子按照一定的空间点阵排列成的结构,具有较低的熔点和脆性。
4. 材料的制备方法有哪些?它们对材料性能有何影响?答案:材料的制备方法包括合成、加工、处理等,如熔炼、铸造、轧制、挤压、拉伸、热处理、腐蚀等。
不同的制备方法对材料的性能有不同的影响。
例如,熔炼法制备的金属材料具有较高的纯度和均匀性;热处理工艺可以改变金属材料的组织结构和性能,如提高硬度和强度等。
北京科技大学材料科学与工程专业814 材料科学基础主讲人:薛老师第二章固体结构例题讲解1.什么是晶面族?立方晶系{111}晶面族包含哪些晶面?答:在晶体内凡是晶面间距和晶面上的原子分布完全相同,只是空间位向不同的晶面我们可以把它们归并为同一个晶面族中,即晶面族,用{hkl}表示。
立方晶系{111}包括:(111)(111)(111)(111)(111)(111)(111)(111),这八个晶面构成一个八面体,因此晶面族{111}也成为八面体的面。
2.面心立方结构(100)和(111)晶面的夹角是多少?{100}的面间距是多少?答:(1) 所以:222222321321332211,cos b b b a a a b a b a b a ba b a b a ++⨯++++=⨯⨯>=<31111001101011cos 222222=++++⨯+⨯+⨯=ϕ︒==7.5431cos arc ϕ晶面的位向表示方法!!(2)面心立方,晶面间距:晶面为{100},则带入公式,得到d=a,(a 最好自己设一下)因为是立方晶系需要对晶面进行判断是否需要修复!!面心立方h 、k 、l 不全为奇数或者偶数时,需要修正,可知,该晶面需要修正所以:d=a/2.222)()()h (d l k a hkl ++=3.晶带定律的应用例:已知晶体中两个不平行的晶面(h1k1l1)(h2k2l2),证明(h3k3l3)与这两个晶面属于同一晶带,其中h3=h2+h1,k3=k2+k1,l3=l2+l1.答:设两个不平行的晶面所属晶带的晶带轴为[uvw]。
根据晶带定律,带入已知条件得到:h1u+k1v+l1w=0,h2u+k2v+l2w=0移项相加,得:(h1+h2)u+(k1+k2)v+(l1+l2)w=0,带入题目中的已知条件,可以得到h3u+k3v+l3w=0所以,第三个晶面与前面两个晶面属于同一个晶带。
例:在体心立方晶胞中画出一个最密排方向,并标明晶向指数,再画出过该方向的两个不同的低指数晶面,写出对应的晶面指数,这两个晶面与晶向构成什么关系?xzy G FE DOCBA注意点:1.画图一定要清洗,最好分开类画2.选取晶向的时候一定要选择对后期选择晶面有利的晶向3.回答晶带时,最好加上什么是晶带定律?4.六方晶系晶面、晶向指数例:写出图中六方晶胞EFGHIJE的晶面指数,以及EF,FG,GH,HI,IJ,JE 各晶向的晶向指数。
材料科学基础(中南大学)中南大学智慧树知到答案2024年第一章测试1.fcc可以看成是原子在密排面(111)面在空间的堆垛。
A:对 B:错答案:A2.已知Al为正三价,阿伏加德诺常数为6.02×1023,铝摩尔量为26.98,质量1g的Al中的价电子数量为( )。
A:6.69×10∧23 B:6.69×10∧22 C:6.02×10∧22 D:6.69×10∧21答案:B3.聚乙烯高分子材料中,C-H化学键结合属于()。
A:金属键 B:氢键 C:共价键 D:离子键答案:C4.化学键中,没有方向性也没有饱和性的为()。
A:离子键 B:共价键 C:金属键 D:氢键答案:C5.晶体的对称轴不存在()对称轴。
A:五次 B:六次 C:四次 D:三次答案:A6.晶面族是指一系列平面的晶面。
A:对 B:错答案:B7.一个晶胞内原子个数、配位数对于fcc是(),bcc是()。
A:4,8 B:2,8 C:4,12 D:2,12答案:BC8.bcc晶胞的密排面是(),密排方向分别是()。
A:{110} B:{111} C:<111> D:<110>答案:AC9.A:8.98 B:7.78 C:8.58 D:8.28答案:A10.晶带是与过某个晶向或与其平行的所有晶面,这个晶向称为晶带轴。
若晶带轴指数为[uvw],则[uvw]与晶带中的一个晶面(hkl)这两个指数之间点积,[uvw]·(hkl)等于()。
A:1 B:0.5 C:-1 D:0答案:D11.一个fcc晶胞的原子中的原子个数为()个。
A:4 B:6 C:8 D:2答案:A12.一个bcc晶胞中的原子个数为()个。
A:6 B:8 C:2 D:4答案:C13.铜和镍属于异质同构。
A:错 B:对答案:B14.间隙固溶体中间隙原子可以无限固溶得到固溶度为100%的无限固溶体。
A:对 B:错答案:B15.一个金属元素与一个非金属元素容易形成固溶体。