电子式表示共价键
- 格式:ppt
- 大小:477.00 KB
- 文档页数:19

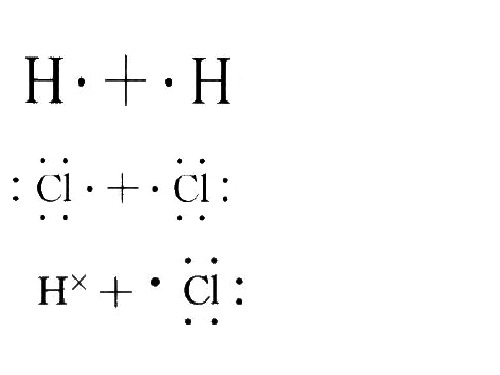


二、共价键1、概念:原子间通过共用电子对所形成的相互作用叫共价键。
(1)共价键的成因:○1通过共用电子对,使每个原子均达到稳定结构 ○2 电子对的引力平衡 ○3 体系能量降低 (2)共价键的成键元素:○1 相同的原子间以共价键相结合,如:H 2、I 2、C 、S ○2 不同非金属元素组成的分子化合物,如:SiO 2、H 2O 、CH 4、2CO 、CO 、SO 2、H 2SO 4、HNO 3、NH 3·H 2O ○3 原子团:SO 42—、NO 3—、CO 32—、NH 4+ ○4 少部分金属元素与非金属元素原子之间以共价键相结合,如:AlCl 3 写出--+2242222O OH NH HClO S H CO Cl H 、、、、、、、的电子式和结构式。
___、____、____、____、____、____、____、____。
2.(重点)用电子式表示共价分子的形成过程。
用电子式表示I 2、2CO 、H 2O 、H 2S 、NH 3的形成过程:I 2:____________;2CO :____________;H 2O :____________;H 2S :____________;NH 3:____________。
3.非极性键与极性键(1)非极性键:由同种元素的原子间形成的共价键。
○1 特征:共用电子对不偏移 ○2存在于:非金属单质:Cl 2、P 4 共价化合物:H 2O 2离子化合物:FeS 2、CaC 2、Na 2O 2(2)极性键:由不同种元素的原子间形成的共价键。
○1 特征:共用电子对偏向吸引电子能力强得一方 ○2存在于:共价化合物:2CO 、H 2SO 4 离子化合物:NH 4Cl 、NaOH4.判断:(1)含有共价键的化合物一定是共价化合物(2)全部由非金属元素组成的化合物一定是共价化合物(3)在气态单质分子里一定有非极性共价键[例4] A 、B 、C 、D 四种元素,原子序数依次增大,A 原子的最外层上有4个电子;B 的阴离子和C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E ,D 的L 层电子数等于K ,M 两个电子层上电子数之和。

第三节化学键一.离子键1.离子键:(1)离子键形成的一般条件:,特殊:。
(2)形成离子键的微粒:;相互作用:;2.电子式:(1)原子电子式:在元素符号周围用“·”(或“×”)标出最外层电子.......1)钠原子2)铝原子3)硫原子4)氙原子5)碘原子二.共价键1.共价键:(1)共价键形成的一般条件:。
(2)形成共价键的微粒:;相互作用:;2.复杂粒子电子式(1)阳离子电子式:单核阳离子直接用离子符号表示,多原子阳离子要标出最外层电子,再括上“[ ]”, 且在“[ ]”右上方标上所带的正电荷。
1)钠离子2)铝离子3)钡离子4)钙离子5)铵根离子(2)阴离子电子式:要标出最外层电子,再括上“[ ]”, 且“[ ]”右上方标上所带的负电荷。
1)氟离子2)溴离子3)碘离子4)氧离子5)硫离子6)氢氧根离子(3)离子化合物:1)溴化钾2)碘化钙3)过氧化钠4)K2S 5)NaHS 6) 氢氧化镁7)氯化铵共价化合物:1)氟化氢2)氨气3)二氧化碳4)水5)甲烷6)次氯酸例1.写出下列物质的电子式:1)液溴2)硫化氢3)氢氧化钾4)氧化钾5)氯化镁例2.用电子式表示下列物质的形成过程:1)溴化钙2)硫化氢3)氧化钾4)水3.极性键和非极性键(2)极性键形成的一般条件: 。
(3)非极性键形成的一般条件: 。
4.化学键是 。
三.化学反应的本质是______________________________________________________________________【针对训练】1.下列化合物中,含有非极性键的离子化合物是A. Ba(OH)2B. H 2SO 4C. Na 2O 2D. CaCl 22.下列性质中,可以证明某化合物内一定存在离子键的是A .可溶于水B .有较高的熔点C .水溶液能导电D .熔融状态能导电3.下列说法中正确的是A 两个原子或多个原子之间的相互作用叫做化学键B 阴阳离子间通过静电引力而形成的化学键叫做离子键C 只有金属元素和非金属元素化合时才能形成离子键D 大多数的盐、碱和低价金属氧化物中含有离子键4.下列说法中正确的是A 含有共价键的分子一定是共价分子B 只含有共价键的物质一定是共价化合物C 离子化合物中可能含有极性共价键或非极性共价键D 氦分子中含有共价键5.80年代,科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C 60。
化学键的表示方法
化学键呢,主要有离子键、共价键这些。
那离子键咋表示呢?一般就用电子式来表示啦。
比如说氯化钠,钠原子最外层有一个电子,氯原子最外层有七个电子。
钠把这个电子给了氯,那在写电子式的时候,钠离子就写成Na⁺,它外面没有电子了哦。
氯离子呢,写成[Cl]⁻,周围有八个电子,就像小括号把它包起来一样,这就表示出了离子键的形成,电子的转移情况看得明明白白的。
再说说共价键的表示方法。
共价键是原子之间共用电子对形成的键。
这时候也能用电子式表示。
像氢气,两个氢原子各拿出一个电子来共用,写成H:H,中间那两个点就表示共用的电子对啦。
还有水分子,氧原子最外层有六个电子,它和两个氢原子分别共用一对电子,电子式就是H:O:H,氧原子周围还有两对孤对电子呢。
除了电子式,还有结构式。
结构式就更直观地表示出原子之间的连接方式了。
还说水分子,它的结构式就是H - O - H,中间的短线就代表共价键,也就是共用电子对。
二氧化碳的结构式是O = C = O,这里的等号表示碳和氧之间是双键,共用了两对电子呢。
宝子们可别小看这些表示方法呀。
它们就像化学世界里的小密码一样,能让我们清楚地知道原子之间是怎么结合在一起的。
要是把化学物质比作一个个小家庭,那化学键就是家庭成员之间的联系纽带,而这些表示方法就是把这种联系展示给我们看的小妙招。
学会了这些,就好像拿到了一把打开化学结构大门的小钥匙,能让我们在化学的奇妙世界里探索更多有趣的东西呢。
3.3 共价键一、知识要点1.共价键的概念:原子间通过共用电子对而形成的化学键。
共价键可存在于非金属单质、共价化合物、离子化合物中。
共价化合物:只存在共价键的化合物称为共价化合物。
共价化合物中,只含有共价键,不含有离子键。
但离子化合物中可含有共价键,如铵盐(NH 4Cl )等。
化学上常用电子式和结构式表示表示共价键。
例如:氯化氢的电子式为 ,结构式为H -Cl ;水的电子式为 ,结构式为 H -O -H 。
2.化学键指直接相邻的两个或多个原子间强烈的相互作用。
化学键可分为离子键、共价键和金属键。
离子键与共价键的对比 化学反应的实质是旧化学键的断裂和新的化学键的形成的过程。
二、疑难解答1.极性键与非极性键共价键有两种类型,极性键和非极性键。
共用电子对不发生偏移的共价键叫非极性共价键,简称非极性键。
共用电子对发生偏移的共价键叫极性共价键,简称极性键。
显然同一种元素原子之间的共价键是非极性共价键,不同种元素原子之间的共价键是极性共价键。
氯气分子中氯原子之间形成一对共用电子对,由于两个氯原子吸引电子的能力相同,共用电子对不偏向任何一方,两个原子都不显电性。
所以氯气分子中氯元素的化合价为0价,Cl -Cl 键为非极性键。
而氯化氢分子中氯原子和氢原子间也形成一对共用电子对,但是氯原子对共用电子对的吸引能力比氢原子强,共用电子对在运动时偏向氯原子一方,从而使氯原子显一定的负比较离子键 共价键 定义阴、阳离子之间强烈的相互作用 相邻原子间通过共用电子对所形成的化学键 成键本质阴、阳离子间的静电作用 共用电子对与两原子核的电性作用 成键粒子 阴离子、阳离子原子 成键元素 一般是活泼金属与活泼非金属(或原子团)一般是非金属与非金属或较不活泼的金属 示例 MgCl 2H 2、HCl 电子式,, 物质类别 离子化合物①非金属单质②共价化合物③复杂离子化合物 晶体类型 离子晶体 离子晶体、分子晶体、原子晶体电性,显负一价。