乙烯乙炔
- 格式:pptx
- 大小:1.24 MB
- 文档页数:42

乙烯和乙炔的化学式
小朋友呀,这题目是不是搞错啦?乙烯的化学式是C₂H₄,乙炔的化学式是
C₂H₂。
可这对于咱们小学生或者初中生来说,好像有点枯燥又难懂呢!
咱们想想啊,这化学式就像神秘的密码,得一点点解开才能明白。
比如说乙烯的C₂H₄,就好像是两个小伙伴手拉手(两个碳原子),然后周围还有四个小跟班(四个氢原子)。
再看乙炔的C₂H₂,就像是两个好兄弟(两个碳原子),各自带着一个小尾巴(一个氢原子)。
哎呀!我就奇怪了,这小小的原子组合起来,怎么就能有这么多奇妙的变化呢?难道它们也会像咱们在学校做游戏一样,有自己的规则和玩法?
你说要是这些原子能说话,它们会不会跟咱们抱怨,说被组合在一起太挤啦,或者太孤单啦?
反正啊,这化学世界里的乙烯和乙炔,就像是藏着无数秘密的城堡,等着咱们去探索发现呢!
我觉得吧,虽然现在搞清楚这些化学式有点难,但是只要咱们好好学,以后肯定能把它们弄得明明白白的!。

实验室制乙炔的方程式制乙炔的方程式是C2H2,也可以写作HC≡CH。
制乙炔是一种化学反应过程,通过适当的实验条件,将合适的原料进行化学反应,生成乙炔这种有用的化学物质。
下面将详细解释制乙炔的方程式及相关过程。
乙炔是一种无色、有毒、易燃的气体,具有特殊的化学性质和广泛的应用价值。
它被广泛用于焊接、切割和加工金属,还可以用作照明和化学合成中的原料。
制乙炔的过程主要分为两个步骤:制备乙炔的原料制备和乙炔的生成。
制备乙炔的原料。
乙炔的主要原料是乙烯(C2H4),乙烯是一种无色、有毒、易燃的气体,也是一种广泛应用的化学物质。
乙烯可以通过石油和天然气中的烃类物质的热解或催化裂化得到。
这个过程通常在高温和压力下进行,通过将烃类物质分解成较小的分子来生成乙烯。
接下来,进行乙炔的生成。
乙炔的生成主要通过乙烯的部分氧化或裂解来实现。
在部分氧化反应中,乙烯和氧气在高温下反应,生成乙炔和水。
反应的化学方程式可以表示为:2C2H4 + O2 → 2C2H2 + 2H2O在裂解反应中,乙烯在高温下分解成乙炔和氢气。
反应的化学方程式可以表示为:C2H4 → C2H2 + H2这两种方法都可以用来制备乙炔,具体使用哪种方法取决于实际需求和条件。
部分氧化反应通常在工业生产中使用,而裂解反应则常用于实验室制备。
制乙炔的过程需要注意一些实验条件,如温度、压力、催化剂等。
在部分氧化反应中,通常需要在高温(约1500°C)和适当的压力下进行反应,以提高乙炔的产率和纯度。
同时,可以使用催化剂来促进反应速率和选择性。
常用的催化剂有铜、银、钯等。
在裂解反应中,温度通常要高于乙烯的热解温度,以促进分解反应的进行。
制乙炔的方程式是C2H2,制备乙炔的过程主要包括乙烯的制备和乙炔的生成。
乙烯可以通过烃类物质的热解或催化裂化得到,而乙炔的生成可以通过乙烯的部分氧化或裂解来实现。
制乙炔的过程需要适当的实验条件和催化剂的使用,以提高产率和纯度。

请问老师乙烯和乙炔的制取方式和反应的化学方程式,并请老师指出这两个实验中需要注意的地方,谢谢老师
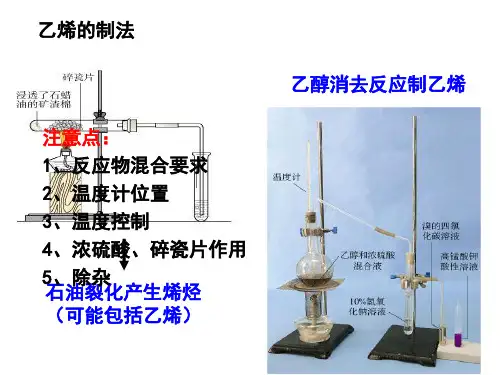
制乙烯:CH 3CH 2OH CH 2 =CH 2 +H 2O
在制乙烯的反应中应注意的反应在170℃,其它的没有什么了。
实验室制乙炔:CaC 2 +H 2O →Ca(OH)2 +C 2H 2 没有什么要特别注意的。
38.在我国青海湖地区有一种说法,冬天捞碱,夏天晒盐。
这里的碱是指Na2CO3,盐是指NaCl 。
人们从盐湖中捞得的碱会含有少量的NaCl 。
某研究性学习小组称取含NaCl 的Na2CO3固体25.0g ,将其配制成溶液,再向其中逐滴加入足量的溶质质量分数为7.3%的稀盐酸,使气体完全放出,共收集到8.8gCO2气体。
试计算:⑴原固体中Na2CO3的质量分数。
⑵反应中消耗盐酸的总质量?
解原固体中的碳酸钠的质量是X , 用的盐酸总质量是Y 。
Na 2CO 3+2HCl → 2NaCl+H 2O+CO 2↑
106 73 44
X Y*7.3% 8.8g
X=21.2g Y=200g
笿:略
某单质X 能从某溶液中置换出单质Y ,由此推断下列说法中正确的是 A .X 一定是排在金属活动顺序表中氢以前的金属 B .X 是金属时,Y 可能是金属,也可能是非金属 C .X 是金属时,Y 一定比X 活泼 D .X 、Y 都是金属时,Y 一定比X 活泼 (说明理由) 本题应选B
A 如果是金属与酸的反应,则A 这时的说明是正确的。
B 正确.金属与酸反应可以置换氢气,金属与盐反应可以置换金属。
浓硫酸
170℃
C应是X活泼。
D应是X活泼。





乙炔和乙烯的化学式
乙炔的化学式是C2H2,它由两个碳原子和两个氢原子组成。
乙烯的化学式是C2H4,它由两个碳原子和四个氢原子组成。
这两种化合物在结构上有所不同,乙炔是由两个碳原子之间通过三重键连接而成,而乙烯则是由两个碳原子之间通过一个双键连接而成。
这种不同的结构导致了它们在化学性质上的差异,比如乙炔可以发生加成反应生成烯烃,而乙烯则可以发生加成反应生成烷烃。
此外,乙炔和乙烯在工业上有着不同的用途,乙炔常被用作溶剂和原料,而乙烯则是重要的化工原料,用于生产乙烯基聚合物等。
总的来说,乙炔和乙烯在化学式、结构和用途上都有着明显的差异。


用化学方法鉴别乙烷乙烯乙炔乙烷、乙烯和乙炔是化学中常见的有机物,它们在结构上有着明显的差异,但在外观上很难直接区分。
因此,需要借助化学方法来鉴别它们。
本文将介绍用化学方法鉴别乙烷、乙烯和乙炔的步骤和原理。
首先,我们可以利用溴水来鉴别这三种化合物。
溴水是一种淡黄色的液体,在室温下为液态,可以溶解在水中。
对于乙烷、乙烯和乙炔,它们分别会产生不同的反应。
当溴水与乙烷接触时,由于乙烷是一种饱和烃,不会发生化学反应,因此溴水的颜色不会发生变化。
而当溴水与乙烯接触时,由于乙烯是一种不饱和烃,会发生加成反应,溴水的颜色会由淡黄色变成无色。
对于乙炔来说,它也是一种不饱和烃,但由于其结构的特殊性,不会和溴水发生反应,因此溴水的颜色依然是淡黄色。
通过这种方法,我们可以初步鉴别出这三种化合物。
除了溴水试剂外,我们还可以使用高锰酸钾溶液来鉴别乙烷、乙烯和乙炔。
高锰酸钾溶液呈紫红色,是一种常用的氧化剂。
当高锰酸钾溶液与乙烷接触时,由于乙烷是一种饱和烃,不会发生化学反应,高锰酸钾溶液的颜色也不会发生变化。
而当高锰酸钾溶液与乙烯接触时,由于乙烯是一种不饱和烃,会发生部分氧化反应,高锰酸钾溶液的颜色会逐渐变淡直至无色。
对于乙炔来说,它也是一种不饱和烃,但由于其结构的特殊性,不会和高锰酸钾溶液发生反应,高锰酸钾溶液的颜色依然是紫红色。
通过这种方法,我们可以进一步鉴别出这三种化合物。
在实际的化学实验中,我们可以结合以上两种方法,通过观察溴水和高锰酸钾溶液的颜色变化,来鉴别乙烷、乙烯和乙炔。
当然,这只是初步的鉴别方法,如果需要更精确的鉴别,还需要借助其他仪器和方法,比如红外光谱、质谱等。
总的来说,通过化学方法鉴别乙烷、乙烯和乙炔,可以利用溴水和高锰酸钾溶液的特性和反应来进行初步的鉴别。
这对于化学实验和工业生产中的化学分离和鉴别具有一定的指导意义。
希望本文所介绍的方法能够对相关领域的研究和实践有所帮助。
乙烷乙烯与乙炔结构的对比乙烷(C2H6)、乙烯(C2H4)和乙炔(C2H2)是碳氢化合物中比较常见的三种化合物。
它们在化学性质、物理性质和结构上都有着很大差异。
以下是对这三种化合物的结构对比及其相关特性的详细说明。
乙烷(C2H6)是由两个碳原子和六个氢原子组成的饱和烃。
乙烷是一种无色、无臭的气体,其熔点为-183.3°C,沸点为-88.6°C。
乙烷是石油和天然气中最简单的烷烃之一,也是生物体内产生的重要产物之一乙烷的结构由两个碳原子通过单键连接而成,碳原子的电子排布是sp3杂化的,其形成了四个等价的sp3杂化轨道。
每个碳原子都与三个氢原子通过σ键连接。
乙烷的化学键角为109.5°,属于正四面体结构。
乙烯(C2H4)是由两个碳原子和四个氢原子组成的不饱和烃。
乙烯是一种无色气体,其熔点为-169.4°C,沸点为-103.7°C。
乙烯是一种重要的工业原料,在制作塑料、橡胶等材料中得到广泛应用。
乙烯的结构由两个碳原子通过双键连接而成,每个碳原子与两个氢原子通过σ键连接,两个碳原子通过π键连接。
碳原子的电子排布是sp2杂化的,即它形成了三个等价的sp2杂化轨道,这些轨道处在同一个平面内。
乙烯的化学键角为120°,属于三角形平面结构。
乙炔(C2H2)是由两个碳原子和两个氢原子组成的不饱和烃。
乙炔是一种无色气体,其熔点为-80.8°C,沸点为-84°C。
乙炔是一种非常有用的物质,广泛用于焊接、切割和实验室研究等领域。
乙炔的结构由两个碳原子通过三键连接而成,每个碳原子与一个氢原子通过σ键连接,两个碳原子通过两个π键连接。
碳原子的电子排布是sp杂化的,即它形成了两个等价的sp杂化轨道,这些轨道处在同一条直线上。
乙炔的化学键角为180°,属于线性结构。
从结构上对比乙烷、乙烯和乙炔,可以看出它们的碳原子间的键连接方式不同。
乙烷的碳原子以单键相连,乙烯的碳原子以双键相连,而乙炔的碳原子以三键相连。
乙烷乙烯与乙炔结构的对比乙烷、乙烯和乙炔是三种简单的碳氢化合物,它们之间的结构差异导致了它们在物理性质和化学性质方面的不同。
下面将对乙烷、乙烯和乙炔的结构进行对比。
乙烷(C2H6)是一种无色、无味的气体,分子式为CH3CH3、乙烷分子由两个碳原子和六个氢原子组成,碳原子之间通过单键相连,每个碳原子上都有三个氢原子。
由于乙烷分子结构的简单性,它的空间构型是平面的。
乙烷的内部键角为109.5°,两个碳原子之间的键长为154 pm。
乙烯(C2H4)是一种无色气体,分子式为CH2CH2、乙烯分子由两个碳原子和四个氢原子组成。
乙烯的结构中有一个双键连接两个碳原子,其他两个碳上分别连接一个氢原子。
与乙烷相比,乙烯的分子结构呈现出平面的构型,碳碳双键成为平面共面的一对。
双键的存在导致乙烯的键角为120°,双键的长度约为133 pm,而单键的长度约为147 pm。
乙炔(C2H2)是一种无色的气体,在常温下具有不稳定性。
乙炔分子由两个碳原子和两个氢原子组成。
乙炔的结构是由一个三键和两个单键连接两个碳原子。
这三个键的存在导致了乙炔分子呈线性结构,其键角为180°。
乙炔分子的键长最短,碳碳三键约为120 pm,而碳碳单键约为154 pm。
从分子结构的对比中可以看出,乙烷、乙烯和乙炔在结构上的主要差异是碳原子间的键的数量和类型。
乙烷的碳原子之间通过单键相连,乙烯则包含一个碳碳双键,乙炔则包含一个碳碳三键。
这些不同的结构导致了不同的物理和化学性质。
首先是物理性质方面的对比。
乙烷是一种饱和烃,分子结构中没有双键或三键,因此其分子间相互作用力较小。
由于乙烷分子结构的简单性,它的沸点较低,约为-88.6℃,熔点也较低,约为-183.3℃。
与乙烷相比,乙烯和乙炔中包含双键和三键,这些键的存在导致分子间相互作用力增强。
乙烯的沸点为-103.7℃,熔点为-169℃,而乙炔的沸点为-84℃,熔点为-80℃。
乙炔制乙烯的化学方程式
(最新版)
目录
1.乙炔制乙烯的反应原理
2.乙炔制乙烯的化学方程式
3.乙炔制乙烯的反应条件
4.乙炔制乙烯的反应类型
5.乙炔制聚氯乙烯的化学方程式
正文
乙炔制乙烯是一种重要的化学反应,被广泛应用于有机合成等领域。
乙炔和乙烯都是重要的化工原料,可以通过乙炔制取乙烯。
乙炔制乙烯的反应原理是:在加热、加压和催化剂的作用下,乙炔和氢气发生加成反应,生成乙烯。
乙炔制乙烯的化学方程式如下:
CH≡CH + H2 → CH2=CH2
乙炔制乙烯的反应条件是:需要加热、加压,并使用催化剂。
催化剂可以是钯、铂等金属。
乙炔制乙烯的反应类型是:加成反应。
在这个反应中,乙炔和氢气发生加成反应,生成乙烯。
乙炔还可以用于制取聚氯乙烯。
乙炔和氯气反应,生成一氯乙烷,然后加入 NaOH 乙醇溶液后加热,制得乙烯。
乙烯和氯气反应,生成 1,2-二氯乙烷,然后加入 NaOH 乙醇溶液后加热,制得乙炔。
乙炔制聚氯乙烯的化学方程式如下:
CHCH=CH2 + nCl2 → [-CH2-CHCl-]n + nHCl
其中,n 表示聚合度。
总结起来,乙炔制乙烯是一种重要的化学反应,被广泛应用于有机合成等领域。
乙烯乙炔乙烷杂化轨道判断-概述说明以及解释1.引言1.1 概述乙烯、乙炔和乙烷是有机化学中非常重要的化合物。
它们在工业和生物领域都有广泛的应用。
在研究和理解这些化合物的性质和反应机理时,对它们的电子结构有深入的认识是至关重要的。
乙烯是一种双键结构的碳氢化合物,由两个碳原子通过一个简单的π键连接而成。
这种双键结构赋予了乙烯许多特殊的性质,例如它的反应活性高和分子构型的柔性等。
乙烯被广泛应用于聚合物产业、化学合成和有机合成等领域。
乙炔是一种三键结构的碳氢化合物,由两个碳原子通过一个三键连接而成。
乙炔由于其高度的不饱和度和反应活性而具有特殊的性质。
在有机合成中,乙炔常被用作重要的反应试剂和中间体,例如用于合成各种有机化合物和聚合物。
乙烷是一种饱和的碳氢化合物,它由两个碳原子通过一个单键连接而成。
乙烷的分子结构非常稳定,因此其化学性质相对较为惰性。
由于乙烷分子上没有不饱和键,其反应性相对较低,但乙烷作为烷烃化合物的代表,仍然在石油化工、能源领域和生物领域等有重要的应用。
了解乙烯、乙炔和乙烷的结构与性质有助于我们对有机化学反应的理解和预测。
而乙烯乙炔乙烷杂化轨道的判断是研究这些化合物的重要方法之一。
本文将对乙烯、乙炔和乙烷的结构与性质进行介绍,并重点探讨乙烯乙炔乙烷的杂化轨道判断以及杂化轨道在有机化学中的应用。
通过对这些内容的深入讨论,我们可以更好地理解这些化合物的化学性质及其在实际应用中的意义。
1.2文章结构1.2 文章结构本文主要分为引言、正文和结论三个部分。
下面将对每个部分的内容进行详细介绍。
1. 引言部分主要包括概述、文章结构和目的三个方面。
在概述中,我们将简要介绍乙烯、乙炔和乙烷这三种化合物的基本结构和性质。
文章将围绕着这三种化合物展开,探究它们的杂化轨道以及对分子性质的影响。
在文章结构部分,我们将清晰地列出整篇文章的目录,方便读者快速了解文章的结构和内容。
最后,在目的部分,我们将明确论文的研究目标,即探讨乙烯、乙炔和乙烷的杂化轨道判断以及这些杂化轨道在有机化学中的应用。