化合物的极性与非极性
- 格式:ppt
- 大小:1.06 MB
- 文档页数:35



极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
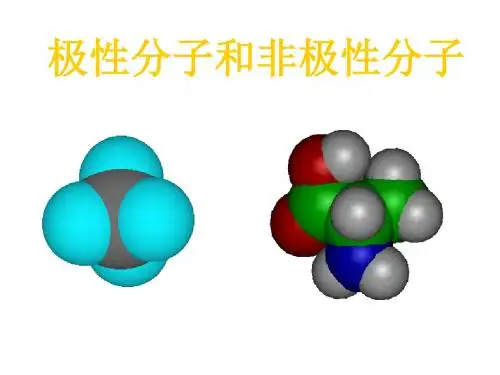
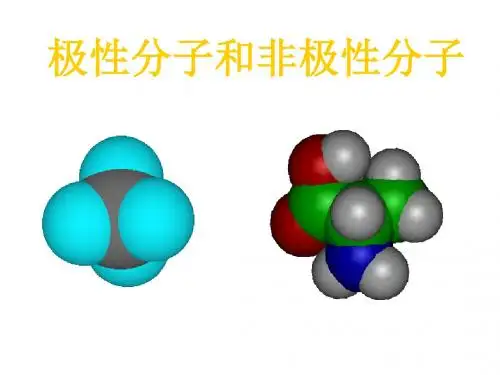
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。

极性与非极性是针对分子说的。
首先化学共价键分为极性键与非极性键。
非极性键就是共用电子对没有偏移,出现在单质中比如O2;极性键就是共用电子对有偏移比如HCl。
而当偏移的非常厉害之后,看上去一边完全失电子另一边得到了电子,就会变成离子键了,如NaCl再说极性分子与与非极性分子。
由于极性键的出现,所以就使某些分子出现了电极性,但是并不是说所有有极性键的分子都是极性分子。
比如CH4,虽然含有4个极性的C-H键,但是因为其空间上成对称的正四面体结构,所以键的极性相消,整个分子没有极性对与H2O,虽然与CO2有相同类型的分子式,也同样有极性共价键,但二者分子的极性却不同。
CO2是空间对称的直线型,所以分子是非极性分子,H2O是折线型,不对称,所以是极性分子,作为溶剂称为极性溶剂常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)常见问题1:两个相同的原子之间形成的共价键一定是非极性键吗?问题:两个相同的原子之间形成的共价键一定是非极性键吗?解答:两个相同的原子之间形成的共价键不一定是非极性键.例如乙醇分子:两个碳原子两边结构不对称,两边对共用电子对的吸引能力不同,则共用电子对不在两个C原子之间的中心位置,即偏向一方,因而形成的共价键不是非极性键.常见问题2:键的极性和分子的极性问题:键的极性和分子的极性解答:1.键的极性键的极性取决于成键的两原子非金属性强弱.一般说,成键的两原子是同种元素的原子,键为非极性键.如果成键的两原子是不同种元素的原子,键为极性键.2.分子的极性在同一分子中,可以同时存在极性键和非极性键.分子的极性取决于键的极性和分子中的键的空间排列.双原子分子的极性与键的极性是一致的,即以极性键结合的双原子分子一定是极性分子.以非极性键结合的双原子分子一定是非极性分子.对于多原子分子的极性除与键的极性有关系外,还与键的空间排列有关.若键的空间排列对称,为对称分子,分子中正、负电荷重心重合,则是非极性分子.如二氧化碳,四氯化碳等.若键的空间排列不对称,分子中正、负电荷重心不重合,分子中出现了带部分正、负电荷的两极,则是极性分子,如水分子.常见问题3:分子极性的判断问题:分子极性的判断解答:判断是否极性分子,进行判断可从分子空间构型是否对称,即分子中各键的空间排列是否对称,若对称,则正负电荷重心重合,分子为非极性分子,反之,是极性分子。

非极性分子和极性分子1. 复习重点1.化学键、离子键、共价键的概念和形成过程及特征;2.非极性共价键、极性共价键,非极性分子、极性分子的定义及相互关系。
2. 难点聚焦 一.化学键:1.概念:化学键:相邻的原子之间强烈的相互作用. 离子键:存在于离子化合物中 2.分类: 共价键:存在于共价化合物中 金属键:存在于金属中 二.离子键:1. 离子化合物:由阴、阳离子相互作用构成的化合物。
如NaCl/Na 2O/Na 2O 2/NaOH/Na 2SO 4等。
2. 离子键:使阴、阳离子结合成化合物的静电作用。
说明:(1)静电作用既包含同种离子间的相互排斥也包含异种离子间的相互吸引。
是阴、阳离子间的静电吸引力与电子之间、原子核之间斥力处于平衡时的总效应。
(2)成键的粒子:阴、阳离子 (3)成键的性质:静电作用 (4)成键条件:①活泼金属(IA 、IIA 族)与活泼非金属(VIA 、VIIA 族)之间相互化合――――ne n me m M M X X ---++-−−−→−−−→ −−−−→吸引、排斥达到平衡离子键(有电子转移) ②阴、阳离子间的相互结合: +-Na +Cl =NaCl (无电子转移)(5)成键原因:①原子相互作用,得失电子形成稳定的阴、阳离子; ②离子间吸引与排斥处于平衡状态; ③体系的总能量降低。
(6)存在:离子化合物中一定存在离子键,常见的离子化合物有强碱、绝大多数盐(PbCl 2/Pb(CH 3COO)2等例外),强的金属的氧化物,如:Na 2O/Na 2O 2/K 2O/CaO/MgO 等。
三.电子式:1.概念:由于在化学反应中,一般是原子的最外层电子发生变化,所以,为了简便起见,我们可以在元素符号周围用小黑点(或×)来表示原子的最外层电子。
这种式子叫做电子式 例如:2.离子化合物的电子式表示方法:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。

化学物质的极性练习题判断物质的极性化学物质的极性对于理解其性质和反应机制具有重要意义。
在化学实验中,我们经常需要判断一个物质是极性还是非极性,以便更好地设计和控制实验条件。
本文将通过一些练习题来帮助读者对判断物质的极性有更深入的理解。
练习题1:下列化合物中,哪些是极性分子,哪些是非极性分子?1. 氯化钠(NaCl)2. 二氧化碳(CO2)3. 水(H2O)4. 苯(C6H6)5. 氨(NH3)解答:1. 氯化钠(NaCl):非极性分子。
由于氯离子和钠离子的电荷均为一致,相互间没有分子内电荷分布不均的情况,因此氯化钠为非极性分子。
2. 二氧化碳(CO2):非极性分子。
二氧化碳分子中的碳和氧原子的电负性相等,电子云分布均匀,因此二氧化碳为非极性分子。
3. 水(H2O):极性分子。
水分子中的氧原子具有较高的电负性,氢原子的电负性较低,因此水分子存在明显的分子内电荷分布不均,呈现极性。
4. 苯(C6H6):非极性分子。
苯分子中的碳碳键和碳氢键呈现相同的键长和键能,电子云分布相等,因此苯为非极性分子。
5. 氨(NH3):极性分子。
氨分子中氮原子的电负性较高,氢原子的电负性较低,因此氨分子也呈现明显的分子内电荷分布不均,具有极性。
练习题2:请根据下列分子的结构式和分子式,判断其是否为极性分子。
1. CH3Cl2. CH43. CH3OH4. CCl45. NH4+解答:1. CH3Cl:极性分子。
氯原子的电负性较高,相对于碳和氢原子来说,电子云分布不均匀,因此CH3Cl为极性分子。
2. CH4:非极性分子。
由于四个碳氢键分子中,电子云分布均匀,因此CH4为非极性分子。
3. CH3OH:极性分子。
氧原子的电负性较高,相对于碳和氢原子来说,电子云分布不均匀,因此CH3OH为极性分子。
4. CCl4:非极性分子。
由于四个氯原子和碳原子的电负性相等,电子云分布均匀,因此CCl4为非极性分子。
5. NH4+:非极性分子。

极性键在化合物分子中,不同种原子形成的共价键,由于两个原子吸引电子的能力不同,共用电子对必然偏向吸引电子能力较强的原子一方,因而吸引电子能力较弱的原子一方相对的显正电性。
这样的共价键叫做极性共价键,简称极性键。
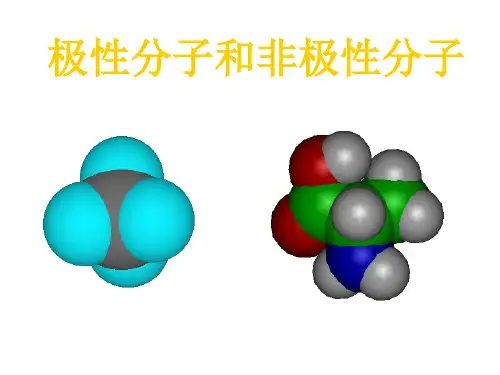
举例:HCl分子中的H-Cl键属于极性键判别同种原子之间的是非极性键极性键存在于不同种元素间但是存在极性键的物质不一定是极性分子.区分极性分子和非极性分子的方法:非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法:组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法:若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了常见极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3 CH2OH非极性键=由同种元素的原子间形成的共价键,叫做非极性键。
同种原子吸引共用电子对的能力相等,成键电子云对称地分布在两核之间,不偏向任何一个原子,成键的原子都不显电性。
非极性键可存在于单质分子中(如H2中H—H键、O2中O=O键、N2中N≡N键),也可以存在于化合物分子中(如C2H2中的C—C键)。
非极性键的键偶极矩为0。
以非极性键结合形成的分子都是非极性分子。
存在于非极性分子中的键并非都是非极性键,如果一个多原子分子在空间结构上的正电荷几何中心和负电荷几何中心重合,那么即使它由极性键组成,那么它也是非极性分子。
由非极性键结合形成的晶体可以是原子晶体,也可以是混合型晶体或分子晶体。
例如,碳单质有三类同素异形体:依靠C—C非极性键可以形成正四面体骨架型金刚石(原子晶体)、层型石墨(混合型晶体),也可以形成球型碳分子富勒烯C60(分子晶体)。

极性基团和非极性基团
两个相同元素的非金属原子所组成的单质为非极性基团,通常以一个活泼金属和一个非金属组成的化合物为极性基团.
同种原子组成的为非极性基团,如过氧根O2 2-
极性基团是分子中的电子分布不产生显著电偶极矩的有机部分,这种基团对低极性有机溶剂呈现亲和性,并决定了分子的亲油特性。
区别在于基团的正负电荷中心是否重合。
极性基团亲水,非极性基团亲油。
极性基团是指正负电荷中心不重合的基团,基团的极性可以用偶极矩来表征。
距离为l,电量为±q的两个点电荷构成一个电偶极子,用电偶极矩(简称偶极矩)μ=ql来表征,极性基团偶极矩μ>0.5。
非极性基团是分子中的电子分布不产生显著电偶极矩的有机部分。
这种基团对低极性有机溶剂呈现亲和性,并决定了分子的亲油特性。
有机化学极性的概念有机化学中的极性是指有机分子中化学键的极性,或者是整个分子的极性。
极性主要由分子内部原子的电负性差异以及分子结构决定。
本文将从电负性的概念、极性的产生原因、有机化合物的分类以及常见的极性分子进行阐述。
电负性是衡量原子或者分子吸引外部电子对的能力的物理量。
常用的衡量电负性的指标是由芬兰科学家Pauling提出的Pauling电负性。
电负性差异越大,原子对电子的吸引力越强,原子越带有负电性,反之则带有正电性。
一般而言,非金属元素电负性较高,而金属元素电负性较低。
极性的产生原因有两个主要方面,分别是分子中键的极性以及分子的几何结构。
分子中的共价键可以分为两类:非极性键和极性键。
非极性键由两个电负性相当的原子组成,这两个原子各自对电子的吸引力相等,电子云对称地分布在两个原子之间,如氧气的O=O键。
极性键由两个电负性差异较大的原子组成,其中一个原子对电子的吸引力较强,电子云在空间上不对称地分布在两个原子之间,这就导致有部分正电荷集中在电负性较强原子附近,而有部分负电荷聚集在电负性较弱原子附近,如氨分子的N-H键。
分子的几何结构也会对极性起到重要的影响。
如果分子是线性排列的,即原子围绕着中心原子呈直线排列,那么这个分子是非极性的,如碳四键的四个氢原子分子。
如果分子是偏线性的或者是非线性的,那么这个分子是极性的,如水分子。
有机化合物根据其极性可以大致分为两类:极性有机化合物和非极性有机化合物。
极性有机化合物在分子中存在极性键,而非极性有机化合物则没有极性键。
极性有机化合物通常是小分子,如醇、醛、酮等。
这些分子通常具有强极性的官能团,如羟基、卡宁基等。
这些官能团在分子中带有部分电荷,可以与其他分子或离子进行氢键和离子键的相互作用。
而非极性有机化合物通常是大分子,如石油化合物、脂肪酸等。
这些分子中没有强极性官能团,因此分子间的相互作用主要是由分子的范德华力和疏水作用来实现的。
常见的极性分子有很多,如水分子、醇类化合物、酸类化合物等。
极性化合物和非极性化合物的概念
分子的极性与非极性是由分子的电荷分布情况决定的.极性分子是分子内部电荷分布不均匀造成的,非极性分子是分子内部电荷分布均匀造成的.键的极性是形成键的两个原子的原子核对电子的束缚能力不同而产生的.键的非极性是形成键的两个原子的原子核对电子的束缚能力相同而产生.
含有非极性键的极性分子:CH3-CH2-CH(CH3)2(C-C键即为非极性键,而整个分子由于电子分布不均匀而由极性)
含有极性键的非极性分子:CH3-CH2—CH3(由于此有机物机构上的对称性,它无极性,但C-H键为极性键)。
分子概述 如果分子的构型不对称,则分子为极性分子。
如:氨气分子,HCl分子等。
区分极性分子和非极性分子的方法: 非极性分子的判据:中心原子化合价法和受力分析法1、中心原子化合价法: 组成为ABn型化合物,若中心原子A的化合价等于族的序数,则该化合物为非极性分子.如:CH4,CCl4,SO3,PCl52、受力分析法: 若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子.如:CO2,C2H4,BF33、非极性分子: 同种原子组成的双原子分子都是非极性分子。
不是非极性分子的就是极性分子了! 高中阶段知道以下的就够了: 极性分子:HX,CO,NO,H2O,H2S,NO2,SO2,SCl2,NH3,H2O2,CH3Cl,CH2Cl2,CHCl3,CH3CH2OH 非极性分子:Cl2,H2,O2,N2,CO2,CS2,BF3,P4,C2H2,SO3,CH4,CCl4,SiF4,C2H4,C6H6,PCl5,汽油 简单判断方法 对于AnBm型 n=1 m>1 若A化合价等于主族数 则为非极性有机极性判断弱极矩μ 有机化合作大多难溶于水,易溶于汽油、苯、酒精等有机溶剂。
原因何在?中学课本、大学课本均对此进行了解释。
尽管措词不同,但中心内容不外乎是:有机化 合物一般是非极性或弱极性的,它们难溶于极性较强的水,易溶于非极性的汽油或弱极性的酒精等有机溶剂。
汽油的极性在课本中均未做详细说明,故而在教学中常 常做如下解释:所有的烷烃,由于其中的O键的极性极小,以及结构是对称的,所以其分子的偶极矩为零,它是一非极性分子。
烷烃易溶于非极性溶剂,如碳氢化合 物、四氯化碳等。
以烷烃为主要成分的汽油也就不具有极性了。
确切而言,上述说法是不够严格的。
我们知道,分子的极性(永久烷极)是由其中正、负电荷的“重心”是否重合所引起的。
根据其分子在空间是否绝对对称来判定极性,化学键极性的向量和——弱极 矩μ则是其极性大小的客观标度.分析1 常见烷烃中,CH4、C2H6分子无极性,C3H8是 折线型分子,键的极性不能相互完全抵消,其μ≠为0.084D。
极性键与非极性键的判断-互联网类关键信息项:1、极性键与非极性键的定义2、极性键与非极性键的判断方法3、常见化合物中极性键与非极性键的实例4、互联网资源在极性键与非极性键判断中的应用5、利用互联网进行学习和交流的注意事项11 极性键与非极性键的定义极性键是指不同种原子之间形成的共价键,由于原子的电负性不同,共用电子对会发生偏移。
非极性键则是同种原子之间形成的共价键,原子的电负性相同,共用电子对不发生偏移。
111 极性键的特点在极性键中,电负性较大的原子吸引电子的能力较强,导致电子对偏向该原子,使得键的两端出现部分正电荷和部分负电荷。
112 非极性键的特点非极性键中,由于原子相同,其吸引电子的能力相同,电子对在键的中央均匀分布,键两端的电荷分布均匀。
12 极性键与非极性键的判断方法判断极性键和非极性键的主要依据是形成共价键的原子的电负性差异。
121 电负性差值判断法如果两个原子的电负性差值大于 17,通常形成离子键;差值在 04 到 17 之间,形成极性共价键;差值小于 04,形成非极性共价键。
122 分子结构对称性判断法对于结构对称的分子,如二氧化碳(CO₂),其化学键为极性键,但由于分子结构对称,整个分子为非极性分子。
而对于水(H₂O),其分子结构不对称,尽管化学键为极性键,整个分子也是极性分子。
13 常见化合物中极性键与非极性键的实例在许多常见的化合物中,都存在极性键和非极性键。
131 含极性键的化合物如氯化氢(HCl)、水(H₂O)、氨气(NH₃)等,其中氢和氯、氢和氧、氮和氢之间的化学键均为极性键。
132 含非极性键的化合物氧气(O₂)、氮气(N₂)中的化学键为非极性键。
133 同时含极性键和非极性键的化合物过氧化氢(H₂O₂)中,氢氧键为极性键,氧氧键为非极性键。
14 互联网资源在极性键与非极性键判断中的应用互联网为学习极性键与非极性键的判断提供了丰富的资源。
141 在线课程许多教育平台提供了相关的化学课程,通过视频讲解、动画演示等方式,帮助学习者更直观地理解极性键与非极性键的概念和判断方法。