非极性分子和极性分子
- 格式:docx
- 大小:132.52 KB
- 文档页数:9
高中化学:分子极性一、分类:按照分子的极性,可把分子分为两类。
1、非极性分子:正负电荷重心重合,分子对外不显示电负性的分子。
例如:等。
疏水分子是指不溶于水的分子。
非极性分子是指原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子。
水分子是极性分子,根据相似相溶原理,非极性分子很难溶于水。
但疏水分子也可能是极性很大的分子,例如各类脂肪酸,所以疏水分子不一定是非极性分子!2、极性分子:正负电荷重心不重合,分子对外显示电负性的分子。
例如HCl、H2O2等。
二、掌握常见分子极性及其空间构型:常见分子极性及其空间构型可用下表表示。
三、了解常见分子空间构型及其键角:中学常见分子空间构型及其键角列举如下:(1)等双原子单质分子为直线形,夹角为180°。
(2)为平面形,夹角为104.5°。
(3)为三角锥形,夹角为107°18”。
(4)S为平面形,夹角为92°。
(5)为正四面体形,夹角为109°28”。
(6)为四面体形,夹角不确定。
(7)为直线形,夹角为180°。
(8)为平面形,夹角为120°。
(9)为平面形,夹角为60°。
(10)为正四面体形,夹角为109°28”。
(11)为直线形,夹角为180°。
(12)为平面形,夹角为120°。
②③④⑤注意:中学常见的四面体物质有①CH4⑥⑦⑧⑨等。
其中是正四面体的有①、⑤、⑥、⑦、⑧、⑨共6种。
四、分子极性判断规律。
①双原子单质分子都是非极性分子。
如等。
②双原子化合物分子都是极性分子。
如HCl、HBr、HI等。
③多原子分子极性要看空间构型是否对称,对称的是非极性分子,否则是极性分O、等是极性分子;子。
如H2等是非极性分子。
④形分子极性判断:若A原子的最外层电子全部参与成键,这种分子一般为非极性分子。
如等。
若A原子的最外层电子没有全部参与成键,这种分子一般为极性分子。

如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。

非极性分子与极性分子分子是由原子组成的。
当原子相互结合时,它们所形成的分子可以是极性的或非极性的。
在对分子进行分类时,需要了解一些基本的化学知识,例如化学键的类型、电子云的分布等等。
本文将介绍非极性分子和极性分子的概念,以及它们的区别。
一、什么是非极性分子?非极性分子是由原子组成的分子,其中原子之间不会产生极性化学键。
这些分子通常由相同性质的原子组成,例如氧气(O2)、氢气(H2)和氮气(N2)。
这些分子的化学键是非极性化学键,这意味着它们是由共价键组成的,共享电子对在两个原子之间平均分布,没有正负极性区。
非极性分子的化学键非常稳定,因为它们通常不与其他分子形成氢键或离子键。
这些分子的化学性质较为稳定,不易被其他物质影响。
例如在空气中,氧气、氮气和氢气都具有较高的稳定性,它们不会被其他物质影响,从而不易被氧化和/或还原。
极性分子是由两种或更多种不同原子组成的分子,其中至少一个化学键是极性化学键。
化学键的极性是由于电子云的分布不均匀所导致的。
每个原子中的电子云在分子中形成了偏移,这意味着它们的电荷分布不再对称。
正因为如此,分子在两端存在带有相反的电荷部分,并能与其他分子发生氢键或离子键。
极性分子的极性化学键会导致分子间的分子间相互作用增强,因此分子更容易被其他分子吸引。
这导致了极性分子在不同物理和化学条件下表现出不同的性质。
例如水(H2O)是一种重要的极性分子,因为其中的氧原子和氢原子之间形成了一个极性化学键。
水具有许多特殊的性质,例如可溶性高、极性化学反应性强等等。
1、化学键类型非极性分子和极性分子的显著区别在于它们的化学键类型。
非极性分子通常由非极性化学键组成,而极性分子则包括至少一个极性化学键。
2、电子云分布非极性分子和极性分子的电子云分布也是不同的。
非极性分子原子间的电子云均匀分布,而极性分子原子间的电子云分布不均匀。
3、化学性质由于极性化学键的存在,极性分子在化学方面表现出不同的性质,例如易溶于水、易发生化学反应等。




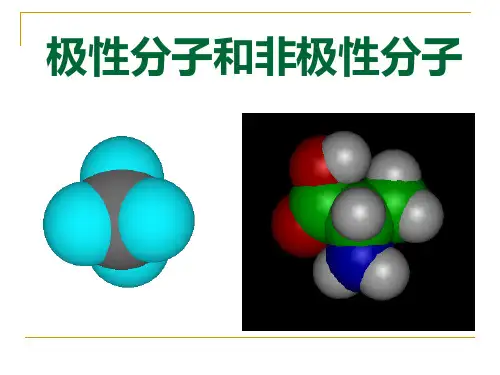
非极性分子和极性分子【考纲要求】1.理解极性键与非极性键的形成原因,并能进行化学键的极性强弱比较。
2.理解化学键的极性与分子的极性的区别与联系,掌握极性分子与非极性分子的判断依据和判断方法。
3.理解分子间作用力和氢键的概念以及对物质性质的影响。
教与学方案【自学反馈】一、概念辨析1.非极性键:(1)概念:。
(2)形成条件:。
2.极性键:(1)概念:。
(2)形成条件:。
(3)共价键极性强弱比较依据:形成共价键的共用电子对偏向与偏离程度越大,键的极性就越强。
试比较下列两组共价键的强弱:①H—H、H—F、H—O、H—N、H—C:;②H—F、C—F、N—F、O—F、F—F:。
3.极性分子:(1)含义:。
(2)举例:。
4.非极性分子:(1)含义:。
(2)判断方法:①根据键角判断分子中的正负电荷重心是否重叠②根据AB n的中心原子A周围是否为完全等价的电子对③根据AB n的中心原子A的最外层价电子是否全部参与形成了同样的共价键。
(或A是否达最高价)(3)常见AB n型分子中极性分子与非极性分子比较:分子类型举例键角构形分子极性AB COAB2(A2B)H2OCS2BeCl2AB3PCl3BF3SO3AB4CH4AB2C2CH2Cl2A2B4C2H4A2B2C2H2A6B6C6H65.分子间作用力:(1)概念:。
(2)影响因素:。
(3)对物质性的影响:。
6.氢键:(1)概念:。
(2)形成条件:。
(3)对物质性质的影响:。
7.相似相溶原理: 。
.【例题解析】[例1] ] 氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,和卤素单质的性质相似。
(1)写出氰与苛性钠溶液反应的离子方程式:_______________________。
(2)已知氰分子键之间夹角为180°并有对称性,(CN)2的电子式为______________,结构式为______________,(CN)2分子为______________(填“极性”或“非极性”)分子。
(3)CN-中电子数为______________,CN-的电子式为______________。
解题思路: 。
易错点: 。
[例2] 将下列粒子的符号填入相应的空格内:O2、NH3、CO2、H2O、N2、(NH4)2SO4、SiCl4。
(1)存在极性键的极性分子是______________。
(2)存在非极性键的非极性分子是______________。
(3)存在极性键的非极性分子是______________。
(4)全部由非金属元素组成的离子化合物是______________。
解题思路: 。
易错点: 。
【考题再现】1. 今有三种物质AC2、B2C2、AD4,元素A的最高正价和负价绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体B2C2;元素D的负一价阴离子电子层结构与氩原子相同,则(1)A、B、C、D的元素符号分别为_______________、_______________、____________、______________________。
(2)AC2的空间构型为______________,属______________分子,AD4的空间构型为______________,属______________分子。
(3)B2C2的电子式为__________,属_________ 。
(填离子或共价化合物)思维方法: 。
展望高考:2.科学家发现铂的两种化合物其化学式都为PtCl2(NH3)2,且均为平面正方形结构,但一种为黄绿色,在水中溶解度较大,具有抗癌作用,另一种为淡黄色,在水中溶解度较小,不具有抗癌作用。
试回答下列问题:(1)一这两种铂的化合物的几何构型图。
黄绿色:______________;淡黄色:______________。
(2)黄绿色固体在水中溶解度大的原因是__________________________。
思维方法: 。
展望高考: 。
【针对训练】A.基础训练1.根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,说明正确的是( )A.溴、碘单质和四氯化碳中都含有卤素B.溴、碘是单质,四氯化碳是化合物C.Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子D.以上说明都不对2.下列物质的熔、沸点高低顺序正确的是( )A.F2<Cl2<Br2<I2B.CF4<CCl4>CBr4>CI4C.HF>HCl<HBr<HID.CH4<SiH4<CeH4<SnH43.已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推出AB n型分子是非极性分子的经验规律正确的是( )A.分子中所有原子在同一平面内B.分子中不含氢原子C.在AB n分子中,A元素为最高正价D.在AB n分子中,A原子最外层的电子都已成键4.下列各组物质中,化学键的类型(离子键、共价键)相同的是( )A.CaO和MgCl2B.NH4F和NaFC.Na2O2和H2O2D.H2O和SO25.下列叙述中肯定正确的是( )A.在离子化合物中不可能存在非极性键B.在共价化合物形成的分子中不可能存在离子键C.在极性分子中不可能存在非极性键D.在非极性分子中不可能存在极性键6.下列叙述中正确的是( )A.两种元素构成的共价化合物分子中的化学键都是极性键B.两种非金属元素的原子间形成的共价键都是极性键C.含有极性键的共价化合物分子不一定是极性分子D.只要是离子化合物,其熔点就比共价化合物的熔点高7.下列说法中正确的是( )A.非金属原子间只能形成共价化合物B.非金属原子间不可能形成离子键C.以非极性键结合的双原子分子一定是非极性分子D.以极性键结合的分子一定是极性分子8.CH4、NH3、H2O、HF分子中,共价键的极性强弱顺序是( )A.CH4、NH3、H2O、HFB.HF、H2O、NH3、CH4C.H2O、HF、CH4、NH3D.HF、H2O、CH4、NH3B.提高训练9.三氯化磷分子的空间构型是三角锥形而不是平面三角形。
下列关于三氯化磷分子空间构型理由的叙述中正确的是( )A.PCl3分子中3个共价键的键长、键这间夹角均相等B.PCl3分子中的3个P—Cl键属于极性共价键C.PCl3分子中3个共价键的键长、键之间的夹角不相等D.PCl3分子中P—Cl键的3个键之间夹角都是100.1°10.实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,由此可判断BeCl2属于( )A.由极性键形成的极性分子B.由极性键形成的非极性分子C.由非极性键形成的极性分子D.由非极性键形成的非极性分子11.下列叙述中正确的是( )A.同主族金属元素的原子半径越大熔点越高B.稀有气体原子序数越大沸点越高C.分子间作用力越弱的分子其熔点越低D.同周期元素的原子半径越小越易失去电子12.A、B、C、D四种元素,AB2分子中有22个电子,C离子中质子数比中子数少一个,11.5gC 与足量水可放出H25.6L(标况下);D与C同周期,无延展性,但有一定的导电性,且在化合物中主要是共价键结合,下面叙述正确的是( )A.DB2的熔点很低B.C2B2有非极性键C.晶体A一定是原子晶体D.这四种元素原子序数只有一个奇数13.对比以下几个反应式:Cl+Cl→Cl2+247KJ;O+O→O2+493KJ;N+N→N2+946J,可得出的结论是( )A.在常温下N2比O2、Cl2稳定B.氮、氧、氯的分子都是非极性分子C.氮、氧、氯都是双原子分子D.氮气、氧气和氯气的密度不同C.能力训练14.已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D 原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是( )15.A、B、C、D、E、F、G为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子极性分子;C与F 可形成D和G分子。
(1)A微粒的结构示意图是______________。
(2)比较B和E相应元素的最高价氧化物对应水化物的碱性强弱,为______________>______________(用化学式表示)。
(3)D和G微粒是否为极性分子?答:______________。
(4)C微粒是______________,F微粒是______________(用电子式表示)。
16.现有短周期A、B、C三种元素,原子序数依次增大,A元素的单质是密度最小的气体,B获得2个电子可达到稳定结构,C与A同主族。
(1)判断A、B、C各为何种元素。
A______________ B______________ C______________(2)用电子式表示三种元素原子之间可能构成的化合物的形成过程,并指示各自化学键的类型:①A与B______________、______________②A与C______________③B与C______________、______________④A、B、C______________17.已知某元素R的最高价氧化物的水化物0.49g与R的气态氢化物0.17g,分别能和100ml,0.1mol/2的NaOH溶液完全反应,R元素的原子中,质子数与中子数相等,在周期表中元素A、B与R同周期左右相邻,元素C、D与R同主族上下相邻,试确定:(1)R、A、B、C、D各为何元素?(2)比较R、C、D三种元素气态氢化物的稳定性大小?(3)由R和C两元素形成的两种化合物分子中,指出它们各属于何种分子?18.某元素A能形成气态氢化物H x A,它的水溶液能和CaCO3反应放出使澄清石灰水变浑浊的气体,反应中H x A和CaCO3的物质的量之比为2∶1,测得H x A气体在标准状况下的密度为1.629g/L。
试确定:(1)x值;(2)A的相对原子质量和名称;(3)H—A键是否是极性键?H x A是否是极性分子?D.奥赛一瞥19.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学论断等高科技领域。
已知只有质子数或中子数为奇数的原子核有NMR现象。
试判断下列哪组原子均可产生NMR 现象()A. 1831119O P SnB. 271912Al F CC. 元素周期表中V A族所有元素的原子D. 元素周期表中第1周期所有元素的原子第四课时 非极性分子和极性分子【例题解析】1.[解析]根据(CN )2分子的对称性和180度的键角这两个已知条件,即可推知其电子式,并知其为非极性分子,再据其与氯气的性质相似,可写出与碱反应的方程式。