化学难点之 非极性分子和极性分子
- 格式:doc
- 大小:76.50 KB
- 文档页数:3


如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。

非极性分子与极性分子分子是由原子组成的。
当原子相互结合时,它们所形成的分子可以是极性的或非极性的。
在对分子进行分类时,需要了解一些基本的化学知识,例如化学键的类型、电子云的分布等等。
本文将介绍非极性分子和极性分子的概念,以及它们的区别。
一、什么是非极性分子?非极性分子是由原子组成的分子,其中原子之间不会产生极性化学键。
这些分子通常由相同性质的原子组成,例如氧气(O2)、氢气(H2)和氮气(N2)。
这些分子的化学键是非极性化学键,这意味着它们是由共价键组成的,共享电子对在两个原子之间平均分布,没有正负极性区。
非极性分子的化学键非常稳定,因为它们通常不与其他分子形成氢键或离子键。
这些分子的化学性质较为稳定,不易被其他物质影响。
例如在空气中,氧气、氮气和氢气都具有较高的稳定性,它们不会被其他物质影响,从而不易被氧化和/或还原。
极性分子是由两种或更多种不同原子组成的分子,其中至少一个化学键是极性化学键。
化学键的极性是由于电子云的分布不均匀所导致的。
每个原子中的电子云在分子中形成了偏移,这意味着它们的电荷分布不再对称。
正因为如此,分子在两端存在带有相反的电荷部分,并能与其他分子发生氢键或离子键。
极性分子的极性化学键会导致分子间的分子间相互作用增强,因此分子更容易被其他分子吸引。
这导致了极性分子在不同物理和化学条件下表现出不同的性质。
例如水(H2O)是一种重要的极性分子,因为其中的氧原子和氢原子之间形成了一个极性化学键。
水具有许多特殊的性质,例如可溶性高、极性化学反应性强等等。
1、化学键类型非极性分子和极性分子的显著区别在于它们的化学键类型。
非极性分子通常由非极性化学键组成,而极性分子则包括至少一个极性化学键。
2、电子云分布非极性分子和极性分子的电子云分布也是不同的。
非极性分子原子间的电子云均匀分布,而极性分子原子间的电子云分布不均匀。
3、化学性质由于极性化学键的存在,极性分子在化学方面表现出不同的性质,例如易溶于水、易发生化学反应等。

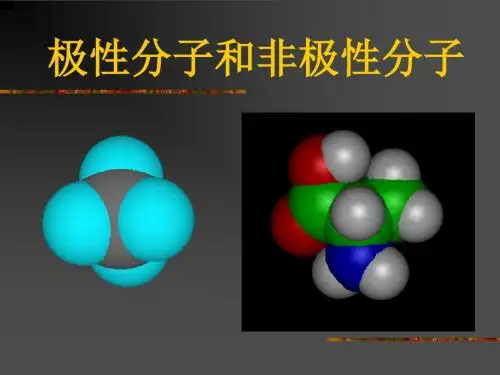
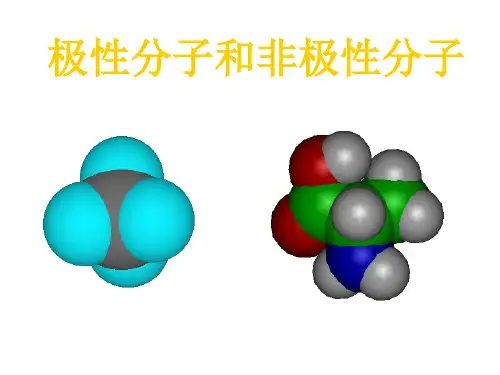
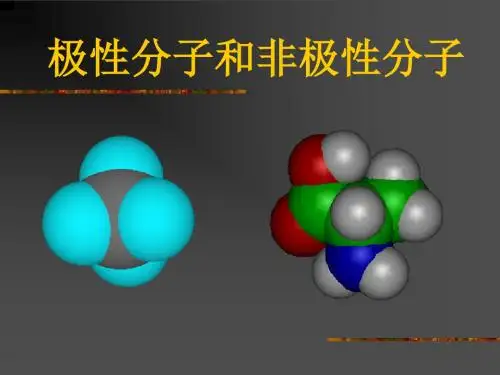

高中化学分子的极性与非极性解析极性分子和非极性分子:(1)极性分子:正电荷中心和负电荷中心不相重合的分子(2)非极性分子:正电荷中心和负电荷中心相重合的分子(3)分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定非极性分子和极性分子的比较:举例说明:分子极性的判断方法:An型分子(以非极性键结合形成的单质分子)一般是非极性分子(O3例外),AB型分子一定是极性分子。
对于ABn型分子是极性分子还是非极性分子,通常有以下判断方法。
1.根据分子的立体构型判断判断ABn型分子是否有极性,关键是看分子的立体构型.如果分子的立体构型为直线形、平面三角形、正四面体形、三角双锥形、正八面体形等空间对称的结构,致使正电中心与负电中心重合,这样的分子就是非极性分子。
若为V形、三角锥形、四面体形(非正四面体形)等非对称结构,则为极性分子。
比如H2O分子中虽然2个H原子轴对称,但整个分子的空间构型是不对称的:,负电中心在a点,正电中心在b 点,二者不重合,因此是极性分子。
2.根据实验现象判断将液体放入适宜的滴定管中,打开活塞让其缓慢流下,将用毛皮摩擦过的橡胶棒靠近液流,流动方向变化(发生偏移)的是极性分子.流动方向不变的是非极性分子。
3.根据中心原子最外层电子是否全部成键判断ABn型分子中的中心原子A的最外层电子若全部成键(没有孤电子对),此分子一般为非极性分子,如CO2、CCl4等;分子中的中心原子最外层电子若未全部成键(有孤电子对),此分子一般为极性分子,如H2O、PCl3等。
4.判断ABn型分子极性的经验规律若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,是非极性分子;H2O、NH3、SO2、PCl3等分子中,O、N、S、P等元素的化合价的绝对值不等于其主族序数,是极性分子。

化学键 非极性分子和极性分子1. 复习重点1.化学键、离子键、共价键的概念和形成过程及特征;2.非极性共价键、极性共价键,非极性分子、极性分子的定义及相互关系。
2. 难点聚焦 一.化学键:1.概念:化学键:相邻的原子之间强烈的相互作用.离子键:存在于离子化合物中2.分类: 共价键:存在于共价化合物中二.离子键:1. 离子化合物:由阴、阳离子相互作用构成的化合物。
如NaCl/Na 2O/Na 2O 2/NaOH/Na 2SO 4等。
2. 离子键:使阴、阳离子结合成化合物的静电作用。
说明:(1)静电作用既包含同种离子间的相互排斥也包含异种离子间的相互吸引。
是阴、阳离子间的静电吸引力与电子之间、原子核之间斥力处于平衡时的总效应。
(2)成键的粒子:阴、阳离子 (3)成键的性质:静电作用 (4)成键条件:①活泼金属(IA 、IIA 族)与活泼非金属(VIA 、VIIA 族)之间相互化合――――nen me m M M X X ---++-−−−→−−−→ −−−−→吸引、排斥达到平衡离子键(有电子转移) ②阴、阳离子间的相互结合: +-Na +Cl =NaCl (无电子转移)5)成键原因:(1)成键的主要原因:电子得失; (2)成键的粒子:阴阳离子; (3)成键的性质:静电作用;(4)成键元素:活泼的金属元素与活泼的非金属元素;(5)存在离子键的物质:强碱、低价态金属氧化物和大部分盐。
①原子相互作用,得失电子形成稳定的阴、阳离子; ②离子间吸引与排斥处于平衡状态; ③体系的总能量降低。
(6)存在:离子化合物中一定存在离子键,常见的离子化合物有强碱、绝大多数盐(PbCl 2/Pb(CH 3COO)2等例外),强的金属的氧化物,如:Na 2O/Na 2O 2/K 2O/CaO/MgO 等。
三.电子式:1.概念:由于在化学反应中,一般是原子的最外层电子发生变化,所以,为了简便起见,我们可以在元素符号周围用小黑点(或×)来表示原子的最外层电子。

非极性分子和极性分子非极性分子和极性分子【考纲要求】1.理解极性键与非极性键的形成原因,并能进行化学键的极性强弱比较。
2.理解化学键的极性与分子的极性的区别与联系,掌握极性分子与非极性分子的判断依据和判断方法。
3.理解分子间作用力和氢键的概念以及对物质性质的影响。
教与学方案【自学反馈】一、概念辨析1.非极性键:(1)概念:。
(2)形成条件:。
2.极性键:(1)概念:。
(2)形成条件:。
(3)共价键极性强弱比较依据:形成共价键的共用电子对偏向与偏离程度越大,键的极性就越强。
试比较下列两组共价键的强弱:①H—H、H—F、H—O、H—N、H—C:;②H—F、C—F、N—F、O—F、F—F:。
3.极性分子:(1)含义:。
(2)举例:。
4.非极性分子:(1)含义:。
(2)判断方法:①根据键角判断分子中的正负电荷重心是否重叠②根据AB n的中心原子A周围是否为完全等价的电子对③根据AB n的中心原子A的最外层价电子是否全部参与形成了同样的共价键。
(或A是否达最高价)(3)常见AB n型分子中极性分子与非极性分子比较:分子类型举例键角构形分子极性AB COAB2(A2B)H2OCS2BeCl2AB3PCl3BF3SO3AB4CH4AB2C2CH2Cl2A2B4C2H4A2B2C2H2A6B6C6H65.分子间作用力:(1)概念:。
(2)影响因素:。
(3)对物质性的影响:。
6.氢键:(1)概念:。
(2)形成条件:。
(3)对物质性质的影响:。
7.相似相溶原理:。
.【例题解析】[例1] ] 氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,和卤素单质的性质相似。
(1)写出氰与苛性钠溶液反应的离子方程式:_______________________。
(2)已知氰分子键之间夹角为180°并有对称性,(CN)2的电子式为______________,结构式为______________,(CN)2分子为______________(填“极性”或“非极性”)分子。
极性分子与非极性分子你知道冰为什么在4℃时密度最大吗?这就是本讲所学内容——分子间作用力和氢键的有关知识。
由于水分子间有氢键缔合这样的特殊结构。
根据近代X射线的研究,证明了冰具有四面体的晶体结构。
这个四面体是经过氢键形成的,是一个敞开式的松弛结构,因为5个水分子不能把全部四面体的体积占完,在冰中氢键把这些四面体联系起来,成为一个整体。
这种通过氢键形成的定向有序排列,空间利用率较小,约占34%,因此冰的密度较小。
液态水不像冰那样完全是有序排列了,而是有一定程度的无序排列,即水分子间的距离不像冰中那样固定,H2O分子可以由一个四面体的微晶进入另一微晶中去。
这样,分子间的空隙减少,密度就增大了。
温度升高时,水分子的四面体集团不断被破坏,分子无序排列增多,使密度增大。
但同时,水分子的热运动也增加了分子间的距离,使密度又减小。
这两个矛盾的因素在4℃时达到平衡,因此,在4℃时水的密度最大。
过了4℃后,分子的热运动使分子间的距离增大的因素,就占优势了,水的密度又开始减小。
知识延伸一、分子间作用力分子型物质无论是气态、液态或固态,都是由许多分子组成的,在分子间存在着一种较弱的作用力叫分子间作用力,也叫做范德华力。
它比分子内原子间的作用力(化学键)要小。
分子间的作用力是一个总的提法,按作用力产生的原因和特性可分为三种力:l.取向力当两个极性分子靠近时,同极相斥,异极相吸,产生相对转动,最后必然是异极相对,同极尽量远离,这叫做分子的取向。
这种由于极性分子取向而产生的力叫取向力。
2.诱导力当极性分子接近非极性分子时,极性分子的偶极电场使非极性分子发生极化从而产生正、负电荷重心不相重合,这种由于外来的影响而产生的偶极叫诱导偶极,诱导偶极与固有偶极产生的力称为诱导力。
一般说来,极性分子的极性越大,诱导力越大。
分子的变形性越大,诱导力也越大。
3.色散力非极性分子之间也存在着相互吸引力,非极性分子内部的原子核和电子都在不断地运动,不断地改变它们相对的位置。
非极性分子和极性分子
学习目标
1.了解非极性键、极性键、非极性分子和极性分子的概念。
2.通过对简单的非极性分子、极性分子结构的分析,了解化学键的极性与分子极性的关系。
重点、难点
重点:非极性分子和极性分子
难点:分子结构与分子极性的关系。
电子云分布均匀、对称,分子中正电荷中心与负电荷中心重合在一起的是非极性分子。
电子云分布不均匀、不对称,分子中正电荷中心与负电荷中心不能重合在一起的是极性分子。
前面我们已经研究过键的极性,对于双原子分子来说,键的极性与分子的极性是一致的。
如HCl分子,由于Cl的电负性比H大,它对电子的吸引能力大于H,则HCl分子中的共用电子对偏向于Cl,结果在HCl分子中Cl这一端显负电性,H这一端显正电性。
但是,并非所有只以极性键组成的分子都是极性分子。
例如,在AB2型化合物中CO2就是非极性分子,而H2O、SO3等分子就是极性分子。
这是由于尽管CO2分子中C = O键是极性键,但是CO2分子是直线型对称分布(O = C = O),两个C = O键的极性正好抵消,其正负电荷中心重合在一起,因此,CO2分子是非极性分子。
而H2O分子和SO2分子为V型结构,正负电荷中心不可能重合在一起,因此H2O分子和SO2分子为极性分子。
极性分子组成的溶剂称极性溶剂,非极性分子组成的溶剂称非极性溶剂。
在通常情况下,极性分子和离子化合物易溶于极性溶剂中,而非极性分子易溶于非极性溶剂中。
如:Br2、I2等非极性分子易溶于CCl4、苯等非极性溶剂中,HCl、HBr、NH3等极性分子易溶于极性溶剂中。
重点、难点、疑点知识
1.非极性键和极性键
(1) 非极性键:同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,电荷在两个原子核附近对称地分布,因此成键的原子都不显电性。
这样的共价键称为非极性键。
判断方法:由相同元素的原子形成的共价键是非极性键。
如单质分子(X n,n > 1,如H2、Cl2、O3、P4等)和某些共价化合物(如C2H2、C2H4、CH3CH2OH等)、某些离子化合物(如Na2O2、CaC2等)含有非极性键。
(2) 极性键:不同种原子形成共价键,由于不同原子吸引电子的能力不同,使得分子中共用电子对的电荷是非对称分布的。
这样的共价键叫做极性键。
判断方法:由不同元素的原子形成的共价键一般是极性键。
如HCl、CO2、CCl4、SO42-、OH-等都含有极性键。
(3) 极性键和非极性键的关系:①有的分子中只有非极性键,如H2、Cl2、O3等。
②有的分子中只有极性键,如HCl、H2S、CO2、CH4等。
③也有的分子中既有极性键,又有非极性键,如H2O2、C
2
H2、CH3CH2OH等。
2.非极性分子和极性分子
(1) 非极性分子:电荷分布是对称的分子称为非极性分子。
例如X2型双原子分子(如H2、Cl2、Br2等)、XY n型多原子分子中键的极性互相抵消的分子(如CO2、CCl4等)都属非极性分子。
(2) 极性分子:电荷分布是不对称的分子称为极性分子。
例如XY型双原子分子(如HF、HCl、CO、NO等)、XY n型多原子分子中键的极性不能互相抵消的分子(如SO2、H2O、NH3等)都属极性分子。
判断分子的空间构型、分子的极性的思路一般是:
键之间的夹角−−−→
决定
分子的空间构型−−−→
决定
分子的极性
解题规律与技巧
分子的极性取决于键的极性和键在空间分布的对称性。
双原子分子中,其键的极性和分子的极性一致,AB n型的多原子分子的极性需视分子的空间构型而定。
键的极性和分子极性的关系见下表。
多原子分子情况比较复杂
例1能说明BF3分子的4个原子在同一平面的理由是()。
A.两个键之间夹角为120︒B.B—F键为非极性共价键
C.3个B—F键的键能相同D.3个B—F键的键长相等
例2下列分子中,具有极性键的非极性分子是()。
A.CO B.H2O C.CO2 D.CH3F
例3下列叙述正确的是()。
A.以非极性键结合起来的分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性键只存在于双原子单质分子里
D.非极性分子中,一定含有非极性共价键
例4下列各组物质中,都是由极性键构成为极性分子的一组是()。
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
例5已知SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子,由此可推出AB n型分子属于非极性分子的经验规律是()。
A.AB n型分子中A、B均不含氢原子
B.A元素的相对原子质量必小于B元素的相对原子质量
C.分子中所有原子都在同一平面上
D.分子中A原子最外层电子都已成键【练习】
1.在下列分子中一定具有极性的是()。
A.XY B.XY2 C.XY3 D.XY4
2.下列物质中含有极性共价键的是()。
A.单质溴B.氯化钙C.二氧化硫D.氢氧化钙
3.下列说法中不正确的是()。
A.含有共价键的化合物一定是共价化合物
B.含有离子键的化合物一定是离子化合物
C.气态单质分子中一定含有非极性共价键
D.双原子单质分子中共价键一定是非极性键
4.下列各组物质中,化学键的类型(离子键、共价键)相同的是()。
A.CaO和MgCl2 B.NH4F和NaF
C.Na2O2和H2O2 D.H2O和SO2
5.用萃取法从碘水中分离碘,所用萃取剂应具有的性质是()。
①不和碘或水起化学反应②能溶于水
③不溶于水④应是极性溶剂⑤应是非极性溶剂
A.①②⑤B.②③④C.①③⑤D.①③④
6.三氯化磷分子的空间构型是三角锥形而不是平面正三角形。
下列关于三氯化磷分子空间构型理由的叙述中正确的是()。
A.PCl3分子中3个共价键的键长、键之间夹角均相等
B.PCl3分子中的3个P—Cl键属于极性共价键
C.PCl3分子中的3个共价键的键长、键之间夹角不相等
D.PCl3分子中P—Cl键的3个键之间夹角都是100.1︒
7.下列分子中,含有非极性键的化合物是()。
A.HD B.CO2 C.H2O D.C2H5OH
8.下列叙述正确的是()。
A.两种元素构成的共价化合物分子中的化学键都是极性键
B.两种不同的非金属元素原子间形成的化学键都是极性键
C.含有非极性键的化合物分子一定不是极性分子
D.只要是离子化合物,其熔点就比共价化合物的熔点高
9.实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180︒,由此可判断BeCl2属于()。
A.由极性键形成的极性分子B.由极性键形成的非极性分子
C.由非极性键形成的极性分子D.由非极性键形成的非极性分子
10.下列说法中正确的是()。
A.非极性键只存在于同种元素形成的双原子分子中
B.极性键只存在共价化合物中
C.含非极性键的分子,有的是非极性分子,有的是极性分子
D.呈四面体型的共价化合物分子一定是非极性分子
11.下列物质中,分子极性最大,分子内化学键极性最强的是()。
A.HCl B.H2S C.CCl4 D.HF
12.碘微溶于水,易溶于CS2的主要原因是()。
A.碘是单质,水是化合物B.碘和CS2都是非极性分子,水是极性分子C.碘是固体,水是液体D.水的密度比CS2小
13.四氯化硅与四氯化碳相似,对其性质判断
①四氯化硅是原子晶体②常温下为液态
③由极性键构成的非极性分子④四氯化硅可溶于四氯化碳
其中可能正确的是()。
A.①④B.②③C.②③④D.①②③④
14.下列分子中键角最小的是()。
A.甲烷B.水C.二氧化碳D.氨
15.硫化氢(H2S)分子中,两个H—S键的夹角接近90︒,说明H2S分子的空间构型为_________型;二氧化碳(CO2)分子中,两个C=O键的夹角是180︒,说明CO2分子的空间构型为__________型;甲烷(CH4)分子中,两个相邻C—H键的夹角是10928'
︒,说明CH4分子的空间构型为__________________型。
16.氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,和卤素单质的性质相似。
(1)写出氰与苛性钠溶液反应的离子方程式:
________________________________________________________________________。
(2)已知氰分子键之间夹角为180︒并有对称性,(CN)2的电子式为__________________,
结构式为________________________,(CN)2分子为_____________(填“极性”或“非
极性”)分子。
(3)CN-中电子数为__________,CN-的电子式为________________________。