考点四 碱金属元素 焰色反应
- 格式:doc
- 大小:71.50 KB
- 文档页数:3

焰色反应当碱金属及其盐在火焰上灼烧时,焰色反应原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色。
但由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出不同波长的光,从焰色反应的实验里所看到的特殊焰色就是光谱谱线的颜色.每种元素的光谱都有一些特征谱线,发出特征的颜色而使火焰着色,根据焰色可以判断某种元素的存在.如焰色洋红色含有锶元素,焰色蓝绿色含有铜元素,焰色黄色含有钠元素,焰色紫色含有钾元素,砖红色则含有钙元素等。
通常所用的广泛试纸,此试纸测量范围是1-14,它只能是大致测量水的酸碱性。
而精密pH 试纸可以将pH值精确到小数点后一位。
精密试纸是按测量区间分的,有0.5-5.0,0.1-1.2,0.8-2.4等。
超过测量的范围,精密PH试纸就无效了。
可以先用广范试纸大致测出水的酸碱性,再用的精密试纸进行精确测量。
平底漏斗(布氏漏斗)操作步骤:见上图按照上图搭好装置,平底漏斗(也称布氏漏斗)上垫好滤纸;水泵(下图蓝色的装置)中灌满水,插上电源开启开关,连接水泵的管子就会产生吸力;将连接水泵的管子与上图中“抽气口”相连,抽滤瓶在水泵产生的吸力的作用下,里面的空气会被抽去,而使得抽滤瓶中产生负压,这样平底漏斗的上方与抽滤瓶中就产生了压力差,且平底漏斗上方的压力大于抽滤瓶中的压力;当将需要过滤的物质倒入平底漏斗中,在平底漏斗上方空气的压力下,粒径小于滤纸的物质就透过滤纸进入抽滤瓶中,粒径大于滤纸的物质则留在了漏斗的滤纸上。
追问:其实就是减压后,通过负压,可以更快分离固体和液体?效果和普通过滤差不多?追答:对的,较常压过滤而言,减压抽滤可以更快使固液分离;常压过滤往往会遇到如下困难:1)常压过滤时,如果滤纸和漏斗的隔层和漏斗管里有气泡或者漏斗管口(斜面背后)没有贴紧烧杯壁,就会使过滤受到空气的阻力而减慢;(2)抽滤的关键在于控制水的流量,开始时如果水的流速过大,会使滤纸穿孔。



常见金属焰色反应颜色金属焰色反应是一种常见的化学现象,它是由于金属在高温下受热而发生的电子跃迁过程,从而导致金属离子的激发发光。
在实验室或者烟花表演中,我们可以通过观察金属在火焰中的颜色来推测金属的成分。
下面将介绍几种常见金属的焰色反应及其颜色。
1. 钠(Na)的焰色反应颜色为黄色。
钠是一种常见的碱金属,当钠盐溶解在火焰中时,火焰会呈现出明亮的黄色。
这是因为钠离子在高温下受热激发,电子跃迁从高能级到低能级时释放出黄光。
2. 钾(K)的焰色反应颜色为紫色。
钾也是一种碱金属,其焰色反应与钠类似,但颜色稍微偏向紫色。
这是因为钾离子的电子跃迁释放出的光波长较长,呈现出紫色。
3. 铜(Cu)的焰色反应颜色为绿色。
铜是一种过渡金属,其焰色反应较为特殊。
当铜盐溶解在火焰中时,火焰呈现出明亮的绿色。
这是因为铜离子的电子跃迁释放出的光波长对应着绿色。
4. 钙(Ca)的焰色反应颜色为橙色。
钙是一种碱土金属,其焰色反应呈现出橙色。
钙离子的电子跃迁释放出的光波长较长,对应着橙色。
5. 锂(Li)的焰色反应颜色为红色。
锂是一种碱金属,其焰色反应呈现出红色。
锂离子的电子跃迁释放出的光波长较长,对应着红色。
6. 铁(Fe)的焰色反应颜色为金黄色。
铁是一种过渡金属,其焰色反应呈现出金黄色。
这是因为铁离子的电子跃迁释放出的光波长对应着金黄色。
7. 锰(Mn)的焰色反应颜色为粉红色。
锰是一种过渡金属,其焰色反应呈现出粉红色。
锰离子的电子跃迁释放出的光波长较长,对应着粉红色。
8. 铅(Pb)的焰色反应颜色为蓝色。
铅是一种重金属,其焰色反应呈现出蓝色。
铅离子的电子跃迁释放出的光波长较短,对应着蓝色。
9. 锌(Zn)的焰色反应颜色为白色。
锌是一种过渡金属,其焰色反应呈现出白色。
这是因为锌离子的电子跃迁释放出的光波长较宽,覆盖了可见光谱的大部分区域,所以呈现出白色。
除了上述提到的金属,还有许多其他金属在高温下也会发生焰色反应,每种金属的焰色反应都有其独特的颜色。

焰色反应颜色大全1. 钠盐类物质。
钠盐类物质在燃烧时产生明亮的黄色火焰,这是因为钠在高温下激发产生黄色光线的缘故。
常见的钠盐类物质包括氯化钠、硝酸钠等。
2. 钾盐类物质。
钾盐类物质在燃烧时产生紫色火焰,这是因为钾在高温下激发产生紫色光线的缘故。
常见的钾盐类物质包括氯化钾、硝酸钾等。
3. 锂盐类物质。
锂盐类物质在燃烧时产生红色火焰,这是因为锂在高温下激发产生红色光线的缘故。
常见的锂盐类物质包括氯化锂、硝酸锂等。
4. 钙盐类物质。
钙盐类物质在燃烧时产生橙黄色火焰,这是因为钙在高温下激发产生橙黄色光线的缘故。
常见的钙盐类物质包括氯化钙、硝酸钙等。
5. 铜盐类物质。
铜盐类物质在燃烧时产生绿色火焰,这是因为铜在高温下激发产生绿色光线的缘故。
常见的铜盐类物质包括氯化铜、硝酸铜等。
6. 锰盐类物质。
锰盐类物质在燃烧时产生粉红色火焰,这是因为锰在高温下激发产生粉红色光线的缘故。
常见的锰盐类物质包括氯化锰、硝酸锰等。
7. 铁盐类物质。
铁盐类物质在燃烧时产生金黄色火焰,这是因为铁在高温下激发产生金黄色光线的缘故。
常见的铁盐类物质包括氯化铁、硝酸铁等。
8. 锌盐类物质。
锌盐类物质在燃烧时产生蓝色火焰,这是因为锌在高温下激发产生蓝色光线的缘故。
常见的锌盐类物质包括氯化锌、硝酸锌等。
9. 铝盐类物质。
铝盐类物质在燃烧时产生银白色火焰,这是因为铝在高温下激发产生银白色光线的缘故。
常见的铝盐类物质包括氯化铝、硝酸铝等。
10. 镁盐类物质。
镁盐类物质在燃烧时产生亮白色火焰,这是因为镁在高温下激发产生亮白色光线的缘故。
常见的镁盐类物质包括氯化镁、硝酸镁等。
通过观察不同物质在燃烧时产生的焰色,我们可以初步判断其成分,这对于化学分析和实验室检测具有重要意义。
同时,焰色反应也是一种直观、生动的实验方法,能够吸引学生的注意力,提高他们对化学实验的兴趣。
希望大家能够通过本文提供的焰色反应颜色大全,更好地了解这一实验方法的应用和意义。

高考化学知识点:焰色反应(一)钠离子:钠的焰色反响本应不难做,但实践做起来最费事。
由于钠的焰色为黄色,而酒精灯的火焰因灯头灯芯不洁净、酒精不纯而使火焰大多呈黄色。
即使是近乎无色(浅淡蓝色)的火焰,一根新的铁丝(或镍丝、铂丝)放在外焰上灼烧,末尾时火焰也是黄色的,很难说明焰色是钠离子的还是原来酒精灯的焰色。
要清楚看到钠的黄色火焰,可用如下方法。
⑴方法一(镊子-棉花-酒精法):用镊子取一小团棉花(脱脂棉,下同)吸少许酒精(95%乙醇,下同),把棉花上的酒精挤干,用该棉花沾一些氯化钠或无水碳酸钠粉末(研细),扑灭。
⑵方法二(铁丝法):①取一条细铁丝,一端用砂纸擦净,再在酒精灯外焰上灼烧至无黄色火焰,②用该端铁丝沾一下水,再沾一些氯化钠或无水碳酸钠粉末,③扑灭一盏新的酒精灯(灯头灯芯洁净、酒精纯),④把沾有钠盐粉末的铁丝放在外焰尖上灼烧,这时外焰尖上有一个小的黄色火焰,那就是钠焰。
以上做法教员演示实验较易做到,但先生实验因大少数酒精灯都不洁净而很美观到焰尖,可改为以下做法:沾有钠盐的铁丝放在外焰中任一有蓝色火焰的部位灼烧,黄色火焰掩盖蓝色火焰,就可以为黄色火焰就是钠焰。
(二)钾离子:⑴方法一(烧杯-酒精法):取一小药匙无水碳酸钠粉末(充沛研细)放在一倒置的小烧杯上,滴加5~6滴酒精,扑灭,可看到清楚的浅紫色火焰,假设隔一钴玻璃片观察,那么更清楚看到紫色火焰。
⑵方法二(蒸发皿-•酒精法):取一药匙无水碳酸钠粉末放在一个小发皿内,参与1毫升酒精,扑灭,熄灭时用玻棒不时搅动,可看到紫色火焰,透过钴玻璃片观察效果更好,到酒精快烧完时现象更清楚。
⑶方法三(铁丝-棉花-水法):取少许碳酸钠粉末放在一小蒸发皿内,加一两滴水调成糊状;再取一条小铁丝,一端擦净,弯一个小圈,圈内夹一小团棉花,棉花沾一点水,又把水挤干,把棉花沾满上述糊状碳酸钠,放在酒精灯外焰上灼烧,透过钴玻璃片可看到清楚的紫色火焰。
⑷方法四(铁丝法):同钠的方法二中的先生实验方法。

科技知识:焰色反应
一、含义
焰色反应,又被称为焰色测试或焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。
二、原理
焰色反应属于物理变化,而非化学变化,它并未生成新的物质,这一点是常识题当中最常考到的。
焰色反应是物质原子内部电子能级的改变,即原子中的电子能量的变化,不涉及物质结构和化学性质的改变。
比如当碱金属及其盐在火焰上灼烧时,焰色反应原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为400nm-760nm),因而能使火焰呈现颜色。
但由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出不同波长的光,从焰色反应的实验里所看到的特殊焰色就是光谱谱线的颜色。
由此可见,焰色反应的原理其实就是电子跃迁。
三、应用
焰色反应的应用主要表现在以下两个:
1.利用焰色反应可检验某些用常规化学方法不能鉴定的金属元素。
2.不同的金属及其化合物对应不同的焰色反应且颜色艳丽多彩,因此可用于制作节日燃放的烟花等。
四、常见的焰色反应及口诀
钾紫钡黄绿,钠黄锂紫红;铷紫钙砖红,铜绿锶洋红。
即钾离子焰色反应为浅紫色,钡离子焰色反应为黄绿色,钠离子焰色反应为黄色,锂离子焰色反应为紫红色,铷离子焰色反应为紫色,钙离子焰色反应为砖红色,铜离子焰色反应为绿色,锶离子焰色反应为洋红色。

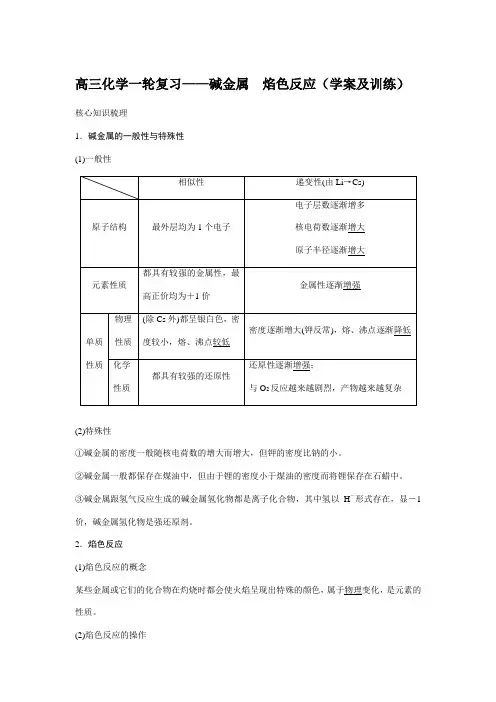
高三化学一轮复习——碱金属焰色反应(学案及训练)核心知识梳理1.碱金属的一般性与特殊性(1)一般性(2)特殊性①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。
2.焰色反应(1)焰色反应的概念某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,属于物理变化,是元素的性质。
(2)焰色反应的操作铂丝――→酒精灯灼烧无色――→蘸取待测物――→酒精灯灼烧观察火焰颜色――→用盐酸洗涤铂丝――→酒精灯灼烧无色 (3)常见元素的焰色钠元素黄色;钾元素紫色(透过蓝色钴玻璃观察);铜元素绿色;钡元素黄绿色;锶洋红色;锂元素紫红色;钙元素砖红色。
问题思考做焰色反应实验时,为什么用稀盐酸洗涤铂丝而不用稀硫酸?答案 铂丝在使用前要用稀盐酸将其表面物质洗净,然后在火焰上灼烧至无色,这是因为金属氯化物在灼烧时易挥发,若用稀H 2SO 4洗涤铂丝,由于硫酸盐的熔、沸点较高而难以挥发,会对后面实验造成干扰。
课堂练习1.正误判断,正确的打“√”,错误的打“×”(1)将镁条点燃后迅速伸入集满CO2的集气瓶中,集气瓶中产生浓烟并有黑色颗粒产生()(2019·全国卷Ⅱ,10B)(2)室温下Na与空气中O2反应制取Na2O2()(2019·江苏,6D)(3)电解熔融氯化镁可制取金属镁()(2018·浙江11月选考,8A)(4)金属钠着火时,可用细沙覆盖灭火()(2018·浙江11月选考,9B)(5)纯碱可用于去除物品表面的油污()(2018·浙江4月选考,6A)(6)二氧化碳可用作镁燃烧的灭火剂()(2018·浙江4月选考,6B)(7)实验室应将钠保存在煤油中()(2017·浙江4月选考,10A)(8)钠可以从四氯化钛中置换出钛()(2016·浙江4月选考,8D)(9)钠和钾的合金可用于快中子反应堆作热交换剂()(2015·浙江10月选考,19A)(10)某试样焰色反应呈黄色,则试样中含有K+()(2016·浙江4月选考,9A)(11)焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验()(2015·浙江10月选考,24B) (12)碳酸氢钠可用于治疗胃酸过多()(2017·浙江4月选考,6A)答案(1)√(2)×(3)√(4)√(5)√(6)×(7)√(8)√(9)√(10)×(11)√(12)√2.下列有关铯及其化合物的说法不正确的是()A.CsOH的碱性比KOH的强B.铯与水或稀盐酸反应剧烈,都生成H2C.Cs的还原性比Na的强,故Na+的氧化性强于Cs+D.Li的金属性比Cs的强答案 D解析根据元素周期律,Cs的金属性比K强,故CsOH的碱性比KOH强,A项正确;Cs 的性质与钠相似,Na能与水或稀盐酸反应产生H2,故Cs也能与水或稀盐酸反应产生H2,且反应更剧烈,B项正确;Cs的还原性强于Na,则Na+得电子能力比Cs+强,即氧化性:Na+>Cs+,C项正确;Li、Cs均为碱金属元素,Cs的电子层数多,更容易失去最外层电子,故金属性:Cs>Li,D项错误。
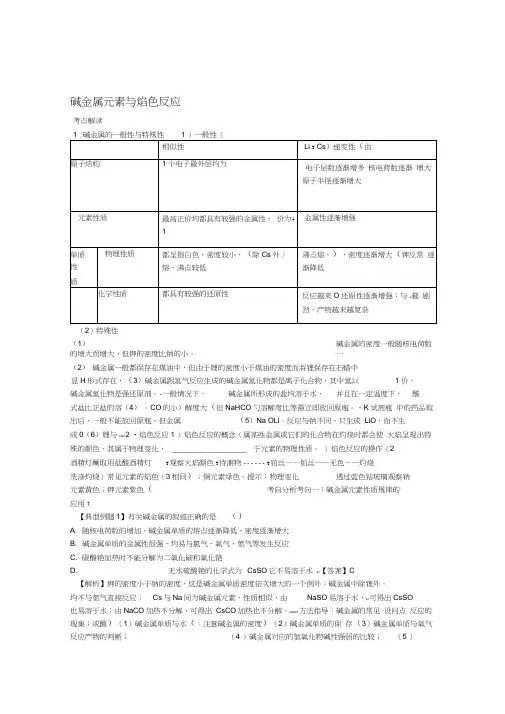
碱金属元素与焰色反应考点解读(2)特殊性(1)碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
一(2)碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中(3)碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以1价,-显H形式存在,碱金属氢化物是强还原剂。
-一般情况下,碱金属所形成的盐均溶于水,并且在一定温度下,酸式盐比正盐的溶(4)。
CO的小)解度大(但NaHCO勺溶解度比等需立即放回原瓶。
、K试剂瓶中的药品取岀后,一般不能放回原瓶,但金属(5)Na OLi。
反应与钠不同,只生成LiO,而不生成0(6)锂与2222 2 •焰色反应1 )焰色反应的概念(属某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,其属于物理变化,____________________ 于元素的物理性质。
)焰色反应的操作(2酒精灯蘸取用盐酸酒精灯T观察火焰颜色T待测物------ T铂丝——铂丝——无色——灼烧洗涤灼烧)常见元素的焰色(3相同);铜元素绿色。
提示:物理变化透过蓝色钻玻璃观察钠元素黄色;钾元素紫色(考向分析考向一:碱金属元素性质规律的应用1【典型例题1】有关碱金属的叙述正确的是()A. 随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大B. 碱金属单质的金属性很强,均易与氯气、氧气、氮气等发生反应C. 碳酸铯加热时不能分解为二氧化碳和氧化铯D. 无水硫酸铯的化学式为CsSO它不易溶于水42【答案】C【解析】钾的密度小于钠的密度,这是碱金属单质密度依次增大的一个例外;碱金属中除锂外,均不与氮气直接反应;Cs与Na同为碱金属元素,性质相似,由NaSO易溶于水,42可得岀CsSO也易溶于水;由NaCO加热不分解,可得岀CsCO加热也不分解。
322423 方法指导:碱金属的常见设问点反应的现象;或酸)(1)碱金属单质与水(;注意碱金属的密度)(2)碱金属单质的保存(3)碱金属单质与氧气反应产物的判断;(4 )碱金属对应的氢氧化物碱性强弱的比较;(5 )碱金属的碳酸盐性质的比较;(6 )与最新的科学技术相关的碱金属的应用。

考点22 碱金属元素焰色反应聚焦与凝萃1.掌握碱金属元素在结构及性质方面的递变规律及特性;2.了解焰色反应的概念及操作。
解读与打通常规考点一、碱金属元素1、原子结构(1)相似性:最外层均为1个电子,易失去一个电子。
(2)递变性:核电荷数依次增多,电子层数依次增多,原子半径依次增大,失电子能力依次增强,活泼程度增强。
2、元素性质(1)相似性:均为活泼金属元素,最高正价均为+1价。
(2)递变性:失电子能力依次增强,金属性依次增强。
3、单质性质(1)相似性:均具强还原性,均具轻、软、易熔的特点。
(2)递变性:还原性依次增强,密度趋向增大,熔沸点依次降低(原因,可与卤素对比),硬度趋向减小。
4、化合物性质(1)相似性:氢氧化物均为强碱。
(2)递变性:氢氧化物的碱性依次增强。
5、碱金属的性质规律与特例(1)通常合金多呈固态,而钠钾合金却是液态。
(2)碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
(3)碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
(4)碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
(5)碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
(6)碱金属的盐一般都易溶于水,但Li2CO3却微溶。
(7)一般说,酸式盐较正盐溶解度大,但NaHCO 3却比Na 2CO 3溶解度小。
(8)试剂瓶中的药品取出后,一般不能放回原瓶,但IA 金属Na 、K 等除外。
(9)一般活泼金属能从盐中置换出不活泼金属,但对IA 非常活泼的金属Na 、K 等除外。
如:2Na+CuSO 4+2H 2O=Cu(OH)2↓+H 2↑+Na 2SO 4。
(10)Fr 是放射性元素,所以在自然界中不存在。
二、焰色反应1.概念:某些金属或它们的化合物在灼烧时使火焰呈现出特殊的颜色,这种现象化学上叫做焰色反应。
2.操作铂丝 无色 待测物 观察火焰颜色 铂丝无色。
化学焰色反应知识点化学焰色反应(一).钠离子:钠的焰色反应本应不难做,但实际做起来最麻烦。
因为钠的焰色为黄色,而酒精灯的火焰因灯头灯芯不干净、酒精不纯而使火焰大多呈黄色。
即使是近乎无色(浅淡蓝色)的火焰,一根新的铁丝(或镍丝、铂丝)放在外焰上灼烧,开始时火焰也是黄色的,很难说明焰色是钠离子的还是原来酒精灯的焰色。
要明显看到钠的黄色火焰,可用如下方法。
⑴方法一(镊子-棉花-酒精法):用镊子取一小团棉花(脱脂棉,下同)吸少许酒精(95%乙醇,下同),把棉花上的酒精挤干,用该棉花沾一些氯化钠或无水碳酸钠粉末(研细),点燃。
⑵方法二(铁丝法):①取一条细铁丝,一端用砂纸擦净,再在酒精灯外焰上灼烧至无黄色火焰②用该端铁丝沾一下水,再沾一些氯化钠或无水碳酸钠粉末③点燃一盏新的酒精灯(灯头灯芯干净、酒精纯)④把沾有钠盐粉末的铁丝放在外焰尖上灼烧,这时外焰尖上有一个小的黄色火焰,那就是钠焰。
以上做法教师演示实验较易做到,但学生实验因大多数酒精灯都不干净而很难看到焰尖,可改为以下做法:沾有钠盐的铁丝放在外焰中任一有蓝色火焰的部位灼烧,黄色火焰覆盖蓝色火焰,就可认为黄色火焰就是钠焰。
(二).钾离子:⑴方法一(烧杯-酒精法):取一小药匙无水碳酸钠粉末(充分研细)放在一倒置的小烧杯上,滴加5~6滴酒精,点燃,可看到明显的浅紫色火焰,如果隔一钴玻璃片观察,则更明显看到紫色火焰。
⑵方法二(蒸发皿-•酒精法):取一药匙无水碳酸钠粉末放在一个小发皿内,加入1毫升酒精,点燃,燃烧时用玻棒不断搅动,可看到紫色火焰,透过钴玻璃片观察效果更好,到酒精快烧完时现象更明显。
⑶方法三(铁丝-棉花-水法):取少许碳酸钠粉末放在一小蒸发皿内,加一两滴水调成糊状;再取一条小铁丝,一端擦净,弯一个小圈,圈内夹一小团棉花,棉花沾一点水,又把水挤干,把棉花沾满上述糊状碳酸钠,放在酒精灯外焰上灼烧,透过钴玻璃片可看到明显的紫色火焰。
⑷方法四(铁丝法):同钠的方法二中的学生实验方法。
2021届高三化学一轮复习一一碱金属焰色反应(学案及训练)核心知识梳理1.碱金属的一般性与特殊性⑴一般性⑵特殊性①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H9式存在,显一1 价,碱金属氢化物是强还原剂。
2.焰色反应(1)焰色反应的概念某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,属于物理变化,是元素的性质。
(2)焰色反应的操作伯丝酒精4无色—叽待测物――4观察火焰颜色用盐酸伯丝迪坦无色灼烧灼烧洗涤灼烧(3)常见元素的焰色钠元素黄色;钾元素紫色(透过蓝色钻玻璃观察):铜元素绿色:钡元素黄绿色:锶洋红色: 锂元素紫红色;钙元素砖红色。
问题思考做焰色反应实验时,为什么用稀盐酸洗涤箱丝而不用稀硫酸?答案柏丝在使用前要用稀盐酸将其表面物质洗净,然后在火焰上灼烧至无色,这是因为金属氯化物在灼烧时易挥发,若用稀H2SO4洗涤柏丝,由于硫酸盐的熔、沸点较高而难以挥发,会对后面实验造成干扰。
课堂练习1.正误判断,正确的打“J”,错误的打“X”(1)将镁条点燃后迅速伸入集满CO2的集气瓶中,集气瓶中产生浓烟并有黑色颗粒产生()(2019•全国卷n , 10B)(2)室温下Na与空气中O2反应制取Na2O2()(2019・江苏,6D)(3)电解熔融氯化镁可制取金属镁()(2018•浙江11月选考,8A)(4)金属钠着火时,可用细沙覆盖灭火()(2018•浙江11月选考,9B)(5)纯碱可用于去除物品表面的油污()(2018•浙江4月选考,6A)(6)二氧化碳可用作镁燃烧的灭火剂()(2018•浙江4月选考,6B)(7)实验室应将钠保存在煤油中()(2017•浙江4月选考,10A)(8)钠可以从四氯化钛中置换出钛()(2016•浙江4月选考,8D)(9)钠和钾的合金可用于快中子反应堆作热交换剂()(2015•浙江10月选考,19A)(10)某试样焰色反应呈黄色,则试样中含有K+( )(2016•浙江4月选考,9A)(11)焰色反应时,先用稀盐酸洗涤箱丝并在酒精灯火焰上灼烧,然后再进行实验()(2015 •浙江10月选考,24B) (12)碳酸氢钠可用于治疗胃酸过多()(2017•浙江4月选考,6A)答案(1)J (2)X (3)V (4) V (5)V (6)X (7) V (8) V (9) V (10) X (11) J (12) V2.下列有关铯及其化合物的说法不正确的是()A. CsOH的碱性比KOH的强B .铯与水或稀盐酸反应剧烈,都生成H2C.Cs的还原性比Na的强,故Na+的氧化性强于Cs+D.Li的金属性比Cs的强答案 D解析根据元素周期律,Cs的金属性比K强,故CsOH的碱性比KOH强,A项正确;Cs 的性质与钠相似,Na能与水或稀盐酸反应产生H2,故Cs也能与水或稀盐酸反应产生H2,且反应更剧烈,B项正确;Cs的还原性强于Na,则Na +得电子能力比Cs +强,即氧化性: Na + >Cs+,C项正确;Li、Cs均为碱金属元素,Cs的电子层数多,更容易失去最外层电子,故金属性:Cs>Li , D项错误。
【解题必备】1、碱金属元素单质的化学性质:(1)相似性:碱金属元素在结构上的相似性,决定了锂、钠、钾、铷、铯在性质上的相似性,碱金属都是强还原剂,性质活泼。
具体表现在都能与O2、Cl2、水、稀酸溶液反应,生成含R+(R为碱金属)的离子化合物;他们的氧化物对应水化物均是强碱;(2)递变性:随着原子序数的增加,电子层数递增,原子半径渐大,失电子渐易,还原性渐强,又决定了他们在性质上的递变性。
具体表现为:①与O2反应越来越剧烈,产物越来越复杂,②与H2O反应越来越剧烈,③随着核电荷数的增强,其最高价氧化物对应的水化物的碱性增强:CsOH>RbOH>KOH>NaOH>LiOH。
2、实验是如何保存锂、钠、钾:均是活泼的金属,极易氧化变质甚至引起燃烧,它们又都能与水、水溶液、醇溶液等发生反应产生氢气,是易燃易爆物质,存放它们要保证不与空气、水分接触;又因为它们的密度小,所以锂只能保存在液体石蜡或封存在固体石蜡中,而将钠、钾保存在煤油中;3、碱金属的制取:金属Li和Na主要是用电解熔融氯化物的方法制取;金属K因为易溶于盐不易分离,且电解时有副反应发生,故一般采用热还原法用Na从熔融KCl中把K置换出来(不是普通的置换,而是采用置换加抽取的方法,属于反应平衡);铷和铯一般也采用活泼金属还原法制取。
【专题必练】1.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,不.正确..的是A.它的原子半径比钠大,失电子能力不如钠B.它的金属性比钠强,跟水反应会更剧烈C.它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红D.它可与硫酸铜溶液反应,但是不易得到金属铜【答案】A点睛:本题考查了碱金属元素的性质和元素周期律的知识。
掌握碱金属元素性质的变化规律是解题的关键。
本题的易错点是D,要知道,碱金属的单质性质非常活泼,与盐溶液反应时,都是首先与水反应。
2.下列关于碱金属元素的原子结构和性质的叙述不正确的是A.碱金属原子最外层都只有1个电子,在化学反应中容易失去B.碱金属单质都是强还原剂C.碱金属单质都能在氧气中燃烧生成过氧化物D.碱金属单质都能与水反应生成强碱【答案】C【解析】A.碱金属元素在元素周期表中位于第IA族,最外层只有一个电子,金属性较强,在化学反应中容易失去,故A正确;B.碱金属原子最外层都只有一个电子,在化学反应中容易失去,所以碱金属单质都是强还原剂,故B正确;C.碱金属单质都能在O2中燃烧产物比较复杂,Li燃烧生成Li2O,Na燃烧生成Na2O2,故C错误;D.碱金属单质都是强还原剂,都能与水反应生成碱,故D正确;故选C。
钠、镁及其化合物
考点四 碱金属元素 焰色反应
1.碱金属的一般性与特殊性
(1)一般性 相似性 递变性(由Li →Cs) 原子
结构
最外层均为1个电子 电子层数逐渐增多 核电荷数逐渐增大 原子半径逐渐增大 元素
性质
都具有较强的金属性, 最高正价均为+1价 金属性逐渐增强 单质
性质 物理
性质 (除Cs 外)都呈银白色, 密度较小,熔、沸点较低 密度逐渐增大(钾反常),熔、沸点逐渐降低 化学
性质
都具有较强的还原性 还原性逐渐增强;与O 2反应越来越剧烈,产物越来越复杂
①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H -形式存在,显-1价,碱金属氢化物是强还原剂。
2.焰色反应
(1)焰色反应的概念
某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,其属于物理变化, 属于元素的性质。
(2)焰色反应的操作
铂丝――→酒精灯灼烧无色――→蘸取待测物――→酒精灯灼烧观察火焰颜色――→用盐酸洗涤铂丝――→酒精灯灼烧
无色 (3)常见元素的焰色
钠元素黄色;钾元素紫色(透过蓝色钴玻璃观察);铜元素绿色。
深度思考
1.根据碱金属的性质规律思考下列问题
(1)钠与氧气反应有Na 2O 、Na 2O 2两种氧化物生成,其他碱金属单质也只生成两种类似的氧化物吗?
答案不是,如Li与氧气反应只生成Li2O,K与O2反应还能生成更复杂的氧化物。
(2)钠的还原性比钾的弱,但工业上制取钾却用钠置换钾的原因是___________________。
答案由于Na+KCl NaCl+K是可逆反应,而K的熔、沸点比Na低,产生钾蒸气,使平衡向右移动
2.焰色反应是物理变化还是化学变化?
答案物理变化
题组一碱金属元素性质规律的应用
1.有关碱金属的叙述正确的是() A.随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大
B.碱金属单质的金属性很强,均易与氯气、氧气、氮气等发生反应
C.碳酸铯加热时不能分解为二氧化碳和氧化铯
D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
答案 C
解析钾的密度小于钠的密度,这是碱金属单质密度依次增大的一个例外;碱金属中除锂外,均不与氮气直接反应。
Cs与Na同为碱金属元素,性质相似,由Na2SO4易溶于水,可得出Cs2SO4也易溶于水;由Na2CO3加热不分解,可得出Cs2CO3加热也不分解。
2.金属活动性顺序表中K在Na的前面,K与Na在性质上具有很大的相似性。
下面是根据Na的性质对K的性质的预测,其中不正确的是
()
A.K在空气中可以被空气中的氧气氧化
B.K可以与乙醇发生反应生成氢气
C.K与水的反应不如钠与水的反应剧烈
D.K也可放在煤油中保存
答案 C
解析金属活动性顺序表中K在Na的前面,K比Na活泼,故K在空气中可以被氧气氧化,A项正确;Na与乙醇能够反应放出氢气,K也能与乙醇反应放出氢气,B项正确;
K与水的反应比Na与水的反应剧烈,C项错误;Na、K均可放在煤油中保存,D项正确。
题组二焰色反应
3.下列对焰色反应实验操作注意事项的说法,正确的是
()
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确B.仅有④不正确
C.仅有⑤不正确D.全对
答案 D
解析由于焰色反应是通过观察火焰颜色来检验离子是否存在的方法,所以实验时所用火焰和所用金属丝在灼烧时都不应该有很明显的颜色,否则将无法观察到被检验离子的真实焰色反应情况;观察钾的火焰颜色时要透过蓝色钴玻璃,目的是滤去黄光,避免钠的干扰。
反思归纳
碱金属常从以下几个方面设问题
(1)碱金属单质与水(或酸)反应的现象;
(2)碱金属单质的保存(注意碱金属的密度);
(3)碱金属单质与氧气反应产物的判断;
(4)碱金属对应的氢氧化物碱性强弱的比较;
(5)碱金属的碳酸盐性质的比较;
(6)与最新的科学技术相关的碱金属的应用。