碱金属元素焰色反应
- 格式:ppt
- 大小:1.72 MB
- 文档页数:35

焰色反应当碱金属及其盐在火焰上灼烧时,焰色反应原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色。
但由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出不同波长的光,从焰色反应的实验里所看到的特殊焰色就是光谱谱线的颜色.每种元素的光谱都有一些特征谱线,发出特征的颜色而使火焰着色,根据焰色可以判断某种元素的存在.如焰色洋红色含有锶元素,焰色蓝绿色含有铜元素,焰色黄色含有钠元素,焰色紫色含有钾元素,砖红色则含有钙元素等。
通常所用的广泛试纸,此试纸测量范围是1-14,它只能是大致测量水的酸碱性。
而精密pH 试纸可以将pH值精确到小数点后一位。
精密试纸是按测量区间分的,有0.5-5.0,0.1-1.2,0.8-2.4等。
超过测量的范围,精密PH试纸就无效了。
可以先用广范试纸大致测出水的酸碱性,再用的精密试纸进行精确测量。
平底漏斗(布氏漏斗)操作步骤:见上图按照上图搭好装置,平底漏斗(也称布氏漏斗)上垫好滤纸;水泵(下图蓝色的装置)中灌满水,插上电源开启开关,连接水泵的管子就会产生吸力;将连接水泵的管子与上图中“抽气口”相连,抽滤瓶在水泵产生的吸力的作用下,里面的空气会被抽去,而使得抽滤瓶中产生负压,这样平底漏斗的上方与抽滤瓶中就产生了压力差,且平底漏斗上方的压力大于抽滤瓶中的压力;当将需要过滤的物质倒入平底漏斗中,在平底漏斗上方空气的压力下,粒径小于滤纸的物质就透过滤纸进入抽滤瓶中,粒径大于滤纸的物质则留在了漏斗的滤纸上。
追问:其实就是减压后,通过负压,可以更快分离固体和液体?效果和普通过滤差不多?追答:对的,较常压过滤而言,减压抽滤可以更快使固液分离;常压过滤往往会遇到如下困难:1)常压过滤时,如果滤纸和漏斗的隔层和漏斗管里有气泡或者漏斗管口(斜面背后)没有贴紧烧杯壁,就会使过滤受到空气的阻力而减慢;(2)抽滤的关键在于控制水的流量,开始时如果水的流速过大,会使滤纸穿孔。


常见金属焰色反应颜色金属焰色反应是一种常见的化学现象,它是由于金属在高温下受热而发生的电子跃迁过程,从而导致金属离子的激发发光。
在实验室或者烟花表演中,我们可以通过观察金属在火焰中的颜色来推测金属的成分。
下面将介绍几种常见金属的焰色反应及其颜色。
1. 钠(Na)的焰色反应颜色为黄色。
钠是一种常见的碱金属,当钠盐溶解在火焰中时,火焰会呈现出明亮的黄色。
这是因为钠离子在高温下受热激发,电子跃迁从高能级到低能级时释放出黄光。
2. 钾(K)的焰色反应颜色为紫色。
钾也是一种碱金属,其焰色反应与钠类似,但颜色稍微偏向紫色。
这是因为钾离子的电子跃迁释放出的光波长较长,呈现出紫色。
3. 铜(Cu)的焰色反应颜色为绿色。
铜是一种过渡金属,其焰色反应较为特殊。
当铜盐溶解在火焰中时,火焰呈现出明亮的绿色。
这是因为铜离子的电子跃迁释放出的光波长对应着绿色。
4. 钙(Ca)的焰色反应颜色为橙色。
钙是一种碱土金属,其焰色反应呈现出橙色。
钙离子的电子跃迁释放出的光波长较长,对应着橙色。
5. 锂(Li)的焰色反应颜色为红色。
锂是一种碱金属,其焰色反应呈现出红色。
锂离子的电子跃迁释放出的光波长较长,对应着红色。
6. 铁(Fe)的焰色反应颜色为金黄色。
铁是一种过渡金属,其焰色反应呈现出金黄色。
这是因为铁离子的电子跃迁释放出的光波长对应着金黄色。
7. 锰(Mn)的焰色反应颜色为粉红色。
锰是一种过渡金属,其焰色反应呈现出粉红色。
锰离子的电子跃迁释放出的光波长较长,对应着粉红色。
8. 铅(Pb)的焰色反应颜色为蓝色。
铅是一种重金属,其焰色反应呈现出蓝色。
铅离子的电子跃迁释放出的光波长较短,对应着蓝色。
9. 锌(Zn)的焰色反应颜色为白色。
锌是一种过渡金属,其焰色反应呈现出白色。
这是因为锌离子的电子跃迁释放出的光波长较宽,覆盖了可见光谱的大部分区域,所以呈现出白色。
除了上述提到的金属,还有许多其他金属在高温下也会发生焰色反应,每种金属的焰色反应都有其独特的颜色。

各种金属焰色反应各种金属焰色反应概述金属焰色反应是指在高温下,金属原子被激发后,释放出特定的光谱线,形成不同颜色的火焰。
这种现象可以用来鉴别金属元素的存在。
实验方法实验中常用的方法是将待检测的金属离子盐溶解在酒精或其他易挥发液体中,再点燃溶液,观察火焰颜色。
各种金属焰色反应钠(Na)钠离子在火焰中呈黄色。
这是因为钠原子被激发后会释放出黄光谱线。
这个现象在日常生活中也可以看到,例如路灯和钠灯都会发出黄光。
钾(K)钾离子在火焰中呈紫色。
这是因为钾原子被激发后会释放出紫光谱线。
锂(Li)锂离子在火焰中呈红色。
这是因为锂原子被激发后会释放出红光谱线。
铜(Cu)铜离子在火焰中呈绿色。
这是因为铜原子被激发后会释放出绿光谱线。
这个现象也可以在古铜器上观察到,因为铜会被氧化形成一层绿色的氧化物。
钙(Ca)钙离子在火焰中呈橙红色。
这是因为钙原子被激发后会释放出橙红光谱线。
这个现象也可以在烟花中观察到,因为烟花中的颜料往往含有钙盐。
锶(Sr)锶离子在火焰中呈红色。
这是因为锶原子被激发后会释放出红光谱线。
锶盐常用于制作烟花和信号弹。
钡(Ba)钡离子在火焰中呈黄绿色。
这是因为钡原子被激发后会释放出黄绿光谱线。
钡盐常用于制作烟花和信号弹。
总结金属焰色反应是一种简单而有趣的实验方法,可以用来鉴别金属元素的存在。
不同金属元素的焰色反应具有不同的颜色,在实验和日常生活中都有广泛应用。
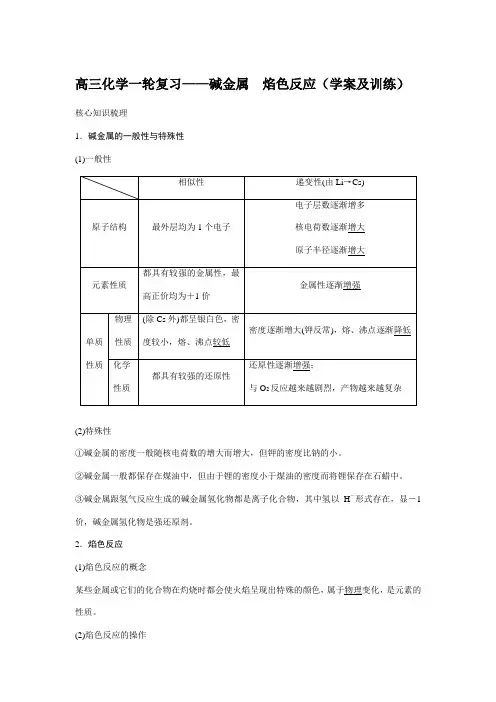
高三化学一轮复习——碱金属焰色反应(学案及训练)核心知识梳理1.碱金属的一般性与特殊性(1)一般性(2)特殊性①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。
2.焰色反应(1)焰色反应的概念某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,属于物理变化,是元素的性质。
(2)焰色反应的操作铂丝――→酒精灯灼烧无色――→蘸取待测物――→酒精灯灼烧观察火焰颜色――→用盐酸洗涤铂丝――→酒精灯灼烧无色 (3)常见元素的焰色钠元素黄色;钾元素紫色(透过蓝色钴玻璃观察);铜元素绿色;钡元素黄绿色;锶洋红色;锂元素紫红色;钙元素砖红色。
问题思考做焰色反应实验时,为什么用稀盐酸洗涤铂丝而不用稀硫酸?答案 铂丝在使用前要用稀盐酸将其表面物质洗净,然后在火焰上灼烧至无色,这是因为金属氯化物在灼烧时易挥发,若用稀H 2SO 4洗涤铂丝,由于硫酸盐的熔、沸点较高而难以挥发,会对后面实验造成干扰。
课堂练习1.正误判断,正确的打“√”,错误的打“×”(1)将镁条点燃后迅速伸入集满CO2的集气瓶中,集气瓶中产生浓烟并有黑色颗粒产生()(2019·全国卷Ⅱ,10B)(2)室温下Na与空气中O2反应制取Na2O2()(2019·江苏,6D)(3)电解熔融氯化镁可制取金属镁()(2018·浙江11月选考,8A)(4)金属钠着火时,可用细沙覆盖灭火()(2018·浙江11月选考,9B)(5)纯碱可用于去除物品表面的油污()(2018·浙江4月选考,6A)(6)二氧化碳可用作镁燃烧的灭火剂()(2018·浙江4月选考,6B)(7)实验室应将钠保存在煤油中()(2017·浙江4月选考,10A)(8)钠可以从四氯化钛中置换出钛()(2016·浙江4月选考,8D)(9)钠和钾的合金可用于快中子反应堆作热交换剂()(2015·浙江10月选考,19A)(10)某试样焰色反应呈黄色,则试样中含有K+()(2016·浙江4月选考,9A)(11)焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验()(2015·浙江10月选考,24B) (12)碳酸氢钠可用于治疗胃酸过多()(2017·浙江4月选考,6A)答案(1)√(2)×(3)√(4)√(5)√(6)×(7)√(8)√(9)√(10)×(11)√(12)√2.下列有关铯及其化合物的说法不正确的是()A.CsOH的碱性比KOH的强B.铯与水或稀盐酸反应剧烈,都生成H2C.Cs的还原性比Na的强,故Na+的氧化性强于Cs+D.Li的金属性比Cs的强答案 D解析根据元素周期律,Cs的金属性比K强,故CsOH的碱性比KOH强,A项正确;Cs 的性质与钠相似,Na能与水或稀盐酸反应产生H2,故Cs也能与水或稀盐酸反应产生H2,且反应更剧烈,B项正确;Cs的还原性强于Na,则Na+得电子能力比Cs+强,即氧化性:Na+>Cs+,C项正确;Li、Cs均为碱金属元素,Cs的电子层数多,更容易失去最外层电子,故金属性:Cs>Li,D项错误。

烟花中的五颜六色——焰色反应每当春节国庆的时候,人们喜欢放烟花来庆祝节日,让绚丽多彩的颜色布满夜空,而这些五彩缤纷,就是锂、钠、钾、锶、钡等金属所呈现的各种艳丽色彩。
这与高中化学中的焰色反应有关。
什么是焰色反应?焰色反应主要是根据某些金属或者它们的挥发性化合物在无色火焰中灼烧时会呈现出不同颜色的火焰,而对这些金属离子进行检验的一种化学实验方法,从而可以判断物质中是否含有这些金属或金属化合物。
当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色。
这就是焰色反应的原理,因此焰色反应不是化学反应,是物理变化。
在焰色反应实验中,不同金属或它们的化合物在灼烧时会放出多种不同波长的光,在肉眼能感知的可见光范围内,因不同光的波长不同,呈现的颜色也就存在差异。
像我们常见的焰色洋红色含有锶元素,蓝绿色含有铜元素,黄色含有钠元素,紫色含有钾元素,砖红色含有钙元素,黄绿色则含有钡元素等。
在实验室中,我们可以用铂丝(或铁丝、镍丝)、酒精灯(或煤气灯、本生灯、酒精喷灯)、稀盐酸、蓝色钴玻璃(检验钾时用),这些仪器进行焰色反应实验。
具体操作过程是:首先将铂丝蘸稀盐酸在无色火焰上灼烧至无色。
然后蘸取试样(固体也可以直接蘸取)在无色火焰上灼烧观察火焰颜色(若检验钾要透过蓝色钴玻璃观察,因为大多数情况下制钾时需要用到钠,因此钾离子溶液中常含有钠离子,而钠的焰色反应为黄色,黄色与少量的紫色无法分别出来)。
最后将铂丝再蘸稀盐酸灼烧至无色,就可以继续做新的实验了。


焰色反应颜色大全焰色反应是一种常见的化学实验现象,也是化学颜色分析的重要手段之一。
通过观察化合物在燃烧或加热时所产生的颜色,可以推断出化合物的成分和性质,这对于化学实验和分析有着重要的意义。
在化学实验中,我们经常会用到焰色反应来进行化学物质的鉴别和分析,下面就让我们来了解一下焰色反应的颜色大全。
1. 钠离子,在燃烧时,产生黄色的火焰。
2. 钾离子,在燃烧时,产生紫色的火焰。
3. 锶离子,在燃烧时,产生红色的火焰。
4. 钡离子,在燃烧时,产生绿色的火焰。
5. 铜离子,在燃烧时,产生蓝绿色的火焰。
6. 锰离子,在燃烧时,产生橙色的火焰。
7. 铋离子,在燃烧时,产生紫红色的火焰。
8. 铁离子,在燃烧时,产生金黄色的火焰。
9. 铬离子,在燃烧时,产生翠绿色的火焰。
10. 银离子,在燃烧时,产生白色的火焰。
以上就是焰色反应的颜色大全,通过观察和记忆这些颜色,我们可以在化学实验中快速鉴别化合物的成分,为化学分析和实验提供便利。
同时,焰色反应也是一种直观的化学现象,能够吸引学生的兴趣,促进他们对化学知识的学习和理解。
除了以上列举的常见离子的焰色反应颜色外,还有许多其他化合物在燃烧时会产生特定的颜色,这些颜色的产生与化合物的成分和结构密切相关。
因此,通过观察焰色反应的颜色,我们可以深入了解化合物的性质和结构,这对于化学研究和应用都具有重要的意义。
总之,焰色反应是一种重要的化学实验现象,通过观察化合物在燃烧时产生的颜色,可以推断出化合物的成分和性质。
掌握焰色反应的颜色大全,有助于我们在化学实验和分析中准确鉴别化合物,促进化学知识的学习和应用。
希望本文能够帮助大家更好地理解焰色反应的颜色规律,提高化学实验和分析的技能水平。


——碱金属元素焰色反应【核心透析】1.碱金属(1)碱金属的一般性质:(2)碱金属的特殊性质:①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属可与H2发生反应生成RH(R代表碱金属),属于离子化合物,H元素显-1价,碱金属氢化物是强还原剂。
如NaH+H2O===NaOH +H2↑,NaH是还原剂,H2O是氧化剂,氧化产物为H2,还原产物为H2。
2.焰色反应(1)概念某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,其属于物理变化,属于元素的性质。
(2)操作步骤(3)应用①用于检测某种金属元素是否存在。
熟记:钠元素黄色,钾元素紫色(透过蓝色钴玻璃观察)②添加到烟花中,使焰火更加绚丽多彩。
1.焰色反应是物理变化,是金属元素的性质,既可以是单质,也可以是化合物,如不论灼烧Na2CO3、NaCl、Na2SO4还是钠的单质,均发出黄色火焰。
2.铂丝用稀盐酸清洗,不能用稀硫酸代替,因为金属氯化物在高温下易挥发,而硫酸盐比较困难。
3.焰色反应中所用的火焰应是无色或浅色,且所用铂丝可用无锈的铁丝代替,不能用有焰色反应的铜丝代替。
4.碱金属常从以下几个方面设问题(1)碱金属单质与水(或酸)反应的现象;(2)碱金属单质的保存(注意碱金属的密度);(3)碱金属单质与氧气反应产物的判断;(4)碱金属对应的氢氧化物碱性强弱的比较;(5)碱金属的碳酸盐性质的比较;(6)与最新的科学技术相关的碱金属的应用。
【核心训练】1.金属活动性顺序表中K在Na的前面,K与Na在性质上具有很大的相似性。
下面是根据Na的性质对K的性质的预测,其中不正确的是( C )A.K可以被空气中的O2氧化B.K可以与乙醇发生反应生成H2C.K与水的反应不如Na与水的反应剧烈D.K也可放在煤油中保存解析:金属活动性顺序表中K在Na的前面,K比Na活泼,故K 在空气中可以被O2氧化,A正确;Na与乙醇反应放出H2,K也能与乙醇反应放出H2,B正确;K与水的反应比Na与水的反应剧烈,C错误;Na、K均可放在煤油中保存,D正确。

金属的焰色反应的颜色
金属的焰色反应,是指将金属样品放入火焰中加热,观察其放出的颜色。
这种反应可以用于鉴定金属元素的存在和浓度,也被广泛应用于化学分析、冶金工业、矿物勘探等领域。
金属的焰色反应的颜色主要来自于电子跃迁所产生的能量差。
当金属样品被加热时,其原子吸收了足够的能量,使得其中一些电子跃迁到较高能级。
当这些电子重新回到低能级时,会放出一定能量的光子,形成特定的颜色。
不同金属元素产生的焰色反应颜色是不同的。
下面分别介绍几种常见金属元素的焰色反应颜色:
钠(Na):产生黄色火苗
钾(K):产生紫色火苗
锂(Li):产生红色火苗
铁(Fe):产生橙黄色火苗
铜(Cu):产生蓝绿色火苗
镁(Mg):产生亮白色火苗
除了上述常见金属元素外,还有许多其他元素也具有独特的焰色反应颜色,如锶(Sr)产生红色火苗、钡(Ba)产生黄绿色火苗等。
需要注意的是,金属的焰色反应颜色不仅与元素种类相关,还与其浓度、加热温度等因素有关。
因此,在进行金属的焰色反应时,需要控制好样品的浓度和加热条件,以保证结果的准确性。
总之,金属的焰色反应是一种简单而有效的分析方法,可以用于鉴定金属元素的存在和浓度。
通过观察不同金属元素产生的颜色,我们可以更深入地了解元素之间的相互作用和化学特性。
焰色反应的原因
当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。
而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色。
但由于碱金属的原子结构不同,电子跃迁时能量的变化就不相同,就发出不同波长的光,,从焰色反应的实验里所看到的特殊焰色,就是光谱谱线的颜色.每种元素的光谱都有一些特征谱线,发出特征的颜色而使火焰着色,根据焰色可以判断某种元素的存在.如焰色洋红色含有锶元素,焰色玉绿色含有铜元素,焰色黄色含有钠元素等。
——文章来源网,仅供分享学习参考~ 1 ~。
常见的焰色反应颜色
焰色反应是一种常见的化学分析方法,利用化合物在高温下的燃烧产生的颜色来判断其成分。
不同的元素在燃烧时会产生不同的颜色,因此可以通过观察燃烧产生的颜色来确定样品中含有哪些元素。
下面是常见的焰色反应颜色:
1. 钠:黄色
钠化合物在燃烧时会产生明亮的黄色火焰,这是因为钠的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生黄色光线。
2. 钾:紫色
钾化合物在燃烧时会产生紫色火焰,这是因为钾的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生紫色光线。
3. 锂:红色
锂化合物在燃烧时会产生红色火焰,这是因为锂的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生红色光线。
4. 钙:橙色
钙化合物在燃烧时会产生橙色火焰,这是因为钙的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生橙色光线。
5. 镁:白色
镁化合物在燃烧时会产生白色火焰,这是因为镁的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生白色光线。
6. 铜:绿色
铜化合物在燃烧时会产生绿色火焰,这是因为铜的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生绿色光线。
7. 锰:紫红色
锰化合物在燃烧时会产生紫红色火焰,这是因为锰的电子在高温下被激发,跃迁到高能级的轨道上,然后再回到低能级轨道时释放出能量,产生紫红色光线。
总之,焰色反应是一种简单而有效的化学分析方法,可以用来确定样品中含有哪
些元素。
考点22 碱金属元素焰色反应聚焦与凝萃1.掌握碱金属元素在结构及性质方面的递变规律及特性;2.了解焰色反应的概念及操作。
解读与打通常规考点一、碱金属元素1、原子结构(1)相似性:最外层均为1个电子,易失去一个电子。
(2)递变性:核电荷数依次增多,电子层数依次增多,原子半径依次增大,失电子能力依次增强,活泼程度增强。
2、元素性质(1)相似性:均为活泼金属元素,最高正价均为+1价。
(2)递变性:失电子能力依次增强,金属性依次增强。
3、单质性质(1)相似性:均具强还原性,均具轻、软、易熔的特点。
(2)递变性:还原性依次增强,密度趋向增大,熔沸点依次降低(原因,可与卤素对比),硬度趋向减小。
4、化合物性质(1)相似性:氢氧化物均为强碱。
(2)递变性:氢氧化物的碱性依次增强。
5、碱金属的性质规律与特例(1)通常合金多呈固态,而钠钾合金却是液态。
(2)碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
(3)碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
(4)碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
(5)碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
(6)碱金属的盐一般都易溶于水,但Li2CO3却微溶。
(7)一般说,酸式盐较正盐溶解度大,但NaHCO 3却比Na 2CO 3溶解度小。
(8)试剂瓶中的药品取出后,一般不能放回原瓶,但IA 金属Na 、K 等除外。
(9)一般活泼金属能从盐中置换出不活泼金属,但对IA 非常活泼的金属Na 、K 等除外。
如:2Na+CuSO 4+2H 2O=Cu(OH)2↓+H 2↑+Na 2SO 4。
(10)Fr 是放射性元素,所以在自然界中不存在。
二、焰色反应1.概念:某些金属或它们的化合物在灼烧时使火焰呈现出特殊的颜色,这种现象化学上叫做焰色反应。
2.操作铂丝无色 待测物 观察火焰颜色 铂丝无色。
考点22 碱金属元素焰色反响聚焦与凝萃1.掌握碱金属元素在构造及性质方面递变规律及特性;2.了解焰色反响概念及操作。
解读与打通常规考点一、碱金属元素1、原子构造〔1〕相似性:最外层均为1个电子,易失去一个电子。
〔2〕递变性:核电荷数依次增多,电子层数依次增多,原子半径依次增大,失电子能力依次增强,活泼程度增强。
2、元素性质〔1〕相似性:均为活泼金属元素,最高正价均为+1价。
〔2〕递变性:失电子能力依次增强,金属性依次增强。
3、单质性质〔1〕相似性:均具强复原性,均具轻、软、易熔特点。
〔2〕递变性:复原性依次增强,密度趋向增大,熔沸点依次降低〔原因,可与卤素比照〕,硬度趋向减小。
4、化合物性质〔1〕相似性:氢氧化物均为强碱。
〔2〕递变性:氢氧化物碱性依次增强。
5、碱金属性质规律与特例〔1〕通常合金多呈固态,而钠钾合金却是液态。
〔2〕碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂氧化物,而Li 只生成Li 2O 。
〔3〕碱金属单质密度一般随核电荷数增大而递增,但K 密度比Na 小。
〔4〕碱金属单质一般跟水剧烈反响,但Li 跟水反响缓慢〔LiOH 溶解度小〕。
〔5〕碱金属单质因其活动性强,多保存在煤油中,而Li 却因密度比煤油更小,只能保存在液体石蜡中。
〔6〕碱金属盐一般都易溶于水,但Li 2CO 3却微溶。
〔7〕一般说,酸式盐较正盐溶解度大,但NaHCO 3却比Na 2CO 3溶解度小。
〔8〕试剂瓶中药品取出后,一般不能放回原瓶,但IA 金属Na 、K 等除外。
〔9〕一般活泼金属能从盐中置换出不活泼金属,但对IA 非常活泼金属Na 、K 等除外。
如:2Na+CuSO 4+2H 2O=Cu(OH)2↓+H 2↑+Na 2SO 4。
〔10〕Fr 是放射性元素,所以在自然界中不存在。
二、焰色反响1.概念:某些金属或它们化合物在灼烧时使火焰呈现出特殊颜色,这种现象化学上叫做焰色反响。
2.操作铂丝 无色 待测物 观察火焰颜色铂丝 无色。