分子空间构型1
- 格式:ppt
- 大小:4.50 MB
- 文档页数:88


高中化学空间构型公式总结
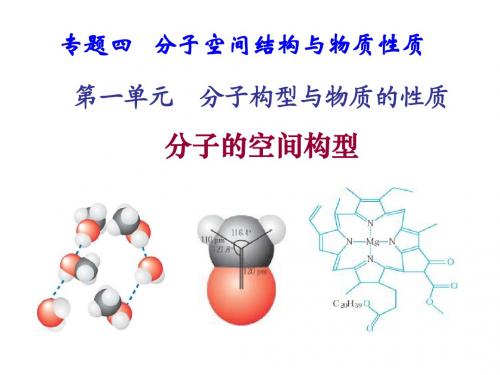
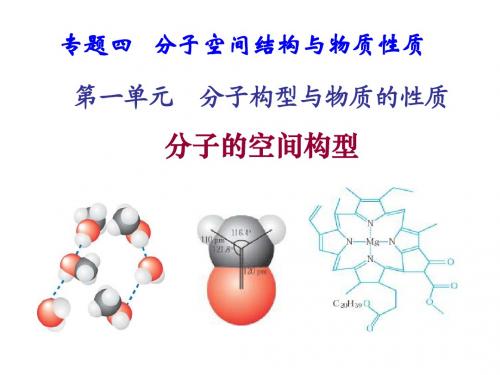
在化学中,分子的空间构型是指分子中原子相对位置的排列方式,它直接影响到分子的化学性质。
因此,空间构型的研究对于理解分子的性质和反应具有重要意义。
在高中化学中,我们需要掌握各种分子的空间构型公式,下面是一些常见的空间构型公式总结。
1. 线性构型
线性构型是指分子中原子在一条直线上排列,例如CO2。
其公式为AX2,其中A代表中心原子,X代表外周原子。
因为该构型对称性好,分子极性为0,不具有偶极矩。
2. 三角形平面构型
三角形平面构型是指分子中原子在一个平面内呈三角形排列,例如BF3。
其公式为AX3。
因为该构型对称性好,分子极性为0,不具有偶极矩。
3. 四面体构型
四面体构型是指分子中原子在一个四面体内排列,例如CH4。
其公式为AX4。
因为该构型对称性好,分子极性为0,不具有偶极矩。
4. 三角形锥构型
三角形锥构型是指分子中原子在一个三角形底面上,另有一个原子在其上方排列,例如NH3。
其公式为AX3E。
因为该构型不对称,分子极性不为0,具有偶极矩。
5. 正方形平面构型
正方形平面构型是指分子中原子在一个平面内呈正方形排列,例如SF4。
其公式为AX4E。
因为该构型不对称,分子极性不为0,具有偶极矩。
总之,掌握各种分子的空间构型公式对于高中化学学习和考试都非常重要,希望以上内容能够帮助大家更好地理解和掌握化学知识。

化学分子的空间构型在化学领域中,分子的空间构型是指分子中各原子的相对排列方式和空间结构。
分子的空间构型对于分子的性质和反应方式起着重要的影响。
本文将探讨化学分子的空间构型及其影响因素。
一、分子的空间构型概述分子的空间构型包括分子的立体结构和键角(键长和键角度)的排列方式。
分子的立体结构决定了分子的三维形状,而键角则决定了分子中原子的相对位置。
分子的空间构型由化学键的性质和原子间相互作用力所决定。
二、空间构型的影响因素1. 化学键类型:分子中的化学键类型不同,对应的空间构型也会有所不同。
例如,碳原子之间的单键使得分子呈现出线性构型,而双键或三键则会使分子呈现出非线性的形状。
2. 原子尺寸:原子的尺寸决定了分子中原子之间的距离,从而影响分子的空间构型。
较大的原子会使得分子呈现出较离散的构型,而较小的原子则有助于分子形成更紧凑的结构。
3. 电子云的排斥和吸引力:分子中的电子云具有互相排斥的作用,导致分子呈现出一定的空间构型。
同时,电子云也可以被相邻原子的核吸引,从而使分子形成更稳定的构型。
4. 手性性质:手性分子是一种具有非对称的空间构型的分子。
它们的空间构型决定了它们的立体异构体是否对映。
手性分子的手性性质对于化学反应的选择性和生物活性具有重要影响。
三、分子空间构型的应用与研究分子空间构型的研究不仅对于理解物质的性质和反应机理具有重要意义,还广泛应用于以下领域:1. 新药研发:分子的空间构型对于药物的生物活性和效果起着至关重要的作用。
通过研究分子的空间构型,可以设计出更具选择性和效果的药物。
2. 光电器件:分子的空间构型决定了分子的光学和电学性质,对于光电器件的设计与性能提升有着重要影响。
3. 催化剂设计:催化剂的活性和选择性与其空间构型密切相关。
研究催化剂的空间构型有助于设计高效和选择性的催化剂。
4. 有机合成:有机合成中,分子的空间构型决定了反应的发生性和选择性。
研究分子的空间构型有助于有效设计合成路线和合成新的化合物。

高中化学分子立体结构知识点讲解高中化学对于大多数同学来说都是一门难学的功课。
不仅化学方程式需要记忆,还要记忆各种化学物质的性质及化学反应现象,更别说计算了。
一、常见分子的空间构型1.双原子分子都是直线形,如:HCl、NO、O2、N2等。
2.三原子分子有直线形,如CO2、CS2等;还有“V”形,如H2O、H2S、SO2等。
3.四原子分子有平面三角形,如BF3、BCl3、CH2O等;有三角锥形,如NH3、PH3等;也有正四面体,如P4。
4.五原子分子有正四面体,如CH4、CCl4等,也有不规则四面体,如CH3Cl、CH2Cl2、CHCl3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥模型1.理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2.价电子对之间的斥力(1)电子对之间的夹角越小,排斥力越大。
(2)由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间斥力大小如下:孤电子对-孤电子对>孤电子对-成键电子>成键电子-成键电子(3)由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键。
3.价层电子对互斥模型的两种类型价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
(1)当中心原子无孤对电子时,两者的构型一致;(2)当中心原子有孤对电子时,两者的构型不一致。
4.用价层电子对互斥理论推断分子或离子的空间构型具体步骤:(1)确定中心原子A价层电子对数目中心原子A的价电子数与配体X提供共用的电子数之和的一半,即中心原子A价层电子对数目。
计算时注意:氧族元素原子作为配位原子时,可认为不提供电子,但作中心原子时可认为它提供所有的6个价电子。