冠醚与氨基脲的合成
- 格式:docx
- 大小:14.55 KB
- 文档页数:3

Schiff碱双冠醚及其多核配合物的合成和表征Schiff碱双冠醚及其多核配合物的合成和表征一、实验目的本实验旨在合成Schiff碱双冠醚及其多核配合物,并对其进行表征。
二、实验原理Schiff碱是一种含有碳-氮双键的有机化合物,其份子中通常含有一个或者多个氮原子,可以通过其与金属离子形成配合物。
Schiff碱双冠醚是通过将两个Schiff碱份子通过双醛桥连接在一起形成的一种双核配合物。
通过更换Schiff碱和桥连接的方式,可以合成具有不同结构和功能的多核配合物。
本实验中使用2,6-二贴脲基-4-甲基苯醛和1,2-丙二胺为前体合成Schiff碱双冠醚,并将其与金属离子Cu(II)、Ni(II)形成多核配合物。
三、实验步骤1. 合成Schiff碱双冠醚将2,6-二贴脲基-4-甲基苯醛和1,2-丙二胺按1:2的比例混合,并加入足量的乙醇溶液进行搅拌反应,反应温度控制在50℃下,即可得到Schiff碱双冠醚。
产物通过过滤、洗涤、干燥等步骤纯化。
2. 合成多核配合物将合成的Schiff碱双冠醚和金属离子Cu(II)、Ni(II)按1:1的比例混合,并加入足量的乙醇溶液,在常温下搅拌反应数小时,得到多核配合物。
产物通过过滤、洗涤、干燥等步骤纯化。
3. 表征使用红外光谱、元素分析、热重分析等方法对合成的Schiff碱双冠醚及其多核配合物进行表征。
四、实验结果1. 合成Schiff碱双冠醚产物为黄色固体粉末,产率为80%。
红外光谱表明产物中有N-H 和C=N的伸缩振动峰,元素分析结果表明C、H、N元素的含量符合产物理论值。
2. 合成多核配合物产物为固体,颜色与金属离子不同,经红外光谱表明配合物中产生新的振动峰,证明了Schiff碱与金属离子的配位反应。
3. 表征结果红外光谱:Schiff碱双冠醚的吸收峰分别为3296.25 cm-1(N-H),1651.79 cm-1(C=N);多核配合物的吸收峰分别为3310.15 cm-1(N-H),1697.09 cm-1(C=N);元素分析:Schiff碱双冠醚的理论值C 57.89%、H 4.96%、N14.47%,实验值C57.90%、H4.98%、N14.51%;多核配合物的理论值C 46.15%、H 4.61%、N10.77%,实验值C46.18%、H4.63%、N10.81%;热重分析:Schiff碱双冠醚的热分解峰为155℃,多核配合物的热分解峰为180℃。

冠醚基团取代的细胞分裂素类似物的合成及其
性质
细胞分裂素(Cytokines)是一类具有多种功能的分子,它们可以调节细胞增殖、移动和修复。
随着人们越来越了解细胞分裂素的作用,细胞分裂素类似物的研究受到了越来越多的关注。
呋喃并兴烯醚(furanoidcyclopentenone,FCP)是一种新型细胞分裂因子类似物,通过氢键取代玉米细胞分裂因子(maize cytokinine,MCK)而获得新的生物活性。
呋喃并兴烯醚类似物的合成可以从三个主要步骤开始:(1)取代反应;(2)涤尔环断裂反应;(3)氯氢化反应。
首先,氢键取代玉米细胞分裂因子,然后将活性组分介入吡咯并异丁烯环中,最后将吡咯和异丁烯环上的氯原子用氢氧化钠反应加以保护,以确保该取代物的稳定性。
此外,该合成的目的是生产细胞活力剂成分,因此研究人员在实验室中进行了多项研究,以检验呋喃并兴烯醚类似物的生物活性。
由于研究人员发现该物质具有良好的细胞刺激和细胞修复活性,其临床用途受到了极大的关注。
此外,研究发现该物质可用于治疗肝脏疾病、肌营养不良等,一些临床试验也已展开,获得了有益的结果。
由此可见,通过氢键取代玉米细胞分裂因子,研究人员合成了一种新型细胞分裂素类似物,即呋喃并兴烯醚类似物,该取代
物具有良好的细胞刺激和修复性,可用于治疗肝脏疾病、肌营养不良等疾病,一些临床试验也已展开,起到了良好的治疗效果。

醚化氨基树脂工艺配方的优化1前言氨基树脂是以三聚氰胺、双氰胺、尿素等含有氨基的单体为主要原料,与甲醛反应缩聚而成的大分子聚合物,因具有优良的固化性,突出的涂膜性能,适中的成本和理想的贮存稳定性已广泛用于涂料工业中。
氨基树脂根据采用的氨基化合物的不同可分为4类:脲醛树脂、三聚氰胺树脂、苯代三聚氰胺树脂、共聚树脂,而以三聚氰胺甲醛树脂应用最广,性能最好。
醚化是合成氨基树脂工艺中的关键步骤之一,常用的醚化剂有甲醇、正丁醇、异丁醇混合醇醚化的氨基树脂也逐渐增多,但丁醇类作醚化剂合成氨基树脂仍占主导地位。
本实验以三聚氰胺、甲醛为原料,对异丁醇作醚化剂合成氨基树脂的工艺条件和配方进行优化,合成出适合的聚合度和醚化度的氨基树脂,并取得了比较满意的效果。
2实验原理氨基树脂的合成反应主要有 2 步:(1)羟甲基化反应:三聚氰胺与甲醛在弱碱性条件下反应生成含羟甲基数不等的溶于水的混合物;(2)醚化反应:即在弱酸性条件下,羟甲基化合物与醇类反应,改进分子极性生成疏水性的物质,形成新的烷氧基。
主反应如下:3反应条件的研究3.1羟化反应时间对树脂性能的影响羟甲基化反应是氨基树脂二步法合成的第一步,三聚氰胺与甲醛生成羟甲基化的三聚氰胺,羟化时间对树脂性能的影响见表1,由表1可以看出:反应时间过短,生成的羟基数太少,不利于后续醚化反应的进行,容忍度过低,羟化反应时间以2.5 h为宜,此时容忍度较合适。
容忍度高表示该树脂与大多数成膜树脂的混溶性好,在有催化剂和无催化剂的体系中稳定性都好,施工固体份较高,漆膜性能如柔韧性、冲击强度、光泽、附着力都较好,但其交联速度慢。
容忍度低的树脂交联速度较快,硬度、耐溶剂、洗涤剂及防腐性较好。
表1 羟化时间对树脂性能的影响3.2醚化反应时间对树脂性能的影响醚化反应时间对树脂性能的影响见表 2。
由表 2可以看出:虽然醚化时间1.5 h时最后水分合格,但分水情况不好,可能是树脂的醚化度低;而当反应 3h 时,分水时沉底,因此醚化时间选择 2 h 较合适。

冠醚和有机胺盐反应引言:冠醚是一类重要的有机化合物,由于其特殊的环状结构和独特的物化性质,广泛应用于化学、生物医药等领域。
而有机胺盐则是一类含有胺基的盐类化合物。
冠醚和有机胺盐之间的反应具有重要的研究价值和应用前景。
本文将详细介绍冠醚和有机胺盐反应的机理、条件以及可能的应用。
一、反应机理冠醚和有机胺盐反应的机理主要涉及冠醚分子与有机胺阳离子之间的相互作用。
冠醚分子中的冠环结构具有较强的配位能力,能够与有机胺阳离子形成稳定的配合物。
这种配合物形成后,可以发生一系列化学反应,包括亲核取代、质子转移等。
反应机理的详细研究有助于揭示冠醚和有机胺盐反应的规律和特点。
二、反应条件冠醚和有机胺盐反应的条件主要包括反应温度、溶剂选择、反应时间等。
一般情况下,反应温度较低时,冠醚和有机胺盐的反应速率较慢,反应不完全;而较高温度下,反应速率较快,但可能伴随着副反应的发生。
溶剂的选择也对反应结果有显著影响,合适的溶剂可以提高反应的选择性和收率。
此外,反应时间的控制也是关键,过长或过短的反应时间都可能导致反应效果不理想。
三、反应应用冠醚和有机胺盐反应在化学合成、分离纯化、生物医药等领域具有广泛应用。
首先,冠醚和有机胺盐反应可以用于有机合成中的功能化修饰。
通过选择不同的冠醚和有机胺盐,可以实现对目标化合物的特定官能团的引入或修饰,从而获得具有特殊性质或功能的有机化合物。
其次,冠醚和有机胺盐反应还可以用于分离纯化技术中的离子交换。
冠醚分子的配位能力使其能够与特定离子形成稳定的络合物,从而实现对离子的选择性吸附和分离。
此外,冠醚和有机胺盐反应还在生物医药领域具有潜在应用价值。
冠醚分子与有机胺盐的反应可以用于药物的控释系统、荧光探针的设计等方面,为药物设计和生物医学研究提供新的思路和方法。
结论:冠醚和有机胺盐反应是一种重要的化学反应,具有广泛的应用前景。
通过研究其反应机理,选择合适的反应条件,可以实现对目标化合物的功能化修饰、离子的选择性吸附和分离,以及药物的控释等应用。


冠醚与氨基脲的合成冠醚和氨基脲都是有着广泛应用的有机化合物。
它们的合成方法有很多种,其中较为常见的是基于有机化学反应学原理的化学合成法。
下面,我们将详细介绍冠醚和氨基脲的合成方法。
一、冠醚的合成冠醚是一类环状醚化合物,具有很强的配位性和选择性,被广泛应用于化学分离、传感器等方面。
冠醚分子的合成常常涉及到到手性控制、形式选择和高效的反应路线。
1、亚甲基化反应法亚甲基化反应法是合成环状冠醚的经典化学反应。
该反应的原理是在醚化反应中通常用一定量的甲醛作为源,通过甲基化反应进行环形化。
这种方法的优势在于反应条件温和,生成的产物通常具有较高的产率和较好的纯度。
常见的亚甲基化反应法包括醛缩反应、柴速定反应和费希尔克拉夫特反应等。
2、氧化环合法氧化环合法是利用氧化剂进行环形化的一种化学合成方法。
该反应的原理是将含有不饱和结构的原料与氧化剂反应,引发剧烈的环化反应。
这种方法的优势在于反应速度较快,产物的结构和形式多样,具有一定的反应功能。
常见的氧化环合法包括鲍耐特氧化反应、康斯热叶-瓦尔撕曼环化、板垣环合反应等。
3、链延拓法链延拓法是一种将较短链延长成较长链的化学方法。
其原理是在短链上通常含有较活跃的功能基团,通过化学反应在链上加入更多的基团生成长链。
这种方法的优势在于能够保持较高的产率和高的反应选择性,适用于合成长链冠醚。
常见的链延拓法包括克氏反应、桂林O反应和酰氨置换反应等。
二、氨基脲的合成氨基脲是一种广泛应用于工业生产、农业和医学领域的化合物。
氨基脲的合成方法较为简单,基本上都能通过反应的方法得到。
1、氨气转化合成法氨气转化合成法是一种利用氨气作为原料的化学合成方法。
其原理是将氨气转化成尿素(发生氨化作用),再通过加热氢氧化钠(NaOH)进行水解反应,得到氨基脲。
这种方法的优势在于反应步骤简单,只需要少量的原料即可获得高产率的产物。
常见的氨气转化合成法包括固氮法和氨气化学合成法等。
2、尿素降解法尿素降解法是一种将尿素分解成氨基脲的化学方法。

万方数据776有机化学、7b1.28.20081含杂原子的簇类金属冠醚最早的金属冠醚是以水杨羟肟酸为配体与金属离子配位形成的以[M.N一0】。
为重复单元的环状结构配合物【1'21.1996年Gibney等‘31报道了锰的[12一MC一4】(MC,金属冠醚)型金属冠醚与碱金属盐配合物的结构,并对配合物的晶体结构及其在溶液中的性质进行了研究,得到了金属冠醚与Li+的1:1配合物5和与Na+的2:1配合物6(图2),研究了溶液中金属冠醚与阴阳离子的作用.随后人们又用羟肟酸或酮肟酸衍生物和一些有机小分子作为配体合成了一系列锰、铁、镍、钼的【12.MC-4】,【12一MC一6】,【18-MC一6】,【18.MC一8】,[36一MC.12】型金属冠状化合物【4 ̄171.有趣的是当向以氨基酸的羟肟酸衍生物为配体合成的铜【12一Mc.4】中加入Ln"或u02+离子时,铜的【12一MC一4】转变为稳定的【15.MC.5】(Eq.1)¨8'l91.而以吡啶取代的羟肟酸衍生物和金属离子(Ni,Cu)反应得到的【15一MC一5】对某些金属离子【如Pd(II),Hg(Ⅱ),Ag(I),N“I)等】表现出一定的识别作用‘20·211.图2配合物5和6的x射线单晶衍射图I匐glIre2ORl'EPdiagramsofcomplexes5and62001年刘世雄m1以水杨酸衍生物合成了第一个锰【30一MC.10】型化合物7之后,又有许多锰、镍、铜、攮-,镧系元素等【12.MC4】,【15.MC一5】,【18.MC.6】,【22.MC一8】化合物相继被合成‘23~281.2003年Kessissoglou等‘29-301又用二吡啶酮肟在甲醇溶液中和高氯酸锰反应得到了【24.MC.8】型化合物8,随后又报道了包含有C10;阴离子的铜【18.MC.6】金属冠醚9.2006年Ji等【3卜”】合成的锰【18.MC.6】表现出一定的生物活性,对杆状菌和葡萄球菌等有良好的抗菌性.2007年Pecoraro【36】制备了含有Ho(III)离子和Mn(Ⅱ)的【22一MC.8】金属冠醚10并研究了它们的磁性(图3).1996年S龃lfhIll(『371报道了第一个金属冠醚夹心配合物1l(图4),它是通过口片呐醇、二水合氯化铜、氨离子和氢氧化钾在甲醇中反应得到的.它们的晶体结构表明其中存在两个相同中性的15.三金属冠一6平台,氨离子处在两个平台之间。

氨基脲的合成
氨基脲是一种重要的有机化合物,广泛应用于农药、医药、染料等行业。
它的合成方法有多种,其中最常见的是从尿素和液氨出发。
1. 原料
尿素(CO(NH2)2)
液氨(NH3溶液)
2. 反应方程式
CO(NH2)2 + 2NH3 → NH2CONHNH2 + H2O
3. 反应条件
反应温度控制在130-150°C,压力为10-20atm。
需要在密闭的不锈钢反应釜中进行,并搅拌均匀。
4. 反应机理
该反应是亲核加成反应。
首先液氨作为亲核试剂攻击尿素的羰基碳,形成中间体。
然后另一分子液氨进攻中间体,开环重排形成氨基脲。
5. 分离提纯
反应结束后,冷却至室温,放出过量氨气。
将混合物过滤,得到粗氨基脲。
经重结晶或回流提纯,即可获得纯品。
6. 注意事项
该反应为可逆反应,需控制好温度和压力。
液氨具有腐蚀性和毒性,操
作时要小心。
产品氨基脲也有一定毒性,使用时需注意安全。
氨基脲的合成是一个典型的亲核加成反应,工艺路线成熟,但需要严格控制反应条件,确保产品质量和安全生产。

综述-冠醚的合成与应⽤冠醚的合成与应⽤⼀、冠醚简介冠醚是⼀类含有醚基的杂环化合物的总称,⼜被称为⼤环醚”。
在有机化学中冠醚被定义为:⼀类含有多个氧原⼦的⼤环化合物的总称。
冠醚的基本单元为亚⼄氧基(―CH 2CH 2O —),该结构单元若被重复两次就可以得到最简单的冠醚,⼀种⼆氧六环的环状低聚物。
重复四次则为12-冠-4,依次类推,⽬前世界上已经有上万种的冠醚化化合物,其中最为常见的冠醚为 15-冠-5、18-冠-6。
冠醚有⼀定的毒性,必须避免吸⼊其蒸⽓或与⽪肤接触。
⼆、冠醚的发现1967年,Pedersen 1】⾸次报道了⼀类新的化合物 --冠醚,同时他还发现冠醚能与⾦属形成稳定的络合物,此后冠醚化合物的特殊性质便引起了⼈们极⼤的研究兴趣。
美国化学家 Cram 和法国化学家 Lehn 从各个⾓度对冠醚进⾏了研究,Lehn ⾸次合成了⽳醚 2。
为此,Pedersen Cram 和Lehn 共同获得了 1987年诺贝尔化学奖。
三、冠醚的合成1简单冠醚的制备1.1威廉森合成法制取18-冠-6 :该反应的实质为⼀个取代反应,⼆氯三亚⼄基⼆醚脱掉氯原⼦三⽢醇羟基脱去氢原⼦形成⼤环化合物Scheme 1威廉森合成法制取 18-冠-61.2⼆苯并-18-冠-6的合成:Pedersen 等⽤邻⼆苯酚在⼆氯⼄基醚⼆甲亚砜的溶剂中以氢氧化钾为催化剂,合成⼆苯并-18-冠-64。
(Scheme 2)3。
(Scheme 1)KOH.四氢咲哺溶剂#呱 40%-Scheme 2⼆苯并-18-冠-6的合成2 N-取代氮杂冠醚的合成2.1成环反应:成环反应是合成N-取代氮杂冠醚的常⽤⽅法,即利⽤⾼度稀释法或模板离⼦的作⽤5,6,将N-取代伯胺进⾏⼆次N-烷基化。
(Scheme 3) Scheme 3通过N-取代⼆⼄醇胺及其类似物与⼆卤代多⽢醇7或多⽢醇⼆对甲苯磺酸酯8进⾏0-烷基化反应缩合成环也可以得到N-取代氮杂冠醚。
(Scheme 4)A H⼧1 i__\ /—尺⼀⼘* TSQ a oa R - CH^OCH^CH^b R=TsNHCH2CH aScheme 42.2氮杂冠醚的N-取代反应:Bogatsky等9则按如下路线合成了⼀系列N-⽀套索冠醚。

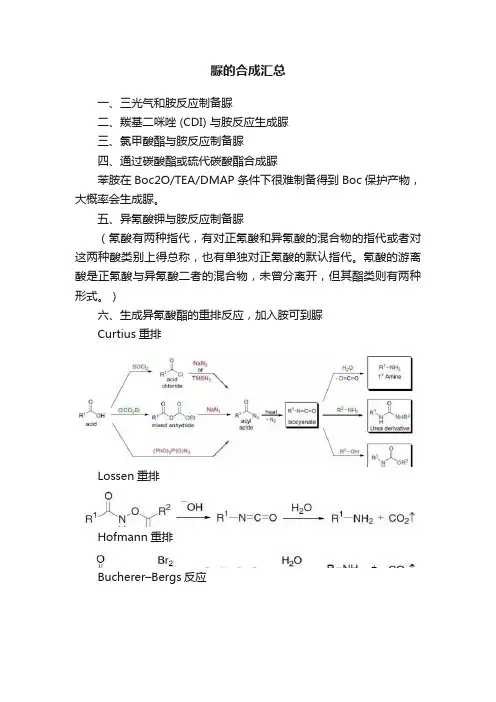
脲的合成汇总一、三光气和胺反应制备脲二、羰基二咪唑 (CDI) 与胺反应生成脲三、氯甲酸酯与胺反应制备脲四、通过碳酸酯或硫代碳酸酯合成脲苯胺在Boc2O/TEA/DMAP条件下很难制备得到Boc保护产物,大概率会生成脲。
五、异氰酸钾与胺反应制备脲(氰酸有两种指代,有对正氰酸和异氰酸的混合物的指代或者对这两种酸类别上得总称,也有单独对正氰酸的默认指代。
氰酸的游离酸是正氰酸与异氰酸二者的混合物,未曾分离开,但其酯类则有两种形式。
)六、生成异氰酸酯的重排反应,加入胺可到脲Curtius重排Lossen重排Hofmann重排Bucherer–Bergs反应由羰基化合物、氰化钾(KCN)和碳酸铵[(NH4)2CO3]或者氰醇和碳酸铵制备乙内酰脲的反应被称为Bucherer–Bergs反应。
七、【Labnetwork】脲合成方法小结通过硫脲合成脲有时候我们也会通过各种氧化方法由硫脲合成脲,如双氧水,NaIO4,HgO,氯乙酸等。
实例:由硫脲合成脲Sulfonythiourea(470 mg, 1 mmol) was dissolved in 1 N NaOH(3 mL) and hydrogen peroxide (0.6 mL, 30%) was added. After 1h stirring at room temperature the mixture was acidified with 2 N HCl and the precipitate filtered off and dried to give thetile compound (420 mg, 92% yield) as colorless solid.【Heinrich C. Englertetc J. Med. Chem. 2001, 44, 1085-1098】通过直接加热或铜催化对伯胺进行转酰胺基合成脲在有些情况下,我们也会通过伯脲与胺在加热下进行胺交换来合成需要的脲。
冠醚配合物及其应用自从1967年Pedersen 首先合成了一系列冠醚化合物以来,各国化学家对于冠醚的合成、性质和应用做了许多工作。
这类配位体广泛地应用于碱金属、碱土金属和镧系元素金属的配位化学基础研究。
一、冠醚配合物目前已合成的冠醚有几百种,下面是最常见的几种冠醚。
OO O O OO O O O O O OO O O O O15-冠-5 18-冠-6 二苯并-18-冠-61、冠醚的配位性质冠醚具有疏水的外部骨架,又具有亲水的可以和金属离子成键的内腔。
冠醚化合物具有确定的大环结构,可以和许多金属离子形成较稳定的配合物。
2、冠醚配合物的合成Pedersen 总结了五种制备冠醚配合物的方法:1)不用溶剂法:将冠醚与金属盐等摩尔相混,加热熔融。
如苯并-15-冠-5与粉状 NaI 的混合物 在烧杯中熔融2)将冠醚与金属盐溶于合适溶剂中,然后蒸发除去溶剂。
如二苯并-18-冠-6与KI 在甲醇中反应。
3)将冠醚与金属盐溶于尽可能少的热溶剂中,冷却后,配合物可沉淀析出。
如将二苯并-18-冠-6和KSCN 在甲醇中加热溶解,冷却后,即可得针状配合物。
4)将冠醚与金属盐在盐易溶的溶剂中加热,冠醚则逐渐转为配合物,冷却过滤即得产品。
如二苯并-18-冠-6与Pb(CH 3CO 2)2·3H 2O 在正丁醇中加热,混合物冷却后过滤,用正丁醇洗涤配合物,干燥即得。
5)将冠醚溶于一个与水不混溶的有机溶剂中,而将盐溶于水中。
二溶液相混后,生成的配合物要比原来化合物在任一溶剂中的可溶性都小,而作为晶体分离。
如二苯并-18-冠-6的二氯甲烷溶液和I 2的二氯甲烷溶液与KI 的水溶液相混,激烈振荡所得配合物。
3、冠醚配合物的结构近年来,对冠醚配合物的结构做了大量研究工作,按照配合物中配体与阳离子的位置关系可分为如下五类:1)第一类是阳离子恰好适合配体的孔穴如:18-冠-6与KSCN 的配合物[K(18-冠-6)(SCN)]K+ 与SCN-间的作用力较弱。
冠醚与氨基脲的合成
自1967年Pedersen教授首先发表关于冠醚的论文到1987年Pedersen,Lehn和Cram3人共受诺贝尔化学奖,恰好经历了20年。
这期间冠醚化学有了长足的发展,形成了一门吸引多学科科学家重视的新兴边缘性学科———冠醚化学[1]。
它具有许多新奇的化学结构和独特的性质,无机化学家视之为环状多齿配体,有机化学家视之为合成宿主或饱和杂环,生物化学家视之为酶、膜、载体、受体等的模型,它是分子识别、弱化学作用力和超分子化学的典型体现[2]。
它在分析、分离、电化学、分子催化以及难以尽举的许多方面,已得到广泛应用,并彰显了其强大的生命力。
由于这类化合物具有能选择性地络合金属离子和中性小分子,使无机盐溶于有机溶剂及类似酶功能的特性,因而引起了多学科科学家浓厚的研究兴趣[3],目前已渗透到有机合成、配位化学、分析化学、无机化学、萃取化学、金属及同位素分离、光学异构体的识别及拆分、物理化学、生物物理、生物化学、光化学、药物化学、农业化学、生物无机化学、土壤化学等,而且在生命科学、酶模拟、原子能科学、国防科学、医药学、信息科学、环境科学、材料科学、能源科学等方面都得到了广泛应用。
因此冠醚化学是一门植根深远的新兴边缘学科[4]。
研究发现,一些缩氨脲和缩氨硫脲化合物对肿瘤、天花、病毒、疟疾、风湿、麻风及结核具有一定的药理治疗活性。
因此,我们用醚链把二芳醛的缩氨脲基桥接起来,期望增大脂溶性,减小毒性和水溶性,扩大冠醚的应用范围,并期望它在药理效能上更有意义。
1实验部分
1.1试剂与仪器
甲醇、乙醇、冰乙酸、盐酸氨基脲、苯均为分析纯;醚链芳香醛,由西北大学提供。
GCMS-QP1000色质联用仪;X4显微熔点测定仪;IR-450型红外光谱仪;2400Ⅱ型元素分析仪。
1.2实验方法
在盛有体积比为4Ⅱ1的乙醇水溶液的反应瓶中,加入2mmol醚链芳香醛。
用5mL水在烧杯中溶解4mmol盐酸氨基脲,加入反应瓶中,再加入约10mL冰乙酸,加热至80Ⅱ,恒温回流2h。
蒸出部分乙醇,冷却,将反应液移入小烧杯中,用冰水冷却,抽滤得白色固体,用水洗、热苯洗涤,用甲醇重结晶,得纯品。
显微熔点测定仪测定化合物Ⅱ的熔点为213~215Ⅱ,产率90.5%;化合物Ⅱ的熔点为201~202Ⅱ,产率为91.5%;化合物Ⅱ的熔点为180~182Ⅱ,产率为92.5%。
2结果与讨论
2.1结构表征
化合物Ⅱ、Ⅱ、Ⅱ通过MS、元素分析和IR确定了其结构,数据见表1。
合成的产物均为含氮化合物,故在MS分析中有M+-1的强峰[5]。
在质谱图中,质量数为M+-1峰较强,说明N、O等原子的存在使碎片离子结合H+的可能性增大,其裂解路线亦涉及了较复杂的麦氏重排反应等。
2.2反应温度
加热时温度不宜过高,且加热升温要缓慢,否则会使产物碳化,反应混合物变黑,使产率降低或得不到产品。
2.3重结晶的溶剂
用苯、石油醚、氯仿、环己烷等进行重结晶不如甲醇效果好,用甲醇重结晶时,结晶速度快、晶型好、产率高,且纯度好。