物质的组成和结构-课件
- 格式:ppt
- 大小:593.00 KB
- 文档页数:24

物质的组成、构成及分类组成:物质(纯净物)由元素组成原子:金属、稀有气体、碳、硅等。
物质 构成 分子:如氯化氢由氯化氢分子构成。
H 2、O 2、N 2、Cl 2。
离子:NaCl 等离子化合物,如氯化钠由钠离子(Na +)氯离子(Cl-)构成混合物(多种物质)分类 单质 :金属、非金属、稀有气体纯净物 (一种元素)(一种物质) 化合物: 有机化合物 CH 4、C 2H 5OH 、C 6H 12O 6、淀粉、蛋白质(多种元素) 无机化合物 第四单元 物质构成的奥秘课题1 原 子考试要求:知道原子是由原子核和电子构成的 考点一、原子的构成 (1)原子结构的认识 (2)在原子中由于原子核带正电,带的正电荷数(即核电荷数)与核外电子带的负电荷数(数值上等于核外电子数)相等,电性相反,所以原子不显电性因此: 核电荷数 = 质子数 = (3)原子的质量主要集中在原子核上 注意:①原子中质子数不一定等于中子数2、相对原子质量:⑴ ⑵相对原子质量与原子核内微粒的关系:相对原子质量 = 质子数 + 中子数课题2 元 素考试要求:认识氢、碳、氧、氮等与人类关系密切的化学元素 记住常见元素的名称和符号 了解元素的分类 能根据原子序数在周期表中找到指定元素 认识元素符号的意义 注意元素符号周围的数字的意义和区别 考点一、元素1、 含义:具有相同质子数(或核电荷数)的一类原子的总称。
注意:元素是一类原子的总称;这类原子的质子数相同因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同。
2、 相对原子质量=3、元素的分类:元素分为金属元素、非金属元素和稀有气体元素三种(考点二)4、元素的分布:①地壳中含量前四位的元素:O、Si、Al、Fe ②生物细胞中含量前四位的元素:O、C、H、N③空气中前二位的元素:N、O 注意:在化学反应前后元素种类不变二、元素符号(考点三)1、书写原则:第一个字母大写,第二个字母小写。
2、表示的意义;表示某种元素、表示某种元素的一个原子。





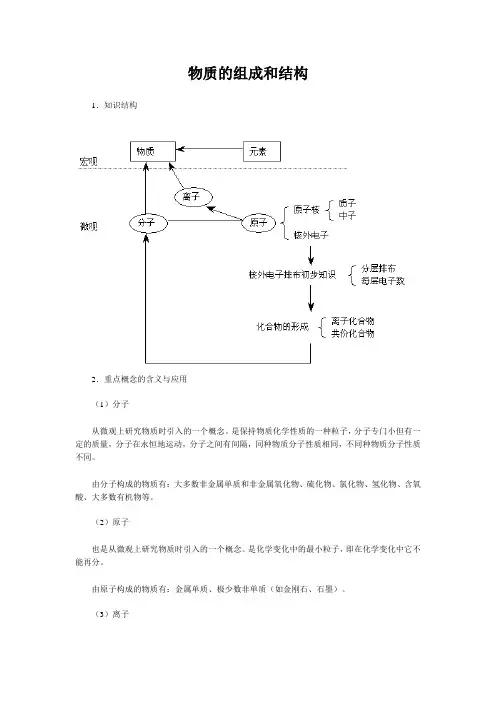
物质的组成和结构1.知识结构2.重点概念的含义与应用(1)分子从微观上研究物质时引入的一个概念。
是保持物质化学性质的一种粒子,分子专门小但有一定的质量,分子在永恒地运动,分子之间有间隔,同种物质分子性质相同,不同种物质分子性质不同。
由分子构成的物质有:大多数非金属单质和非金属氧化物、硫化物、氯化物、氢化物、含氧酸、大多数有机物等。
(2)原子也是从微观上研究物质时引入的一个概念。
是化学变化中的最小粒子,即在化学变化中它不能再分。
由原子构成的物质有:金属单质、极少数非单质(如金刚石、石墨)。
(3)离子从微观上研究化合物时引入的一个概念。
离子是带电的原子或原子团。
带正电荷的离子叫阳离子,如H+、Mg2+、NH4+等;带负电荷的离子叫阴离子,如Cl-、S2-、OH-、SO42-等。
由离子构成的物质有:碱类和大多数的盐。
(4)元素从宏观上认识物质时,分析是由哪些差不多物质形成的,引出来的一个宏观上的概念。
元素的具有相同核电荷数(即核内质子数)的一类原子的总称。
此概念应用于物质的宏观组成。
(5)原子的组成原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成。
原子核由质子和中子构成,每个质子带1个单位正电荷,中了不带电。
故原子核所带的正电荷数(核电荷数)等于核内质子数。
在含有多个电子的原子里,核外电子是按能量分层(离核远近区域)排布的,把能量最低,离核最近的叫第一层,能量稍高、离核稍远的叫第二层,由里往外依次类推,叫三、四、五、六、七层。
每层最多容纳的电子数目是一定的,第一层为2个,第二层为8个,第三层为18个┅┅,然而,最外层电子数目不超过8个。
金属元素、非金属元素、稀有气体元素的原子最外层电子数有明显的特点:金属元素原子的最外层电子数目一样少于4个,非金属元素原子的最外层电子数目一样多于或等于4个,稀有气体元素原子的最外层电子数目差不多上8个(氦只有一层电子,因此是2个)。
通常认为这种最外层有8个电子(最外层是一层时为2个)的结构叫做稳固结构,那个地点所说的稳固是相对的,不是绝对的。


物质的组成与结构物质是组成宇宙万物的基本单位。
我们日常生活中使用的各种物质,不论是固体、液体还是气体,都是由一种或多种原子形成的。
本文将探讨物质的组成和结构,以帮助我们更好地理解物质世界。
一、原子的组成原子是物质的基本构成单位,由质子、中子和电子组成。
质子带有正电荷,中子不带电,电子带有负电荷。
原子的结构中心是由质子和中子组成的核,而电子则环绕着核旋转。
每个元素都有特定数量的质子,这被称为原子序数。
例如,氢原子有一个质子,氧原子有八个质子。
通过这种方式,我们可以根据周期表中的元素进行分类和标识。
在原子中,质子和中子集中在核心,而电子则分布在核周围的能级上。
电子的数量和分布方式决定了元素的化学性质。
二、原子间的相互作用在物质世界中,原子之间的相互作用是非常重要的。
原子可以通过化学键或物理力进行结合。
1. 化学键化学键是指原子之间的相互作用力,是形成化合物的基础。
常见的化学键类型包括离子键、共价键和金属键。
- 离子键:在离子晶体中,正电荷离子和负电荷离子通过电荷吸引力结合在一起,形成离子键。
典型的例子是氯化钠(NaCl)。
- 共价键:共享电子是共价键的特征。
通过共享电子,原子可以达到稳定的电子构型。
例如,氢气(H2)中的两个氢原子通过共享一个电子形成共价键。
- 金属键:金属中的原子由于其自由移动的电子而形成金属键。
这种键强度高,使得金属具有良好的导电性和导热性。
2. 物理力物理力是原子之间引起的非化学相互作用。
这些力包括弱力、静电力和磁力等。
- 弱力:弱力包括范德华力和氢键等。
这些力相对较弱,但在某些情况下仍然起到重要作用。
例如,水分子中的氢键使其具有特殊的性质,如高沸点和密度最大值在4℃时。
- 静电力:静电力是由于带电物体之间电荷的不平衡而引起的相互作用力。
正负电荷之间会相互吸引,而相同电荷则会相互排斥。
- 磁力:磁力是由于原子或分子中电子的自旋和轨道运动形成的。
物质可以表现出磁性,如铁、镍和钴。

