物质的构成和组成
- 格式:ppt
- 大小:755.00 KB
- 文档页数:30

物质的组成与结构物质是构成我们周围世界的基本元素。
通过对物质的研究,科学家们揭示了物质的组成和结构,对于我们深入了解自然界和应用科学知识具有重要意义。
本文将探讨物质的组成与结构,并介绍相关的理论和实验方法。
一、原子与分子物质的基本单位是原子。
原子是由质子、中子和电子组成的微观粒子。
质子和中子位于原子核中,而电子绕着原子核运动。
不同元素的原子具有不同的原子序数和质量数,通过元素周期表可以系统地了解各个元素的特点。
原子通过化学反应可以结合成分子。
分子是由两个或多个原子通过化学键结合而成的粒子。
如水分子(H2O)由两个氢原子和一个氧原子组成。
分子的结构对物质的性质和反应起着决定性的作用。
二、元素的组成与结构元素是由相同类型的原子组成的纯物质。
元素按照化学性质和物理性质可以进行分类。
目前已知的元素共有118种,其中92种是自然界中存在的,其他的是人工制造的。
元素的结构可以通过原子的电子排布来描述。
原子的电子排布遵循能量最低的原理,即电子会尽可能地占据最低能级的轨道。
这种排布方式对元素的性质和反应有着重要的影响。
三、化合物的组成与结构化合物是由不同元素的原子通过化学键结合而成的纯物质。
化合物的组成可以通过化学式表示。
例如水的化学式为H2O,表明水分子中含有两个氢原子和一个氧原子。
化合物的结构可以通过分子的几何形状来描述。
分子的几何结构对于化合物的物理性质和化学性质有着重要的影响。
通过实验方法,如光谱学和晶体学,我们可以揭示化合物的具体结构。
四、晶体的组成与结构晶体是由具有有序排列方式的分子或离子组成的物质。
晶体具有规则的几何形状和特定的物理性质。
晶体的组成和结构可以通过晶体学的方法进行研究。
晶体的组成可以由元素或化合物的原子、离子或分子构成。
晶体的结构是由这些组成部分按照一定规律排列所形成的。
晶体的结构可以用晶胞和晶体结构图来描述。
五、金属的组成与结构金属是一类具有特殊结构和性质的物质。
金属的组成主要是金属元素。

物质的组成与分类一、物质的组成1.微观组成:物质由原子、分子、离子等微观粒子组成。
2.宏观组成:物质由元素和化合物组成。
3.定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
4.特点:互为同位素,具有独特的物理和化学性质。
5.分类:金属元素、非金属元素、稀有气体元素。
6.定义:化合物是由两种或两种以上不同元素以固定的比例结合成的纯净物。
7.分类:离子化合物、共价化合物。
四、物质的分类1.纯净物:由一种物质组成的物质,分为单质和化合物。
2.混合物:由两种或两种以上的物质混合而成的物质。
3.溶液:均一、稳定的混合物,溶质以分子或离子形式存在于溶剂中。
4.浊液:不均一、不稳定的混合物,分为悬浊液和乳浊液。
5.胶体:均一、稳定的混合物,分散质粒子介于1-100nm之间。
五、物质的性质1.物理性质:不需要发生化学变化就表现出来的性质,如颜色、状态、密度、熔点、沸点等。
2.化学性质:在化学变化中表现出来的性质,如可燃性、氧化性、还原性、酸碱性等。
六、物质的鉴别与分析1.鉴别:根据物质的性质差异进行区分。
2.分析:研究物质的组成、结构、性质及变化规律。
七、物质的制取与合成1.制取:通过化学反应或物理方法获取物质。
2.合成:通过化学反应将两种或两种以上的物质结合成新的物质。
八、物质的用途与环境保护1.用途:根据物质的性质将其应用于生产、生活等领域。
2.环境保护:合理利用和保护资源,减少污染物排放,防止环境污染。
综上所述,物质的组成与分类涉及元素、化合物、纯净物、混合物等多种概念,以及物理性质、化学性质、鉴别、分析、制取、合成等方面的知识。
掌握这些知识点有助于我们更好地理解物质世界,为学习化学和其他科学领域奠定基础。
习题及方法:1.习题:区分下列物质中属于纯净物的是?方法:根据纯净物的定义,由一种物质组成的物质属于纯净物。
因此,选项B蒸馏水是由一种物质组成的,属于纯净物。
2.习题:下列哪种物质属于化合物?方法:化合物是由两种或两种以上不同元素以固定的比例结合成的纯净物。

物质的组成及性质随着人类科技的发展和认知的提升,对于物质的组成及性质的研究也越来越深入。
本文将从化学角度探讨物质的组成和性质,并以有机物和无机物为例进行阐述。
一、物质的组成物质是指占据空间并具有质量的实物。
从微观角度来看,物质是由不同种类的原子或分子组成的。
原子是构成物质的基本粒子,在化学上以符号表示,如氧原子的符号为O,氮原子的符号为N。
原子可以组成分子,分子是由两个或更多原子通过化学键连接而成的。
不同种类的原子和分子以一定的比例组合在一起,构成了不同性质的物质。
例如,水分子由一个氧原子和两个氢原子组成,化学式为H2O。
而氧气分子由两个氧原子结合而成,化学式为O2。
二、物质的性质物质的性质可以分为物理性质和化学性质。
1.物理性质物理性质是反映物质在不发生化学变化的情况下的特性。
它包括外观、颜色、形状、密度、熔点、沸点等。
物理性质可以通过观察和实验进行测量和描述,但不改变物质的化学组成。
举个例子,水的物理性质包括无色、透明、具有一定的密度和熔点等。
当温度低于0摄氏度时,水会凝固成冰,而当温度超过100摄氏度时,水会沸腾成水蒸气。
2.化学性质化学性质是指物质在与其他物质发生反应时所表现出的性质。
它涉及物质的组成和结构的变化,包括化学反应的速率、反应产物、氧化性、还原性等。
以燃烧为例,燃烧是一种常见的化学反应,当物质与氧气发生燃烧反应时,会产生火焰、热和光。
例如,木材燃烧时会释放出可燃气体和灰烬。
三、有机物和无机物根据化学组成和性质的不同,物质可以分为有机物和无机物。
1.有机物有机物是指含有碳元素,并通常与氢、氧、氮等元素组成的化合物。
它们是生物体的基本组分,包括蛋白质、碳水化合物、脂肪等。
有机物通常是复杂的,具有多样性和特殊的化学性质。
以葡萄糖为例,葡萄糖是一种有机物,化学式为C6H12O6。
它是一种简单糖类,是生物体内重要的能量来源。
2.无机物无机物是指除了有机物以外的物质,主要由无机化合物和无机元素组成。

物质的组成、构成及分类
组成:物质(纯净物)由元素组成(只有一种分子或原子)有固定的组成,有化学式原子:金属、稀有气体、碳、硅等。
物质构成分子:如氯化氢由氯化氢分子构成。
H
2、O
2
、N
2
、Cl
2。
离子:NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成
混合物(多种物质)(含有多种分子)无固定组成,无化学式。
分类单质:金属、非金属、稀有气体(一种元素)
纯净物
(一种物质)化合物:有机化合物CH4、C2H5OH、C6H12O6、淀粉、蛋白质(多种元素)
氧化物H2O CuO CO2
无机化合物酸HCl H2SO4HNO3
碱NaOH Ca(OH)2 KOH
盐NaCl CuSO4 Na2CO3
注意:同种元素可形成不同的单质或化合物。
因此描述单质和化合物时必须指明是纯净物。
例如:CO和CO2 都是有碳元素和氧元素组成的化合物;O3 和O2 都是有氧元素组成的单质;H2O2和H2O组成元素也相同。

物质的基本结构和组成物质是构成宇宙万物的基本实体,它们以不同的形式存在于我们周围。
了解物质的基本结构和组成对我们理解世界的本质和发挥科学技术的作用至关重要。
本文将介绍物质的基本结构和组成,揭示其在宇宙中的奥秘。
物质的基本结构是由原子构成的。
原子是最基本的粒子,也是构成一切物质的基本单元。
原子由质子、中子和电子组成。
质子带正电荷,中子没有电荷,电子带负电荷。
质子和中子位于原子核中心的核子,而电子则围绕着核子运动。
不同元素的原子通过质子的数量来区分,例如氢原子有一个质子,氧原子有八个质子。
原子由原子间的结构连接在一起形成分子。
分子是由两个或更多的原子通过共享电子或通过化学键连接而成的。
分子的组成取决于原子之间的键类型,包括共价键、离子键和金属键等。
共价键是原子通过共享电子来连接的,而离子键是由正负电荷之间的引力连接的。
金属键是金属中的离子通过共享电子构成的。
除了原子和分子外,更大规模的物质结构可以通过组合不同的分子形成。
例如,细胞是生物体中的基本单位,通过蛋白质、核酸、碳水化合物和脂质等分子构成。
晶体是由重复排列的原子或分子构成的,具有清晰的几何形状和规则结构。
纤维是由重复排列的分子形成的,具有长度比宽度更大的特点。
在物质的基本结构和组成中,元素的存在和组合是至关重要的。
元素是由具有相同质子数量的原子组成的。
目前已知的元素有118种,其中92种是自然界存在的,其余的是人工合成的。
元素可以通过化学反应进行组合,形成不同的化合物。
例如,氧和氢元素可以通过化学反应形成水分子。
化合物是由两个或更多不同元素的原子组成的。
物质的基本结构和组成在研究物质性质、开发新材料和应用于科学技术上发挥着重要的作用。
人们通过研究物质的基本结构,可以了解物质的性质和行为。
例如,通过了解碳原子的结构,人们可以研究碳在不同形式下的性质,如金刚石和石墨。
通过控制物质的组成和结构,人们可以创造新的材料,如高强度钢、陶瓷等。
此外,对物质的基本结构和组成的了解有助于开发新的技术,如纳米技术和材料科学。


物质的组成和结构一、物质的组成1、从宏观上看:物质是由 组成的;如醋酸钾(CH 3COOK )由 、 、 、 四种元素组成,其中原子个数比为 : : : 。
2、从微观上看,物质是由 、 和 三种粒子构成,如水是由 构成,氯化钠是由 构成,铁是由 构成。
二、原子(带正电)1、原子结构 (不带电)2、在原子中存在的等量关系: = = =原子序数。
3、核外电子围绕原子核进行分层运动,共分 层,越在外层的电子能量越 。
4、最外层电子数为 或为 (只有一层)的为相对稳定结构。
5、金属原子最外层电子数 ,易 电子,形成 离子。
6、非金属原最外层电子数 ,易 电子,形成 离子。
7、所以原子的化学性质取决于 。
8、原子的质量主要集中在 上。
相对原子质量= ,近似计算= + 。
相对原子质量是一个比值,没有 。
三、分子、原子和离子区别、联系1、共同性质: 、 、 。
2、区别:分子是 最小粒子原子是 最小粒子分子在 变化中可再分,而原子在化学变化中不能再分。
化学变化的实质是构成分子的原子重新组合。
3、联系:离子 原子 分子4、练习:用符号表示下列元素、原子、分子、离子3个铁原子 ,5个二氧化硫分子 ,2个钙离子 ,2个水分子 。
氮元素 , 2个氢氧根离子 , 镁元素 , 2个氧原子5、根据下列结构图作答:其中属于金属原子的有 ,属于稀有气体原子的有 ,属于阴离子的有 ,离子符号分别是达到稳定结构的有 。
6.右图是某粒子的结构示意图:(1)当该粒子为原子时,X= ;(2)当该粒子的化学符号为X 3+ 时,X= ,符号为 ;(3)当微粒带两个单位负电荷时,微粒符号为四、物质分类混合物:宏观上是由多种物质混合而成的物质,微观上由多种分子构成的物质:只有一种元素组成的纯净物1、物质氧化物:由种元素组成,且其中一种元素是元素。
纯净物化合物酸:如:HCl H2CO3H2SO4 HNO3碱; 如:NaOH Mg(OH)2KOH Ca(OH)2盐2、将下列物质分类空气,干冰、氧气、纯净的井水、石灰水、氮气、蒸馏水、铁粉,氧化镁其中属于混合物的有属于纯净物的有(写化学式)属于单质的有(写化学式)属于氧化物的有(写化学式)实验部分1、药品取用规则:三不原则(不、不不);节约原则(不规定用量时,固体药品一般取;液体药品一般取);环保原则。
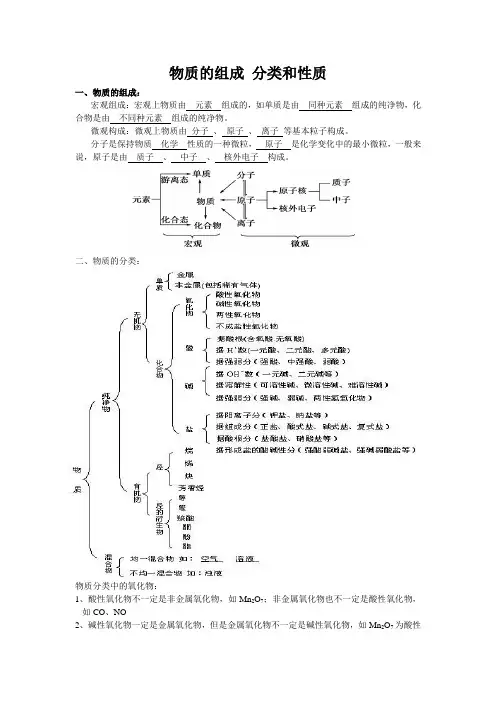
物质的组成分类和性质一、物质的组成:宏观组成:宏观上物质由元素组成的,如单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物。
微观构成:微观上物质由分子、原子、离子等基本粒子构成。
分子是保持物质化学性质的一种微粒,原子是化学变化中的最小微粒,一般来说,原子是由质子、中子、核外电子构成。
二、物质的分类:物质分类中的氧化物:1、酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO2、碱性氧化物一定是金属氧化物,但是金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物等3、酸酐一般能与水直接反应生成对应的酸,但SiO2、Mn2O7不能与水直接反应。
4、一种酸酐可以对应多种酸,如HPO3和H3PO4的酸酐均为P2O5。
三、分散系1.分散系(1)概念:一种(或多种)物质分散到另一种(或多种)物质中所得到的混合体系。
(2)组成:由分散质和分散剂组成。
(3)分类:根据分散质粒子的大小,可以分为溶液、胶体和浊液。
2.胶体(1)定义:分散质粒子直径介于1~100nm 之间的分散系。
(2)特征:均一、稳定,(填“能”或“不能”)透过滤纸,(填“能”或“不能”)透过半透膜。
(3)性质:①丁达尔现象:“光柱”形成——区分胶体与溶液的一种物理方法。
②布朗运动:胶体颗粒不断地做无规则的运动。
③电泳:在外加电场作用下,胶粒在分散剂中向电极做定向移动的现象。
电泳现象证明了胶体微粒带有电荷。
胶体带电规律:A、金属氢氧化物、金属氧化物的胶粒带正电(吸附阴离子);B、非金属氧化物、金属硫化物、硅酸、土壤胶体微粒带负电(吸附阳离子,故一般不宜在水田施用硝态氮肥)。
④胶体的凝聚:向胶体中加入少量电解质,使胶粒聚集形成较大颗粒的沉淀而从分散剂中析出的现象。
(此外加热、将两种带相反电荷胶粒的胶体混合也可使其凝聚)实例:①MgCl2用于止血;②豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐;③水泥里加石膏能调节水泥浆的硬化速率;④在江河与海的交汇处形成的沙洲;⑤用明矾、氯化铁等净水;⑥不同种类的墨水混合使用时有沉淀产生,使墨水失效。

中考专题-----基础知识概念辨析 物质的构成和组成、分类1、物质的构成(分子、原子、离子)一、分子概念 分子是保持物质化学性质的最小粒子。
分子的特征:小、动、隙。
(小东西)分子也是构成物质的一种微粒。
例如固态非金属单质(金刚石、石墨、也就是化学名称是石字旁的等);金属单质(如铁、汞等);稀有气体等。
学生形成分子或原子概念过程中可能有以下困惑和误解: 1、为什么分子是保持物质化学性质的最小粒子,而不是原子。
【解释】分子能保持物质的化学性质,但原子不一定能保持物质的化学性质。
如:H 2O 的化学性质是由H 2O 分子保持的,而不是由H 原子和O 原子来保持的,因为水的直接构成微粒是水分子,而不是氢原子和氧原子,如果水是H 原子和O 原子直接构成那就会具有氢气和氧气的化学性质;金属的化学性质是由原子来保持的,因为金属的直接构成微粒是由金属原子。
2、分子既能保持物质的化学性质,又能保持物质的物理性质。
【解释】物质的物理性质,如熔点、沸点、密度、硬度等都是该物质大量分子的聚集所表现出来的属性,并不是单个分子所能表现出来的。
例如,单个的分子就不能用固态、液态或气态来描述,因此,分子不能保持物质的物理性质,只能保持物质的化学性质。
我们都有这样的生活体验:若口渴了,可以喝水解渴,吃几块冰块也可以解渴,这就说明:水和冰都具有相同的化学性质,而物理性质大不相同,因为水和冰都是由水分子构成的,同种物质的分子,化学性质2H 2O水分子分解示意4H2O2H 2O 2分 子:是相同的。
3、分子是保持物质化学性质的惟一微粒吗?也就是物质都是由分子构成的?【解释】物质不全是由分子构成的。
分子只是构成物质的一种微粒,除分子外,构成物质的微粒还有原子、离子等。
如:氧气由氧分子直接构成,铁由铁原子直接构成,氯化钠由氯离子和钠离子直接构成。
4、分子是最小粒子吗?【解释】说“分子是最小粒子”是以保持物质化学性质为前提,离开这个前提分子不是最小粒子,他仍然可分(他是由原子构成的);同样说“原子是最小粒子”是以化学变化为前提,离开了这个前提他也仍然可分(他是由原子核和核外电子构成的)。


构成和组成有什么区别关于构成和组成,很多人容易混淆,其实构成和组成是有区别的。
构成包括一切能够体现事物内在联系的东西,但这些东西都不是构成;组分只能算一个成分,如果只指这个成分就是组分。
例如:元素 A+ C= C,元素 As+ A= Cu (H)+ K= K (Mn)+ N (N)),而组分则只能算两个元素: As和 Ks。
但是这并不妨碍我们用元素组成物来判断元素的属性和组成情况。
下面我们一起学习关于构成和组成之间的区别。
一、构成是指事物内部存在的联系构成是指事物内部有规律性、必然性、关联性等基本内容,它包括一切能够体现事物内在联系的东西,但这些东西都不是构成。
组分只是一个成分,这个成分只是代表这个成分。
例如:一个物体里面有电子、质子等物质,这一点在物质构成理论中不能体现出来,只能算组分。
例如:同种物质之间、物质粒子之间以及物质与其他成分之间相互作用都需要有特定的条件下才能发生作用或形成新物质。
但是无论有什么作用都需要一个相互联系才能体现。
二、组成有其内在的规律我们可以从一些基本规律上去分析构成和组成之间的区别,也可以从元素结构的本质上来说明事物的组成是有其内在规律的。
简单来说就是,一个物质在构成物质之前是一个组成物,但从组成物中又能够体现出物质的内在规律,比如:一个组分中包含的元素越多,那这个组分就越多,比如说在构成物中包含的元素就越多,就更容易表示出来了,而其他元素在构成物中只起到一个组成作用就可以了。
所以说组成只是说明事物整体的一个过程。
所以我们认为所有物质都具有某种结构形式,但不完全一样。
以碳为例:碳—碳结构层和碳—氧结构层中碳元素占主要成分,其他成分少一些。
而水和碳氧化合物结构与组成物一样。
所以我们还应该注意一点:有些物质是没有构成物的存在的;但是有些物质却恰恰是构成的物质,如有机物等等;有些物质甚至可以组成一个有机系统等等;同样当组成物与有机物相联系到一起时也会存在一些特殊情况,比如:电子在形成氢元素时会形成氢气的状态,氢气在气态的时候是处于稳定状态(如水和氧气);水能够变成二氧化碳或者氢气等;碳元素在其中只占一种成分,如氢、氧等;氢元素虽然没有组成物但是却可以成为元素……这类物质也叫做元素结构物,比如甲烷、乙烷等。
氢(H) 氦(He) 锂(Li) 铍(Be) 硼(B)碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne) 钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S)氯(Cl) 氩(Ar) 钾(K) 钙(Ca)+ + + + + + + + + + + + + + + + + + + + 一、物质的组成与构成①分子的体积和质量都很小。
②分子在不断的运动。
如:很远地闻到花香、酒香,蔗糖、食盐在水中溶解、湿衣服晒干等 ③分子间有间隔 。
如:气体容易被压缩、把100毫升酒精与100毫升水混合后,总体积小于200毫升。
④同种分子的性质相同,不同种分子的性质不同。
由分子构成的物质主要有:H 2 、O 2 、N 2 、H 2 、H 2O 、2 、CH 4 、C 2H 5OH。
如:架在高处的电线夏长冬短、钢轨间的距质子:每个质子带一个单位正电荷 中子:不带电= 核电荷数= 质子数 + 中子数 1,一般省略不写属单质阳离子:核内质子数﹥核外电子数,所带电荷=原子失去电子数 阴离子:核内质子数﹤核外电子数,所带电荷=原子得到电子数 NaCl 、NaOH 、H 2SO 4 、KNO 3 金属元素:Na 、Mg 、Al 、Fe 、Cu 、Zn 非金属元素:C 、S 、P 、O 、Si 、Cl 稀有气体元素:He 、Ne 、Ar4种元素:氧O 、硅Si 、铝Al 、 铁Fe核外电子排布:1-20号元素(要记住元素的名称及原子结构示意图)二、物质的变化与性质化学变化(化学反应):有新物质生成。
电解水、钢铁生锈、动植物的呼吸作用等物理变化:没有新物质生成。
如:冰雪融化、水变为水蒸气、工业上制取氧气、电灯通电发光、发热等物理性质:颜色、状态、气味、密度、熔点、沸点、硬度、挥发性、吸附性、溶解性 化学性质:可燃性、助燃性、毒性、氧化性、还原性、腐蚀性、酸性、碱性化合反应:由两种或两种以上的物质生成另一种物质的反应。
【物理知识点】物质的组成和构成
物质是由元素组成的。
物质是由分子、原子、离子构成的。
物质为构成宇宙间一切物体的实物和场。
例如空气和水,食物和棉布,煤炭和石油,钢铁和铜、铝,以及人工合成的各种纤维、塑料等等,都是物质。
物质是由元素组成的。
元素是宏观的概念,是具有相同核电荷数的一类原子的总称,是无数量名词,因此在用元素描述物质组成时不使用数量词,即使用元素概念时“只讲种类,不论个数”。
如五氧化二磷不能说成是由二个磷元素和五个氧元素组成的,只能说五氧化二磷由磷元素和氧元素组成的。
元素组成完全相同的物质,不一定是同种物质。
如水和过氧化氢都是由氢元素和氧元素组成的纯净物,但它们是两种不同的物质。
构成物质的粒子有分子、原子、离子三种,在分别用它们描述物质的构成时,不同粒子的描述不同的。
1.原子是微观有数量名词,通常在描述分子构成时,原子“既讲种类,又论个数”。
如“1个水(H2O)分子是由2个氢原子和1个氧原子构成的”或“2个氢原子和1个氧原子构成1个水(H2O)分子”。
2.很多物质是由无数分子积聚在一起构成的,因此用分子描述物质的构成时,不指明分子的数量。
如“水是由水分子构成的”,“二氧化碳是由二氧化碳分子构成的”。
3.用离子描述物质的构成时,由于化学式只表示阴、阳离子的个数比例关系,故也不指明离子的数目。
如“氯化钠(NaCl)是由钠离子和氯离子构成的”,“硫酸铝[Al2(SO4)3]是由铝离子和硫酸根离子构成的”。
感谢您的阅读,祝您生活愉快。
化学组成和构成区别
化学组成和构成是细微而有趣的区别。
前者指物质本身的组成成分;后者指物质性质的独特安排。
决定构成的影响因素主要有形式结构,种类,定量等。
化学组成首先,每种物质都由构成元素组成,而不同的物质它们的化学组成不同。
比如,空气是由氮和氧两种元素的混合物,比例为78%的氮和21%的氧,以及少量的水蒸气,二氧化碳和其他气体。
水是由氢和氧两种元素构成的,比例是2:1。
石膏是由钙和氧构成的化合物,比例是20%的钙和80%的氧。
构成其次,化学构成指物体的构造安排。
它由一定的结构,种类和定性配置构成,从而形成一定的构造特征和性质。
比如,银是由一种原子(银原子)构成的,只不过形状不同,它们排列成了一个叫做晶格的稀疏排列形式,这决定了银的表面光泽。
同样地,某些食物也是按这种形式构成的,比如面条、面包、茶叶等,这就形成了关于质地上的不同性能。
此外,维持物质的构造还需要物质的定量配置。
前者反映物质的构成元素的物理量,即重量或体积;后者反映物质的构成元素的定性组合,即种类和分量比例,这也是物质能产生多种性质和多种功能的主要原因。
综上所述,化学组成和构成有着有趣的区别。
化学组成则反映物体的构成元素的种类;而构成反映的是原子的形状和物质的定量组合,这也是物质有特定性质和功能的主要原因。
因此,我
们不能仅仅关注化学组成,而应该研究物质的构成,才能真正尊重物质的本质。