2.2 晶体的微观结构
- 格式:ppt
- 大小:709.50 KB
- 文档页数:34

蛇纹石晶体结构-概述说明以及解释1.引言1.1 概述蛇纹石是一种美丽而独特的矿石,其独特的纹理和色彩,使其成为了一种备受喜爱的装饰材料。
本文将从蛇纹石的形成、晶体结构以及应用领域来进行深入的探讨,并对其未来的发展进行展望。
通过对蛇纹石的研究,我们可以更好地了解这种矿石的特性和潜在的用途,为相关科研和工程应用提供有益的参考和指导。
1.2 文章结构文章结构是指整篇文章按照一定的组织方式和逻辑顺序进行构思和安排。
本文的结构分为引言、正文和结论三个部分。
在引言部分,我们将对蛇纹石的背景和研究意义进行概述,介绍其晶体结构的重要性,以及本文的撰写目的和目标。
在正文部分,我们将深入探讨蛇纹石的形成机制、晶体结构特点及其在实际应用中的意义和价值。
在2.1节中,我们将详细介绍蛇纹石的形成过程,并探讨其与其他石材的区别。
在2.2节中,我们将重点讨论蛇纹石的晶体结构,包括其微观组成和结构特点,从而深入了解蛇纹石的物理特性。
在2.3节中,我们将探讨蛇纹石在建筑材料、装饰艺术和室内设计等领域的应用情况,以及未来可能的发展方向和潜在的应用前景。
在结论部分,我们将对本文的主要内容进行总结概括,展望蛇纹石晶体结构研究的未来发展方向,提出希望和建议,以及对蛇纹石晶体结构研究的结论和观点。
1.3 目的本文的目的是通过对蛇纹石晶体结构的深入探讨,揭示蛇纹石形成的原因和过程,以及其晶体结构的特点和特性。
此外,本文还将探讨蛇纹石在实际应用中的潜在价值和可能的发展方向,以期为相关领域的研究提供参考和启发。
通过对蛇纹石的深入研究,我们可以更好地了解该矿物的特性和用途,为其在地质学、材料科学和工程技术等领域的应用提供理论支持和实践指导。
通过本文的撰写,希望能够为读者呈现一幅清晰的蛇纹石晶体结构的科学图景,为相关研究和应用提供理论基础和实践指导。
2.正文2.1 蛇纹石的形成蛇纹石是一种以石英为主要成分的变质岩,其形成过程是在地壳深部高温高压条件下,由于地壳运动或热液作用而发生改变。


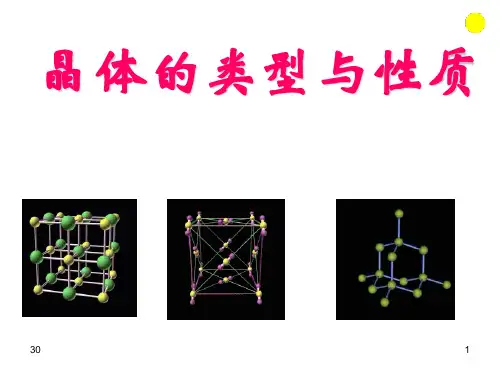





晶体的结构和性质晶体,是由原子、离子或分子有序排列而成的固态物质。
其独特的结构和性质使得晶体在科学研究和工业应用中占据重要地位。
本文将着重探讨晶体的结构和性质,并对其应用领域进行简要介绍。
一、晶体的结构晶体的结构可以分为两个层次来讨论:微观结构和宏观结构。
微观结构是指晶体中原子、离子或分子的排列方式。
晶体的微观结构可以由X射线衍射、电子显微镜等高分辨率实验手段进行研究。
例如,石英晶体的微观结构是由硅氧簇构成的,这些硅氧簇按照一定的规则排列形成晶体的三维结构。
宏观结构是指晶体的晶体形状,也就是晶体表面的外部几何形态。
晶体的宏观结构与其内部微观结构密切相关。
例如,钻石晶体的宏观结构呈现为八面体的形状,与其微观结构中碳原子之间的强共价键有关。
晶体的结构对于其性质具有重要的影响,下面将对晶体的一些性质进行探讨。
二、晶体的性质1. 光学性质晶体的不同结构决定了它们不同的折射率、吸收特性和透明度等光学性质。
例如,石英晶体具有较高的透明度,可以广泛用于光学仪器和光学器件制造。
而金刚石晶体在适当条件下具有高折射率和强光散射能力,使其成为用于研究光学行为的重要晶体。
2. 电学性质晶体的结构和电子排布方式影响着它们的电学性质。
不同的晶体可以表现出不同的电导率、介电常数和电荷迁移速率等。
这些性质使得晶体在电子学领域具有重要应用,如半导体材料和光电器件。
3. 热学性质晶体的结构也会对其热学性质产生影响。
晶体的热导率、热膨胀系数和热稳定性等热学性质对于材料的热管理和稳定性至关重要。
例如,硅晶体由于其较高的热导率和稳定性,是制造集成电路中必不可少的材料之一。
三、晶体的应用由于晶体独特的结构和性质,它们广泛应用于多个领域:1. 材料科学领域晶体结构研究对于新材料的开发具有重要意义。
通过对晶体结构的深入理解,科学家能够设计出具有特定性能的新材料,如高强度陶瓷、高温超导材料等。
2. 光电子学领域晶体的光学和电学性质使其成为光电子学领域的核心材料。

《固体的微观结构》知识清单一、固体的定义与分类在我们日常生活中,固体随处可见,从桌椅板凳到高楼大厦,从金属器具到陶瓷制品。
那么,究竟什么是固体呢?简单来说,固体是物质存在的一种状态,具有一定的形状和体积,并且其分子或原子的排列相对稳定。
固体可以分为晶体和非晶体两大类。
晶体具有规则的几何外形和固定的熔点,比如食盐、钻石等;而非晶体则没有规则的外形和固定的熔点,像玻璃、橡胶等就是非晶体。
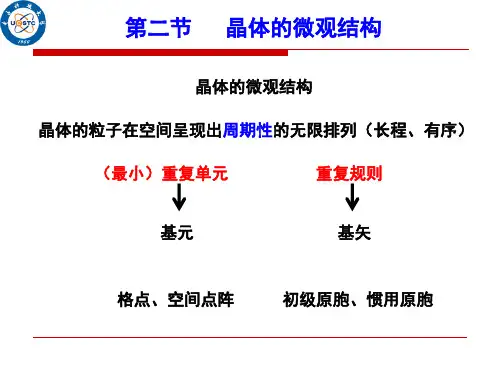
二、晶体的微观结构1、晶格与晶胞晶体的微观结构可以用晶格和晶胞来描述。
晶格是晶体中原子、离子或分子排列的几何框架,就好像是一个巨大的坐标系。
而晶胞则是晶格中能够反映整个晶格对称性的最小重复单元。
通过晶胞的重复排列,就构成了整个晶体。
2、晶体的类型常见的晶体类型有离子晶体、原子晶体、分子晶体和金属晶体。
离子晶体是由正、负离子通过离子键结合而成的,例如氯化钠。
在离子晶体中,离子间的静电作用力很强,因此离子晶体通常具有较高的熔点和硬度。
原子晶体中原子之间通过共价键结合,金刚石就是典型的原子晶体。
由于共价键非常牢固,原子晶体一般也具有很高的熔点和硬度。
分子晶体中分子间依靠范德华力或氢键结合,比如干冰。
分子晶体的熔点和硬度通常较低。
金属晶体则是由金属阳离子和自由电子通过金属键结合而成,金属具有良好的导电性和导热性就与这种结构有关。
3、晶体的各向异性晶体在不同方向上的物理性质常常不同,这就是晶体的各向异性。
比如,石墨在平行于层的方向上比垂直于层的方向上更容易导电。
这种各向异性是由于晶体内部原子、分子或离子的排列方式在不同方向上存在差异导致的。
三、非晶体的微观结构非晶体的内部原子或分子的排列没有规则的周期性。
它们的结构类似于液体,只是粘度较大,所以在宏观上表现出固体的特征。
非晶体没有固定的熔点,加热时会逐渐变软,最终变成液体。
例如,玻璃在加热过程中会逐渐软化,没有一个明确的温度点使其从固态转变为液态。
四、固体微观结构对性质的影响1、力学性质晶体由于其内部原子或分子排列的规则性,通常具有较高的强度和硬度。
晶格与晶胞的名词解释1.引言1.1 概述晶格和晶胞是材料科学中非常重要的概念,用于描述晶体的结构和性质。
晶格是指晶体内部原子、离子或分子排列成有序、重复的结构。
晶胞则是晶格的最小重复单元,它可以完整地再现整个晶格的结构。
在材料科学领域,研究晶格和晶胞的性质是为了理解和解释材料的结构、性能和行为。
晶格的特征决定了晶体的物理、化学和电子性质,包括导电性、热导性、光学性质等。
晶胞的结构决定了晶体的晶体学性质,如晶胞的形状、尺寸和对称性。
通过对晶格和晶胞的研究,科学家能够更好地理解材料的内部结构,并预测和设计新材料的性能。
例如,在固态物理和材料科学中,晶格常常用于描述金属、半导体、陶瓷和晶体材料的结构和性能。
同时,晶格和晶胞的概念也广泛应用于其他领域,如光学、凝聚态物理和无机化学等。
本文将详细介绍晶格和晶胞的定义、特征以及它们之间的关系。
通过深入理解这些概念,我们可以更好地理解材料的微观结构与宏观性质之间的关联,为材料科学和工程领域的研究和应用提供指导。
希望本文可以帮助读者对晶格和晶胞的概念有一个清晰而全面的了解,并对材料世界有更深入的认识。
1.2文章结构文章结构部分的内容可以如下编写:1.2 文章结构本文将按照以下结构进行论述晶格与晶胞的名词解释。
首先,在引言部分,我们将简要概述晶格和晶胞的概念以及它们在材料科学中的重要性。
同时,我们将介绍本文的目的和意义,以便读者能够更好地理解本文所要传达的内容。
接下来,在正文部分,我们将详细解释晶格的定义和特征。
我们会介绍晶格是指由晶体内的原子、离子或分子排列所形成的规则三维结构。
同时,我们还会探讨晶格的一些重要特性,如晶胞的常见形状、晶体的晶型和晶系分类等。
然后,我们将进一步讨论晶胞的定义和构成。
晶胞是指在晶格中所选取的最小重复单元,它由原子、离子或分子构成。
我们将介绍晶胞的几何形状和晶格常量等关键概念,并解释晶胞在描述晶体结构中的重要性。
在结论部分,我们将对晶格和晶胞的理解与应用进行深入讨论。