6-晶体结构详解
- 格式:ppt
- 大小:4.87 MB
- 文档页数:126

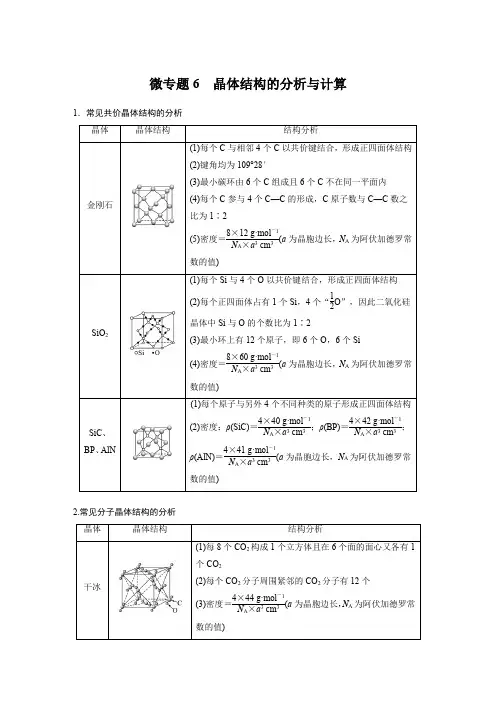
微专题6晶体结构的分析与计算1.常见共价晶体结构的分析晶体晶体结构结构分析金刚石(1)每个C与相邻4个C以共价键结合,形成正四面体结构(2)键角均为109°28′(3)最小碳环由6个C组成且6个C不在同一平面内(4)每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2(5)密度=8×12 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)SiO2(1)每个Si与4个O以共价键结合,形成正四面体结构(2)每个正四面体占有1个Si,4个“12O”,因此二氧化硅晶体中Si与O的个数比为1∶2(3)最小环上有12个原子,即6个O,6个Si(4)密度=8×60 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)SiC、BP、AlN (1)每个原子与另外4个不同种类的原子形成正四面体结构(2)密度:ρ(SiC)=4×40 g·mol-1N A×a3 cm3;ρ(BP)=4×42 g·mol-1N A×a3 cm3;ρ(AlN)=4×41 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)2.常见分子晶体结构的分析晶体晶体结构结构分析干冰(1)每8个CO2构成1个立方体且在6个面的面心又各有1个CO2(2)每个CO2分子周围紧邻的CO2分子有12个(3)密度=4×44 g·mol-1N A×a3 cm3(a为晶胞边长,N A为阿伏加德罗常数的值)白磷密度=4×124 g·mol-1N A×a 3 cm 3(a为晶胞边长,N A为阿伏加德罗常数的值)3.常见离子晶体结构的分析NaCl型CsCl型ZnS型CaF2型晶胞配位数684F-:8;Ca2+:4密度的计算(a为晶胞边长,N A为阿伏加德罗常数的值)4×58.5 g·mol-1N A×a3 cm3168.5 g·mol-1N A×a3 cm34×97 g·mol-1N A×a3 cm34×78 g·mol-1N A×a3 cm31.AB型化合物形成的晶体结构多种多样。

晶体结构的类型分类晶体是由原子、离子或分子按照一定的规律排列而成的固体物质,其结构具有高度的有序性和周期性。
根据晶体内部原子、离子或分子的排列方式和结构特征,可以将晶体结构分为几种不同的类型。
下面将介绍几种常见的晶体结构类型分类。
1. 根据晶体的周期性分为:- 长程有序晶体:具有长程有序性,即晶体中原子、离子或分子的排列呈现出明显的周期性,如立方晶系、四方晶系、六方晶系等。
- 短程有序晶体:具有短程有序性,即晶体中只有一部分原子、离子或分子的排列呈现出周期性,而整体结构并不呈现规则的周期性。
2. 根据晶体的原子、离子或分子排列方式分为:- 离子晶体:由正负离子按照一定比例排列而成,如氯化钠晶体。
- 共价晶体:由共价键连接的原子或分子构成,如金刚石晶体。
- 金属晶体:由金属原子通过金属键连接而成,如铜晶体。
- 分子晶体:由分子之间通过范德华力或氢键等相互作用力连接而成,如冰晶体。
3. 根据晶体的结构特征分为:- 离子晶体:具有高度的电荷平衡,通常硬度较大,熔点较高,易溶于水。
- 共价晶体:具有坚硬的结构,通常硬度很大,熔点也很高。
- 金属晶体:具有电子云海结构,通常具有良好的导电性和热导性。
- 分子晶体:分子之间的相互作用力较弱,通常易溶于有机溶剂,熔点较低。
4. 根据晶体的晶体系统分类:- 立方晶系:包括立方晶体、体心立方晶体、面心立方晶体。
- 四方晶系:包括四方晶体。
- 六方晶系:包括六方晶体。
- 斜方晶系:包括斜方晶体。
- 单斜晶系:包括单斜晶体。
- 单轴晶系:包括单轴晶体。
总的来说,晶体结构的类型分类是根据晶体内部原子、离子或分子的排列方式、结构特征以及晶体系统等因素进行划分的。
不同类型的晶体结构具有不同的性质和特点,对于研究物质的性质和应用具有重要意义。
通过对晶体结构的分类和研究,可以更深入地了解物质的结构和性质,为材料科学和化学领域的发展提供重要参考。


第2章晶体结构提纲:2.1 晶体学基础2.2 金属的晶体结构2.3 合金相结构2.4 离子晶体结构2.5 共价晶体结构2.6 聚合物的晶态结构2.7 非晶态结构学习要求:掌握晶体学基础及典型晶体的晶体结构,了解复杂晶体(包括合金相结构、离子晶体结构,共价晶体的结构,聚合物的晶态结构特点)、准晶态结构、液晶结构和非晶态结构。
1.晶体学基础(包括空间点阵概念、分类以及它与晶体结构的关系;晶胞的划分,晶向指数、晶面指数、六方晶系指数、晶带和晶带定律、晶面间距的确定、极射投影);2.三种典型金属晶体结构(晶胞中的原子数、点阵常数与原子半径、配位数与致密度、堆垛方式、间隙类型与大小);3.合金相结构(固溶体、中间相的概念、分类与特征);4.离子晶体的结构规则及典型晶体结构(AB、AB2、硅酸盐);5、共价晶的结构规则及典型晶体结构体(金刚石)6、聚合物的晶态结构、准晶态结构、液晶结构和非晶态结构。
重点内容1.选取晶胞的原则;Ⅰ) 选取的平行六面体应与宏观晶体具有同样的对称性;Ⅱ)平行六面体内的棱和角相等的数目应最多;Ⅲ)当平行六面体的棱角存在直角时,直角的数目应最多;Ⅳ)在满足上条件,晶胞应具有最小的体积。
2.7个晶系,14种布拉菲空间点阵的特征;(1)简单三斜(2)简单单斜底心单斜(3)简单正交底心正交体心正交面心正交(4)简单六方(5)简单四方体心四方(6)简单菱方(7)简单立方体心立方面心立方3.晶向指数与晶面指数的标注,包括六方体系,重要晶向和晶面需要记忆。
4.晶向指数,晶面指数,晶向族,晶面族,晶带轴,共带面,晶面间距5.8种,即1,2,3,4,6,i,m,。
或C1,C2,C3,C4,C6 ,C i,C s,S4。
微观对称元素6.极射投影与Wulff网;标hkl直角坐系d4⎧⎨⎩微观11213215243滑动面 a,b,c,n,d螺旋轴 2;3,3;4,4,4;6,6,6,6,67.三种典型金属晶体结构的晶体学特点;在金属晶体结构中,最常见的是面心立方(fcc)、体心立方(bcc)和密排六方(hcp)三种典型结构,其中fcc和hcp系密排结构,具有最高的致密度和配位数。





ca6晶体结构
CA6晶体结构属于六方晶系。
CA6,即六铝酸钙(CaAl12O19或CaO·6Al2O3),是一种具有优异高温性能的材料,广泛应用于钢铁冶金等高温领域。
其晶体结构特点是:
-镜面层与尖晶石基块:CA6的结构由镜面层和尖晶石基块沿着c-轴堆叠而成。
每个晶胞通常包含两个镜面层和两个尖晶石基块。
-六方晶系:由于镜面层中的Ca2+半径大于O2-半径,Ca2+无法进入O2-构成的间隙中,因此CA6的晶体结构是六方晶系而非立方晶系。
此外,在制备过程中,CA6晶体的片状生长特性可能会影响其致密化,从而影响材料的性能。
研究人员正在探索通过结构改性方法来提高CA6的致密度。
综上所述,CA6的晶体结构对其性能有着重要影响,尤其是在高温应用中的稳定性和耐用性。
通过材料科学的研究和工艺改进,可以进一步优化CA6的性能,以满足工业应用的需求。