第22届全国高中化学竞赛(决赛)实验试题及答案
- 格式:doc
- 大小:1.32 MB
- 文档页数:8


第22届全国高中生化学竞赛(省级赛区)模拟试题第一题:(4分)本题考考你对化学史的了解程度,请将下面的化学家与主要的贡献连线配对阿雷尼乌斯化学热力学的奠基人范特霍夫配合物结构理论的奠基人维尔纳发现有机镁试剂并广泛用于有机物合成格利亚电解质溶液电离理论的创始人第二题:(6分)铝是地球上最丰富的元素,历史上冶炼铝的过程十分的曲折,德国的化学家Wohler在1827年时,通过下面的两个过程制得了铝:1)将氧化铝,糖,碳及油脂压紧,烧结得到致密的混合物,将该混合物置于炙热的管子中,通入氯气,产生另一种气体X。
2)Na与X反应,生成金属铝1.请写出X的化学式。
2.请写出上面两步的方程式。
第三题:(6分)在单环共轭体系中,如果共轭的电子数为4n+2个,那么该环状体系显示出特殊的稳定性(芳香性),由此请解释下列现象:1、烃类的极性应该非常小,而下面化合物的极性非常大:2、空间结构成四元环状的24S 离子可以稳定存在第四题(8分)液晶是我们生活中使用非常广泛的一种物质状态,它是液态的,但却是各向异性的,所以它既有液态物质的性质也有晶态物质的性质。
下面的反应是合成液晶的一种反应:1、请模仿上述反应完成下列反应式1)2)2、合成液晶的反应可以用Pd做催化剂,有人提出了一种合适的Pd做催化剂的反应机理,请在下面的框图中填入合适的分子。
第五题:(14分)氟化硝酰(NO2F)是一种无色有刺激性臭味的化合物,熔点107K,沸点201K,有极性,是良好的氟化剂和氧化剂。
1、在Pt管中将AgF加热到513K,通入NO2Cl气体,可生成NO2F。
1)请写出该化学反应方程式。
2、请分析NO2F分子中个原子的成键情况,并指出NO2F分子的空间结构。
3、NO2F分子与Zn作用后产物中有N2O3生成,请写出反应的化学方程式。
4、NO2F与AsF5作用可以生成一种离子化合物,请分别写出这个离子化合物中阴阳离子的化学式与立体构型。
第六题:(13分)化学镀镍由于具有镀层厚薄均匀,抗腐蚀性能和耐磨性能号,操作方便的优点,在众多的工业领域中有广泛的应用,化学镀镍所用的还原剂主要是次磷酸盐,硼氢化钠,水和肼等,当用次磷酸钠作为反应的还原剂时需要及时分析,补充调整次磷酸钠的浓度,所以反应的过程中需要快速地测定次磷酸钠的浓度,一般使用容量分析的方法。
中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则题号1 2 3 4 5 6 7 8 9 10 11 总分 满分 14 5 4 10 5 11 14 9 7 11 10 100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣分,但每大题只扣1次。
3单位不写或表达错误,扣分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2- (1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
N S HO O H O(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
A B C D E F G HNO2+ NO N2O3N2H4NH3 N2O4H2N2O2NH2OH)不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
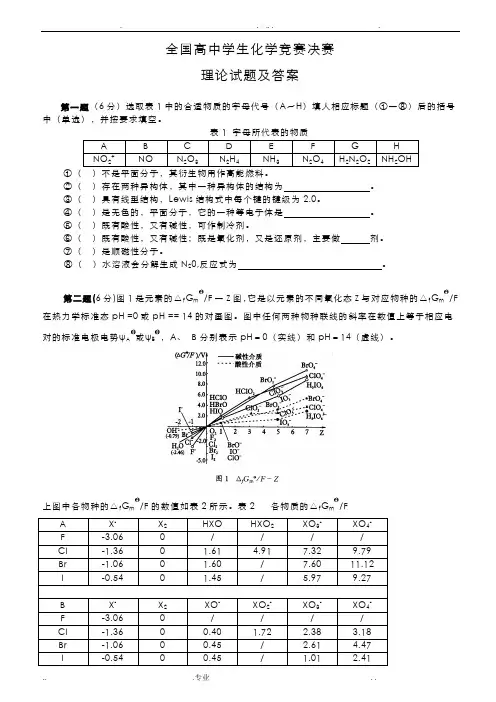
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F 在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/FA X- X2HXO HXO2 XO3- XO4-F -3.06 0 / / / /Cl -1.36 0 1.61 4.91 7.32 9.79Br -1.06 0 1.60 / 7.60 11.12I -0.54 0 1.45 / 5.97 9.27B X-X2XO- XO2- XO3-XO4-F -3.06 0 / / / /Cl -1.36 0 0.40 1.72 2.38 3.18Br -1.06 0 0.45 / 2.61 4.47I -0.54 0 0.45 / 1.01 2.41⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。

化学竞赛试题及答案一、选择题(每题5分,共20分)1. 下列元素中,属于非金属元素的是:A. NaB. ClC. FeD. H答案:B2. 以下化合物中,属于共价化合物的是:A. NaClB. HClC. MgOD. NaOH答案:B3. 根据元素周期表,下列元素中,原子半径最大的是:A. LiB. NaC. KD. Rb答案:D4. 下列反应中,属于氧化还原反应的是:A. H2 + Cl2 → 2HClB. NaOH + HCl → NaCl + H2OC. 2H2O → 2H2 + O2D. CaCO3 → CaO + CO2答案:A二、填空题(每题5分,共20分)1. 元素周期表中,第ⅢA族元素的价电子数为______。
答案:32. 根据化学键理论,离子键与共价键的主要区别在于离子键中存在______。
答案:电荷3. 金属活动性顺序表中,排在氢前面的金属能与酸反应生成氢气,排在氢后面的金属则不能。
因此,铁(Fe)能与盐酸(HCl)反应生成氢气,而铜(Cu)则不能。
请写出铁与盐酸反应的化学方程式:______。
答案:Fe + 2HCl → FeCl2 + H2↑4. 请写出水的化学式:______。
答案:H2O三、简答题(每题10分,共20分)1. 请简述什么是原子的电子排布原理。
答案:原子的电子排布原理是指电子在原子核外的排布遵循一定的规律,如泡利不相容原理、能量最低原理和洪特规则等,以使整个原子体系的能量处于最低状态。
2. 请解释什么是摩尔质量,并给出其单位。
答案:摩尔质量是指一摩尔物质的质量,单位是克/摩尔(g/mol),它与该物质的相对分子质量在数值上相等。
四、计算题(每题15分,共30分)1. 已知某化合物的化学式为C6H12O6,求该化合物的摩尔质量。
答案:C6H12O6的摩尔质量= 6 × 12.01(碳的原子质量)+ 12 × 1.01(氢的原子质量)+ 6 × 16.00(氧的原子质量)= 180.16g/mol。

● 竞赛时刻3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时刻到,把试卷(反面朝上)放在桌面上,当即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必需写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必需写在首页左侧指定位置,写在其他地址者按废卷论处。
● 许诺利用非编程计算器和直尺等文具。
第一题(8分)在一次化学爱好小组的活动中,某小组进行了如下的实验:在小烧杯中加入了必然量的某物质的水溶液A ,滴加了几滴盐酸溶液,再在小烧杯上盖上一张滤纸,在滤纸上滴加了一些碘酸钾-淀粉溶液,几秒钟后,烧杯壁上有黄色的固体析出,滤纸变成蓝色,又过了一段时刻后,滤纸的蓝色退去。
1、 请说明A 是什么溶液。
2、 请写出所有有关的离子反映方程式。
1.008Zr Nb Mo Tc Ru Rh P d Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir P t Au Hg Tl P b Bi P o At Ac-Lr H Li Be B C N O F Na Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y LaLu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn相对原子质量Rf Db Sg Bh Hs Mt金属化合物不仅在晶体结构上不同于分组金属,而且性质上也不同。

化学奥林匹克中国化学会第22届全国高中学生化学竞赛(决赛)理论试题(2009年1月7日陕西西安)第1题金在自然界中主要以分散的单质形式存在,需要先富集再提炼。
富集后的精矿用混汞法、氰化法等工艺提取金。
混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。
氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为IAu(CN)2]-),再用置换法或电沉积法从浸出液中回收金。
1-1 写出用氰化物溶金反应和用zn粉置换金的化学反应方程式。
设配制的NaCN水溶液的浓度为 1.00X10-3mol/L、生成的[Au(CN)2]-配离子的浓度为1.00 X10-4·mol/L、空气中O2的体积分数为0.210,计算298 K时在空气中溶金反应的自由能变。
1-3 当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。
E-pH图上有3种类型的线:电极反应的E与pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的上方,是该电对的氧化型的稳定区,E-pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。
下图是氰化法溶金过程的Au-CN-H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论。
第2题液氨是一种广泛使用的类水溶剂。
2-1 作为溶剂,NH3分子也能发生类似于H2O分子的缔合作用,说明发生这种缔合的原因和比较这种缔合作用相对于水的大小。
2-2 以液氨作为溶剂最引起化学家兴趣的是它能够溶解一些金属,如电极电势小于-2.5 V的碱金属、部分碱土金属及镧系元素可溶于液氨,形成蓝色的具有异乎寻常性质的亚稳定态溶液,这种溶液具有顺磁性和高的导电性,溶液的密度比纯溶液的密度小。
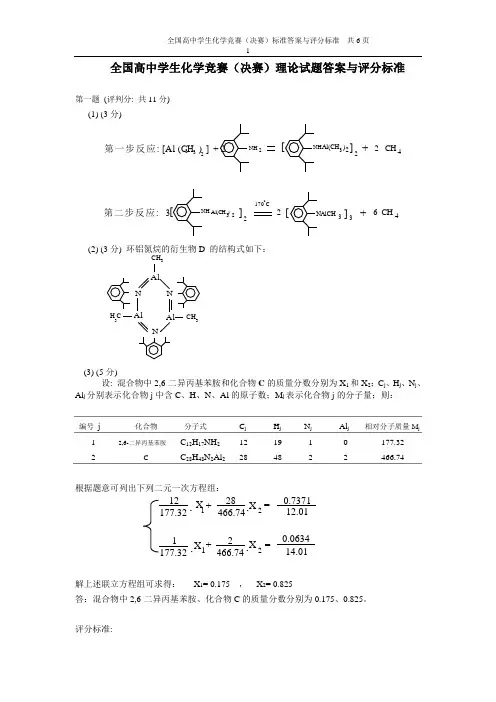
全国高中学生化学竞赛(决赛)理论试题答案与评分标准第一题 (评判分: 共11分)(1) (3分)3NAlCH 第一步反应: [Al (CH ) ] + 2 NH 2332[NH Al(CH )322]+2CH 4]223 Al(CH )NH [第二步反应: 3170C3]+6 CH 42[(2) (3分) 环铝氮烷的衍生物D 的结构式如下:CH 3Al NN AlAl N3CH 3H C(3) (5分)设: 混合物中2,6-二异丙基苯胺和化合物C 的质量分数分别为X 1和X 2;C j 、H j 、N j 、Al j 分别表示化合物j 中含C 、H 、N 、Al 的原子数;M j 表示化合物j 的分子量;则:编号 j 化合物分子式 C j H j N j Al j 相对分子质量M j1 2,6-二异丙基苯胺C 12H 17NH 21219 1 0 177.32 2 CC 28H 48N 2Al 2 284822466.74根据题意可列出下列二元一次方程组:12+28=0.7371177.32466.7412.011+2=0.0634177.32466.7414.01 X X X X 1212....解上述联立方程组可求得: X 1= 0.175 , X 2= 0.825答:混合物中2,6-二异丙基苯胺、化合物C 的质量分数分别为0.175、0.825。
评分标准:全题评判分: 共11分.(1) 评判分: 共3分,其中第一步反应为1分, 第二步反应为2分, 没用结构简式表示的不给分, 未配平、但方程中各化合物结构简式写对的, 第一步扣0.5分, 第二步扣1分;(2) 评判分: 3分(3) 评判分: 共5分, 写对求解联立方程组得3分, 方程结果X1、X2各占1分,全对得2分, 错一个扣1分;用百分数表示者, 只要正确不扣分, 结果数字有效位数不正确者, 每个结果扣0.25分。
第二题(评判分: 共18分)1. (评判分: 6分)第一步反应为CaC2O4·H2O脱水反应, N2和O2对反应无影响, 所以热重曲线相同(2分);第二步反应为CaC2O4的分解,由于CO在O2中氧化放热,使温度升高,加快了反应速率,所以在较低的炉温下CaC2O4即开始分解(2分);第三步反应为CaCO3 的分解,N2和O2对反应无影响,但由于第二步反应分解速率不同,使所生成的CaCO3有所不同,所以曲线有差异(2分)。

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2-(1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。

高中化学竞赛试题精选及答案标题:高中化学竞赛试题精选及答案一、文章类型:说明文二、关键词分析:1、高中化学2、竞赛3、试题4、精选5、答案三、文章结构:1、引言:介绍高中化学竞赛的重要性和目的,以及本文的撰写背景。
2、试题概述:介绍高中化学竞赛试题的类型和难度,以及如何准备应对。
3、试题精选及答案:选取具有代表性的高中化学竞赛试题,附上详细答案和解析。
4、结论:总结本文的要点,强调高中化学竞赛的意义和价值。
四、文章内容:引言:高中化学竞赛是面向全国高中生举办的化学学科竞赛,旨在提高广大青少年对化学学科的兴趣,培养创新精神和实践能力。
本文选取了一些典型的高中化学竞赛试题,并附上详细的答案和解析,以便读者深入了解竞赛试题的难度和特点。
试题概述:高中化学竞赛试题主要分为选择题、填空题、实验题和计算题等几种类型。
其中,选择题注重基础知识的掌握和理解,填空题侧重对知识点的细化和运用,实验题则强调实践操作和创新思维,计算题则考验学生的数学运算和分析能力。
总体来说,竞赛试题难度较大,涉及的知识面广,需要学生具备扎实的化学基础和灵活的思维。
试题精选及答案:(1)选择题题目:下列哪个物质不能与水形成溶液? A. 食盐 B. 酒精 C. 汽油 D. 蔗糖答案:C. 汽油解析:本题考查物质的溶解性,主要涉及溶液的概念。
只有汽油不能与水形成溶液,因为它是一种有机物,不溶于水。
(2)填空题题目:用化学方程式表示下列现象的原理:铁与硫酸反应生成硫酸亚铁和氢气。
答案:Fe + H2SO4 = FeSO4 + H2↑解析:本题考查化学方程式的书写,需要掌握基本的化学反应原理和方程式的规范书写。
(3)实验题题目:设计一个实验方案,用化学方法鉴别下列物质:氧气、氮气和二氧化碳。
答案:将三支试管分别装入上述三种气体,分别插入燃烧的火柴棒,熄灭的为二氧化碳,燃烧更剧烈的为氧气,燃烧情况不变的为氮气。
解析:本题考查实验方案的设计和实施,需要运用所学的化学知识设计实验步骤和操作方法,具有一定的挑战性。

中国化学会第22届〔2021年〕全国高中学生化学竞赛〔省级赛区〕试卷〔2021年9月15日9:00−12:00共3小时〕〔1〕EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
I. 画出EDTA二钠盐水溶液中浓度最高的阴离子的构造简式。
II. Ca(EDTA)2−溶液可用于静脉点滴以排出体内的铅。
写出这个排铅反响的化学方程式〔用Pb2+表示铅〕。
III. 能否用EDTA二钠盐溶液代替Ca(EDTA)2−溶液排铅?为什么?〔2〕氨和三氧化硫反响得到一种晶体,熔点205℃,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的构造式,标出正负极。
〔3〕Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2−的试剂,二者反响得到紫色溶液,写出鉴定反响的离子方程式。
〔4〕CaSO4·2H2O微溶于水,但在HNO3(1mol/L)、HClO4(1mol/L)中可溶。
写出可以解释CaSO4在酸中溶解的反响方程式。
〔5〕取质量相等的2份PbSO4〔难溶物〕粉末,分别参加HNO3(3mol/L)和HClO4(3mol/L),充分混合,PbSO4在HNO3能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
〔6〕X和Y在周期表中相邻。
CaCO3与X的单质高温反响,生成化合物B和一种气态氧化物;B与Y单质反响生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
2. 〔5分〕化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是消费X的原料,92%用于消费X——在酸性水溶液中用盐酸、二氧化硫或草酸复原。
此外,将亚氯酸钠固体装柱,通入空气稀释的氯气氧化,也可产生X。
X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反响。
化学奥林匹克中国化学会第22届全国高中学生化学竞赛(决赛)理论试题(2009年1月7日陕西西安)第1题金在自然界中主要以分散的单质形式存在,需要先富集再提炼。
富集后的精矿用混汞法、氰化法等工艺提取金。
混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。
氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为IAu(CN)2]-),再用置换法或电沉积法从浸出液中回收金。
1-1 写出用氰化物溶金反应和用zn粉置换金的化学反应方程式。
设配制的NaCN水溶液的浓度为 1.00X10-3mol/L、生成的[Au(CN)2]-配离子的浓度为1.00 X10-4·mol/L、空气中O2的体积分数为0.210,计算298 K时在空气中溶金反应的自由能变。
1-3 当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。
E-pH图上有3种类型的线:电极反应的E与pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的上方,是该电对的氧化型的稳定区,E-pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。
下图是氰化法溶金过程的Au-CN-H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论。
第2题液氨是一种广泛使用的类水溶剂。
2-1 作为溶剂,NH3分子也能发生类似于H2O分子的缔合作用,说明发生这种缔合的原因和比较这种缔合作用相对于水的大小。
2-2 以液氨作为溶剂最引起化学家兴趣的是它能够溶解一些金属,如电极电势小于-2.5 V的碱金属、部分碱土金属及镧系元素可溶于液氨,形成蓝色的具有异乎寻常性质的亚稳定态溶液,这种溶液具有顺磁性和高的导电性,溶液的密度比纯溶液的密度小。
高中化学竞赛试题精选1答案班级姓名1.在一定条件下将a体积NO2和b体积O2同步通入倒立于水中且盛满水旳容器内充足反映后,容器内残留体积旳气体,该气体遇空气即变为红色,则a与b旳比值为--------------------------------------------------------------------------------------[B]A、1:6B、6:1C、8:3D、3:8〖提示〗:残留旳体积旳NO气体是由剩余旳NO2与水反映得到有,故与O2参与反映旳NO2旳体积为a-=,消耗O2旳体积为旳四分之一。
2.某学生为测定一瓶失去标签旳铁旳氧化物样品旳成分,称取14.00克该样品用足量旳CO在合适旳条件下使其所有还原,将生成旳CO2用足量旳澄清石灰水吸取生成26.25克沉淀,据此可推断出该样品是--------------------------------[A]A、Fe2O3B、Fe3O4C、不纯旳Fe2O3D、FeO〖提示〗:CO与之反映后均生成CO2,其中旳一种氧原子所有来自铁旳氧化物,因此生成旳CO2旳物质旳量(0.2625摩)也就是铁氧化物中所含旳氧原子旳量,其中每1摩氧原子所相应旳式量=3.a在常温下为离子晶体,由X、Y两元素构成,在a中X m+和Y n-旳电子层构造相似。
已知下列反映:(1)a+H2O H2+b+c(2)H2+c→d(气)(3)b+c→a+e+H2O则a、e、f依次是-----------------------------------------------------------------------[B]A、NaCl NaClO HClB、CaCl2Ca(ClO)2HClOC、Na2S Na2SO3H2SO3D、K2S K2SO3H2SO44.将amol/L旳碳酸氢钙溶液跟bmol/L旳烧碱溶液等体积混合后旳溶液中具有四种生成物,则下列a与b旳关系对旳旳是----------------------------------------------[B]A、a:b≥1:2B、1:2<a:b<1:1C、2a=bD、a=2b5.①将0.1升1.0mol/L旳纯碱溶液逐滴加入到0.1升1.25mol/L旳盐酸中②将0.1升1.25mol/L旳盐酸逐滴加入到0.1升 1.0mol/L旳纯碱溶液中,两种操作产生二氧化碳旳体积比为------------------------------------------------------------------------[A]A、5:2B、2:5C、2:1D、1:16.二种短周期元素构成旳化合物中,原子个数比为1:3,若二种元素旳原子序数分别为a和b,则a、b旳关系也许是------------------------------------------[D]①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8A、①②③B、①②④C、②③④D、①②③④7.某离子晶体旳空间构型如图所示,则该晶体中X、Y旳离子个数比为[BD]A、XY4B、XY2C、YXD、YX28.向具有a摩AlCl3溶液中加入具有b摩KOH溶液,生成沉淀旳物质旳量也许是-------------------------------------------------------------------------------------------------[A]①a摩②b摩③a/3摩④b/3摩⑤0摩⑥(4a-b)摩A、①③④⑤⑥B、①②③④⑤C、①④⑤⑥D、①④⑤9.用H2还原某+n价旳金属氧化物,如有1克H2正好还原a克氧化物时,则该金属旳相对原子质量(原子量)为-----------------------------------------------------[B]A、(8-a)nB、(a-8)nC、an+8nD、an+16n10.25℃时,在0.1mol/LNaX溶液中,水旳电离度为α1;在0.1mol/L盐酸中,水旳电离度为α2,若=109,则NaX溶液旳PH值为----------------------[C]A、5B、7C、10D、1111.已知[Co(NH3)6]3+呈正八面体构造:各NH3分子间距相等,Co3+位于正八面旳中心。
第22届全国高中学生化学竞赛(省级赛区)备用试卷第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式I 2O 5 2I 2O 52I 2+5O 2(1分)(1分)1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
I 2O 5+5CO5CO 2+I 2 (1分)因该反应完全定量进行,用碘量法以Na 2S 2O 3滴定反应释出的I 2,即可定量测定合成气中CO 含量.(1分)1—3画出X 的分子结构示意图IOIOOOO (2分)1—4 X 的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y ,Y 是制造一种灭火器的原料,写出上述两步反应的化学方程式。
2HIO 3+10HCl=I 2+5Cl 2+6H 2O 或HIO 3+5HCl=ICl 3+Cl 2+3H 2(1分)Cl 2+CHCl 3=HCl+CCl 4或Cl 2+2CHCl 3=2CCl 4+H 2(1分)O第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。
回收钯的中间物常以PdCl 42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A 表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。
图1是在固定酸度、钯浓度、A 浓度和相比的条件下lgD~lg[Cl -]的关系,图2是在固定酸度、钯浓度、Cl -浓度和相比时lgD~lg[A]的关系。
整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。