第四章配合物在溶液中的稳定性
- 格式:ppt
- 大小:620.00 KB
- 文档页数:34









课题:配合物的稳定性课型:课时:上课时间:学习目标:1、理解配合物稳定常数的意义2、了解配位平衡移动的原理重、难点:1、稳定常数的意义2、配位平衡的移动学习过程:课前检测:1、化学平衡常数的意义2、沉淀溶解平衡学习新课一、配合物的稳定性[实验探究]1、取一支试管加入5mL 0.1mol/L CuSO4溶液,逐滴加入2mol/L NH3·H2O溶液至过量(溶液变成深蓝色,这种深蓝色溶液是什么,含有什么离子?),然后逐滴加入0.1mol/L BaCl2溶液至不再有沉淀生成为止(注意不能过量),取上层清液滴加2mol/L Na2S溶液,观察并记录现象。
2、分析实验现象,你能得出什么结论:。
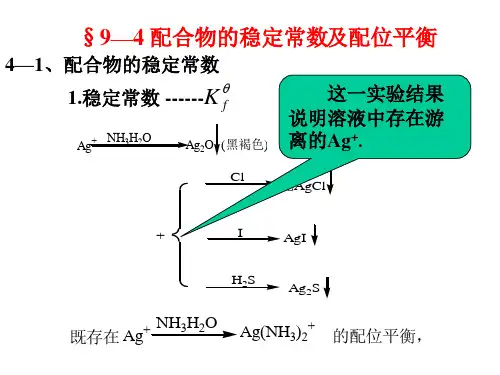
[自学反馈]预习P133配离子在水溶液中的解离平衡,理解配离子的解离与结合是一个可逆过程,学会计算配离子的稳定性常数1、配离子的稳定性可以用和表示。
2、以配合物[Cu(NH3)4]SO4为例,表示其稳定性3、稳定性常数的意义。
二、配位平衡的移动[实验探究]1、取一支试管加入2mL 10% FeCl3溶液,逐滴加入5%KSCN溶液,观察溶液颜色;然后逐滴加入1mol/LNaF溶液,观察并记录现象。
2、分析实验现象,你能得出什么结论:。
[自学反馈]预习P133配位平衡的移动,理解配位平衡移动的原理,找出影响配位平衡的因素。
[思考讨论与应用](难)取一支试管加入1mL 0.1mol/L的AgNO3溶液,1mL 0.1mol/L的NaCl溶液,1mL 1mol/L的NH3·H2O溶液,摇匀静置,试判断溶液中是否有沉淀,并进行解释。
自学检测:1、配合物在水溶液中全部解离成,而配离子在水溶液中解离,存在着平衡。
2、在[Ag(NH3)2]+水溶液中的解离平衡式为:3、配位数相同的配离子,若越或越,则该配离子越稳定,若值越大,表示该配离子解离程度越。
4、·=。
课堂检测:1、在AgNO3溶液中加入NaCl溶液,产生沉淀,反应的离子方程式为。

配合物的稳定常数公式配合物的稳定常数是描述配合物中金属离子和配体之间的络合平衡的一个重要参数。
它提供了一种衡量配合物稳定性的指标,有助于了解配合物的结构、性质和反应行为。
在配合物化学中,稳定常数的计算和测定是非常重要的,因为它们揭示了配体和金属离子之间的相互作用强度。
配合物的稳定常数通常用K值表示,可以通过测定配合物的络合平衡反应的平衡常数K来得到。
平衡常数K是指当配体和金属离子形成配合物时,反应达到平衡时配合物浓度的平均大小。
稳定常数与平衡常数的关系可以通过以下公式表示:K = [MLn]/([M][Ln])其中,[MLn]表示配合物的浓度,[M]表示金属离子的浓度,[Ln]表示配体的浓度。
当配合物形成的平衡常数越大时,稳定常数也会越大,说明配合物越稳定。
反之,当平衡常数接近1时,配合物的稳定常数较小,说明配合物不稳定。
稳定常数的计算可以通过多种方法进行,包括光度法、电导法、行为积等。
光度法是一种常用的测定稳定常数的方法,它利用配合物的颜色和吸收光的特性来测定配合物的浓度。
电导法则是通过测定电解质溶液中的电导率来推算稳定常数。
行为积法则是通过测定配体和金属离子的相对电荷量来估算稳定常数。
稳定常数对于配合物化学的研究具有重要意义。
首先,稳定常数可以揭示配合物的稳定性和反应性,有助于了解配体和金属离子之间的相互作用机制。
稳定常数还可以指导合成新颖的配合物,设计特定性质的配合物,以及优化配合物的应用性能。
此外,稳定常数还可以用于解释反应平衡的移位情况和配合物的形成与解离过程。
配合物的稳定常数还可以与其他参数一起使用,比如pH值、温度等。
这些参数都可以影响配合物的稳定性,进一步影响到配合物的性质和反应行为。
因此,稳定常数的测定和理解对于认识和探索配合物化学具有重要的意义。
总之,配合物的稳定常数是描述配体和金属离子之间络合相互作用的一个重要参数。
它可以通过平衡常数来计算和测定,提供了一种衡量配合物稳定性的指标。
第四章配合物之练习参考答案1解:取少量粗盐酸,适当稀释,则黄色消失,说明配离子[FeCl4]-不稳定,已分解为Fe3+和Cl-。
再加入KSCN溶液,有血红色溶液生成,说明有自由的Fe3+存在。
而取未稀释的粗盐酸加入KSCN溶液却无现象,证明无自由的Fe3+存在,这时的Fe(Ⅲ)是以[FeCl4]-形式存在。
2解:对于配离子FeF63-和FeCl4-,中心离子相同,配体不同,因半径:F-<Cl-,配体半径增大,相互间的排斥作用增大,要使配离子稳定,则只有减小配位数,所以Fe3+与Cl-形成配离子时只能是4配位。
3解:4解:该配合物无几何异构。
因只有一种配体,且由于乙二胺分子本身的大小决定了它不能采用对位结构(张力太大),则无几何异构。
但它有一对对映异构体。
5解:因为双齿配体C2O42-的碳链很短,不可能对位配位。
其顺式有极性,且水溶性大,而反式无极性,不溶于水。
6解:由于只有外界离子在水中可完全电离而与Ag+生成AgCl沉淀,由沉淀所需AgNO3的量可推出:黄色CoCl3·6NH3应为[Co(NH3)6]Cl3;紫红色CoCl3·5NH3应为[Co(NH3)5Cl]Cl2;绿色CoCl3·4NH3应为[Co(NH3)4Cl2]Cl;紫色CoCl3·4NH3应为[Co(NH3)4Cl2]Cl。
(它与绿色配合物互为几何异构体)它们的电导之比约为4:2:1:1。
7解:Fe2+的价电子构型为3d64s0,Co3+的也为3d64s0。
由于CN-为强场配体,可使Fe2+的3d轨道上的电子重排而空出2条轨道,则在[Fe(CN)6]4-中Fe2+采用d2sp3杂化。
同理,NH3也可使Co3+重排形成内轨型配合物,则也采用d2sp3杂化。
8解:RuCl2(H2O)4+有2个立体异构体,它们是:RuCl3(H2O)3有2个立体异构体,它们是:它们水解后均转化为一种异构体A,则只能是顺式的结构.10解:(1)[CoCl2(H2O)(NH3)3]Cl (2) K2[PtCl6](3) (NH4)3[Cr(SCN)4Cl2] (4) Ca[Co(C2O4)2(NH3)2]211解:这五种配合物的化学式均为K2[CoCl2I2(NH3)3],它们互为几何异构体,中心离子氧化态为+2。