无机化学-氮族元素
- 格式:ppt
- 大小:1.96 MB
- 文档页数:2





宋天佑版无机化学氮族元素无机化学是研究无机化合物的性质、合成、结构和反应的学科,其中氮族元素是无机化学中一个重要的元素族群。
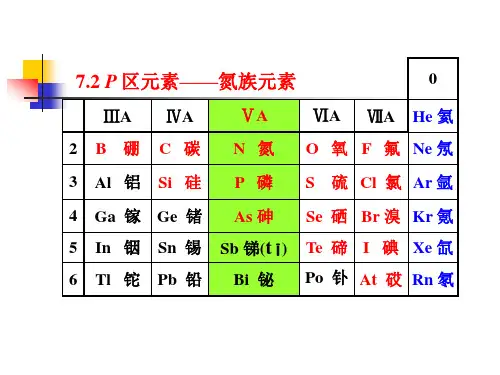
氮族元素包括氮、磷、砷、锑、和铋,它们的特点是具有类似电子构型和化学性质。
首先,我们来讨论氮元素。
氮是地壳中的第七大元素,占地壳总质量的0.025%,在空气中的含量约为78%。
氮的电子构型为1s²2s²2p³,有5个外层电子。
氮是一种非金属元素,没有明显的金属光泽。
氮分子是由两个氮原子通过共用电子对形成的双原子分子,其化学式为N₂。
在常温常压下,氮气是一种无色、无味、无臭的气体。
氮元素具有较高的电负性,因此它喜欢与其他元素形成共价键。
它与氢原子结合形成氨气(NH₃),与氧原子结合形成氧化氮(N₂O、NO、NO₂等),与卤素原子结合形成卤化氮(NF₃、NOCl、NCl₃等)等。
此外,氮还可以形成与氧原子和氢原子交替排列的环状结构,如硝酸盐(NO₃⁻)和亚硝酸盐(NO₂⁻),这些化合物在环境中起到重要的生物和化学过程。
相比之下,磷(P)是地壳中的第14大元素,其电子构型为1s²2s²2p⁶3s²3p³。
磷是一种多态元素,常见的有白磷(P₄)、红磷和黑磷。
白磷是一种有毒的、具有刺激性气味的固体。
磷还形成一系列的氧化物和氧酸盐,如氧化磷(P₂O₅)、磷酸盐(H₃PO₄)等。
磷还可以形成有机磷化合物,如磷酸二酯和磷酰氯等,它们在生物和化学中发挥着重要的作用。
砷(As)、锑(Sb)和铋(Bi)是氮族元素中的其他元素。
砷是地壳中的第20大元素,电子构型为1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p³。
砷是一种具有多种化合价的元素,它的主要氧化态有-3、+3和+5、锑是地壳中的第51大元素,电子构型为1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶4d¹⁰5s²5p³。
![无机化学[第十四章氮族元素]课程预习](https://uimg.taocdn.com/753880ec5f0e7cd185253620.webp)
第十四章氮族元素知识点归纳一、氮的单质单质氮在常况下是一种无色无味的气体,在标准状况下密度为1.25g/dm3。
工业上生产氮一般是由分馏液态空气在15.2MPa压力下装入钢瓶备用,或做成液氮存在于液瓶中,实验室中制备少量氮气。
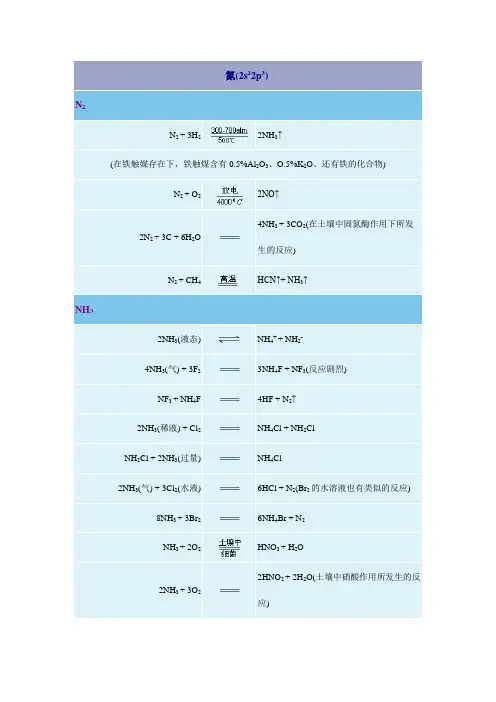
N2分子是已知的双原子分子中最稳定的.在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:二、氦的成键特征N原子价最子层结构为2s2p3,即有3个成单电子和一个孤电子对,在形成化合物时,其成键特征如下:(1)形成离子键N原子有较高的电负性,它同电负性较低的金属形成一些二元氮化物即能够获得部分负电荷而形成N3-离子。
(2)形成共价键N电子同电负性较高的非金属形成化合物时它总是以不同的共价键同其他原子相结合,这些共价键一般有以下几种:三、氮的氢化物1.氨(1)氨的制备氨是氮的最重要化合物之一,在工业上氨的制备是用氮气和氢气在高温高压和催化剂存在下合成的:(2)氨分子的结构在NH3中,氨采取不等性sp3杂化,有一对孤电子对,分子呈三角锥形结构,键角为107。
18’。
这种结构使得NH3分子有较强的极性。
(3)氨的物理性质和化学性质NH3具有相对高的凝固点、溶解热、蒸发热、溶解度和介电常数,氨极易溶于水。
在水中的溶解度比任何气体都大,237K时1 dm3的水能溶解1200dm3的氨。
氨的主要化学性质有:①还原性KH3和NH4+离子中N的氧化价为+3,因此它们在一定条件下只能有失去电子的倾向而显还原性。
常温下,氨在水溶液中能被Cl2,H2O2,KMnO4等氧化。
例如:③加合反应氨中氮原子上的孤电子对能与其他离子或分子形成配位键,结果形成了各种形式的氨合物,氨能与许多金属离子形成氨配合物如[Ag(NH3)2]+。
④弱碱性氨极易溶于水,它在水中主要是形成水合分子,同时在水中只有一部分水合氨分子发生电离作用。
NH3·H2O的K b=1.8×10—5,可与酸发生中和反应.(4)铵盐氨和酸作用可得到相应的铵盐,铵盐一般是无色晶体,易溶于水,而且是强电解质。


无机化学第17章氮族元素第17章是关于氮族元素的无机化学知识。
氮族元素是元素周期表中第15族的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
这些元素在化学中具有许多重要的性质和应用。
在本章中,我们将讨论氮族元素的化学性质、反应、化合物以及它们在生物体系中的重要性。
首先,我们将介绍氮族元素的一些共同性质。
氮族元素的原子半径逐渐增加,而电负性逐渐降低。
氮族元素的价壳层电子配置为ns2np3,其中n代表价壳层的主量子数。
氮族元素通常形成3价阳离子(如NH4+),5价阴离子(如NO3-)和3价中性化合物(如NH3)。
从氮到铋,这种趋势是明显的。
此外,氮族元素的氧化态范围很广,从-3到+5都有。
这种多样性使得氮族元素在化学反应中能够发挥多种不同的角色。
氮族元素最重要的元素之一是氮。
氮气(N2)是地球大气中占据最大比例的气体成分之一、氮气在室温和常压下是稳定的,但它可以通过高温和高压的条件下与氢气反应,形成氨气(NH3)。
氨气是一种重要的化学物质,在肥料、农药和化肥生产中应用广泛。
此外,氨气也是合成其他化学品(如硝酸和尿素)的重要原料。
尤其是,氨气还可以和各种酸反应,形成盐。
这些氨盐可以通过酸碱反应来制备氨化合物,例如铵盐(如氨铵硝酸盐)和亚硝酸(如亚硝基氨)。
亚硝酸是氮族元素的另外一个重要化合物,在食品加工和防腐剂中有广泛应用。
另一个重要的氮族元素是磷。
磷在生物体中起着重要的作用,例如在DNA和RNA的结构中起着关键的作用。
磷也是肥料和家庭清洁剂中的重要成分。
磷的化合物也可以通过与氧气的反应制备。
磷酸盐(如三钠磷酸盐)是广泛存在于自然界中的一个重要矿物。
此外,砷是氮族元素中的另一个重要元素。
砷化氢(AsH3)是砷的重要化合物之一,它是一种无色、有毒的气体。
砷酸盐在过去被广泛应用,但由于砷的毒性,它们现在被禁止在许多国家使用。
锑和铋是氮族元素中较重的元素,它们在化学上与轻量级元素相似。
锑的最常见氧化态是+3,而铋的最常见氧化态是+3和+5、锑和铋的化合物在电子和光学领域有许多应用。

第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水§1. 氮和氮的化合物一.单质1 氮气的化学性质常温下N2很稳定,表现出惰性,高温下活泼些。
1°和非金属的反应N 2 + 3H2--2NH3催化剂,一定T.P下反应,高中讨论过。
2°和金属单质的反应高温下和Mg、Ca、Sr、Ba反应3Ca + N2---Ca3N2( Ca:410℃,Sr:380℃ ,Ba:260 ℃)和Li反应250℃就很快了6Li + N2 --- 2Li3N二氮的氢化物1、氨(NH3)1°NH3的分子结构2 °液氨的性质(和H2O相比较):-33.4℃液化,可作非水溶剂。
它是路易斯碱。
故液氨和H2O一样,很难电离和Na反应,H2O 和Na反应迅速,NH3和Na反应极慢,放置时反应如下:H 2逸出后,蒸干得白色固体NaNH2,即氨基钠。
NH3(l)能溶解碱金属,稀溶液显蓝色氨合电子是金属液氨溶液显蓝色的原因,也是金属液氨溶液显强的还原性和导电性的依据。
它的导电性超过任何电解质溶液,类似金属。
3°氨的化学性质A)络合反应氨分子中有一个孤电子对,所以可与许多金属离子配位形成络离子。
B: 杂化,与3个F形成三个键,B中还有一个空的2P轨道,NH3的孤电子对填到B的2P空轨道中。
2、联氨 N2H41°结构N2H4可以看成是NH3中的一个H被NH2取代,联氨又叫肼,N上仍有孤对电子。
2°联氨的性质纯的联氨是无色液体, m.p.1.4 ℃, b.p.113.5 ℃。
A)显碱性其碱性的机理与NH3一样是二元弱碱,比NH3略弱。
B)氧化还原性N2H4N显-2价,既有氧化性又有还原性不论在酸中、碱中,联氨作氧化剂,反应都非常慢,故只是一个好的还原剂。