无机化学13章氮族元素
- 格式:doc
- 大小:886.50 KB
- 文档页数:9




氮族元素word版氮族元素王振⼭第⼀节氮族元素⼀、氮族元素在周期表中的位置:ⅤA族,2~6周期⼆、原⼦结构与元素的性质1、原⼦结构⑴、相同点:最外层电⼦数均为5;2、元素的性质⑴、相似点:①、最⾼正化合价为+5,最⾼价氧化物的化学式为R2O5,最⾼价氧化物⽔化物的通式为HRO3或H3RO4;*{N2O5(⽆⾊固体)、P4O10(⽩⾊雪状固体)、As2O5[⽩⾊粉末,对热不稳定,315℃左右分解为As2O3(⽩⾊晶体)和O2]、Sb4O10(淡黄⾊粉末,对热不稳定……)、Bi2O5[红棕⾊,极不稳定,很快分解为Bi2O3(黄⾊晶体)和O2]。
}②、负化合价为-3,⽓态氢化物的化学式为RH3。
*主要化合价⑵、差异和递变规律:②、单质③、最⾼价氧化物的⽔化物注释:*原某酸:酸分⼦中氢氧基的数⽬和成酸元素的氧化数相等时,可⽤字头“原”表⽰,称为原某酸。
如原碳酸H4CO4,原硅酸H4SiO4,原碲酸H6TeO6,原碘酸H7IO7。
⾃⼀分⼦正酸缩去⼀分⼦⽔⽽成的酸,定名为偏酸,也可称为⼀缩某酸。
正⾼碘酸H5IO6[或I2O7·5H2O或IO(OH)5],⽩⾊晶体,熔融时分解为HIO3;在真空中加热时,H5IO6逐渐失⽔⽣成偏⾼碘酸HIO4,HIO4在⽔溶液中⼜重新变为⾼碘酸H5IO6。
碲酸H6TeO6,[或Te(OH)6],⽩⾊固体。
锑酸H[Sb(OH)6](可以看作H3SbO4+2H2O),两性偏酸,作为酸是⼀元弱酸,微溶于⽔,可溶于KOH 溶液⽣成锑酸钾K[Sb(OH)6]。
锑酸H[Sb(OH)6]与同周期的锡酸H 2[Sn(OH)6]、碲酸H 6TeO 6、正⾼碘酸H 5IO 6有相同的结构,都是六配位的⼋⾯体结构,⽽且它们互为等电⼦体。
④、⽓态氢化物NH 3 PH 3 AsH 3 SbH 3 BiH 3 (单质跟H 2)⽣成越来越难,热稳定性依次降低;碱性依次减弱,酸性依次增强;还原性依次增强。

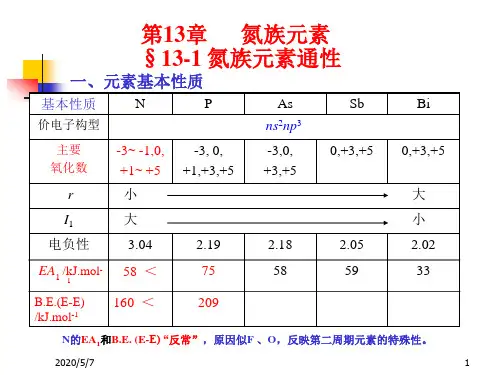


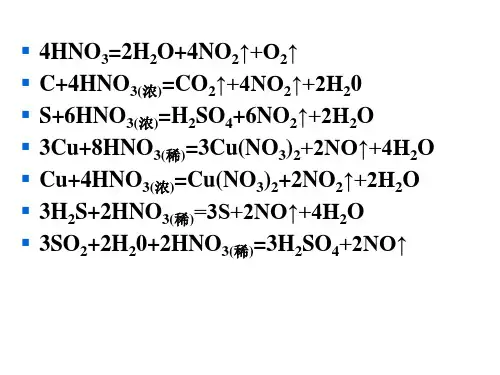

氮族元素概述王振山一、氮族元素通性周期系ⅤA族包括N、P、As、Sb、Bi五种元素称为氮族元素。
氮在地壳中的丰度为0.0046%,氮主要以单质存在于大气中;磷在地壳中的丰度为0。
118%,磷主要以磷酸盐形式分布在地壳中;砷、锑、铋是亲硫元素,它们在自然界中主要以硫化物矿形式存在。
⑴、结构:①、有获得3个电子成为-3氧化态而达到稀有气体结构的趋势,但要完全夺得3个电子成为—3价离子则困难,只有电负性较大的N和P在个别化合物中能成为-3价离子,如Li3N,Mg3N2,Na3P,Ca3P2等,但只能存在于干态,因N3-,P3—离子半径大,变形性强,遇水会强烈水解生成NH3和PH3.本族元素与电负性较小的元素化合时,可形成-3氧化态的共价化合物。
②、本族元素与电负性较大元素化合时,主要形成氧化数为+3或+5的化合物,这与共价层电子相关,即前者相当于用3个np电子成键,而后者则用2个ns电子和3个np电子成键。
本族元素从上→下,+5氧化态化合物稳定性递减,而+3氧化态的稳定性递增。
2、性质变化规律NPAsSbBi单质物态:气固固固固非金属元素准金属元素金属元素I1──────────────────〉减小X──────────────────>减小EA1─────────────────>递增,负值减小N在本族中半径最小,电负性最大,价电子层数为2,故具有一些与本族其它元素不同的特性。
如形成化合物时,只有2s、2p轨道可用,故最高配位数为4;r小,故易形成重键。
共价半径(单键)/pm:N,70;O,66;F,64;(双键)/pm:N,60;O,55;F,(54);(叁键)/pm:N,55;O,(51);—与氧族元素及卤素比较⑴、本族元素的金属性更强,同族从上到下非金属性向金属性过渡完整。
⑵、ⅥA、ⅦA族元素均存在8-族数的负氧化态离子,本族则只有N和P两元素在固态下个别化合物中有—3氧化态离子,As,Sb,Bi不形成负离子。
第13 章氮、磷、砷13.1 请回答下列有关氮元素性质的问题。
( l )为什么N-N 键的键能(167KJ.mol-1)比P-P 键(201 kJ·mol-1)的小?而N≡N叁键的键能(942 kJ·mol-1)又比P≡P叁键(481 kJ·mol-1 )的大?( 2 )为什么氮不能形成五卤化物?( 3 )为什么NO的第一电离能比N原子的小?解:( l )氮的原子半径比磷的小很多,价层中又有孤对电子,当两个氮原子靠近成键时,电子对间的排斥作用抵消了部分键能,故N-N键的键能比P-P键的小。
但正由于氮原子的半径小,且内层电子也比磷的少,有利于p 轨道的侧向重叠,氮形成多重键的倾向比磷强,故N≡N叁键的键能反比P≡P叁键的大。
( 2 )氮原子的价层只有4个价轨道,只能形成4个共价键,故不能形成含有5个N-X键的NX5。
( 3 )氮原子价电子层半满,稳定。
从NO→NO+是失去π*反键轨道上的电子,故所需的能量比N的IE1 要小得多。
13.2.请回答下列问题:( l )如何除去N2中少量NH3和NH3中的水气?( 2 )如何除去NO中微量的NO2和N2O中少量的NO ?解:( l )将含有少量的NH3的N2气,通入水中除去NH3,NH3中的水气用碱石灰吸收。
( 2 )将含有微量的NO2和N2O通入水中以吸收NO2(用碱液吸收更好)。
将含有少量NO的N2O通入FeSO4溶液中,使NO与FeSO4络合成Fe(NO)SO4。
13.3 以NH3与H2O作用时质子传递情况,讨论H2O,NH3和质子之间键能的强弱:为什么醋酸在水中是一弱酸,而在液氨溶剂中却是强酸?解:2O作用时,质子传递情况为:NH3+H2O NH4++OH-K=1.77×10-5O H3O++OH-K=1.0×10-1422从K值可知:NH3与H+结合的键能比H2O与H+间的键能大。
NH3接受H+的能力比H2O强,故醋酸在液氨中几乎完全电离,表现强酸性;而醋酸在水中则不能完全电离,表现弱酸性。
第13 章氮、磷、砷13.1 请回答下列有关氮元素性质的问题。
( l )为什么N-N 键的键能(167KJ.mol-1)比P-P 键(201 kJ·mol-1)的小?而N≡N叁键的键能(942 kJ·mol-1)又比P≡P叁键(481 kJ·mol-1 )的大?( 2 )为什么氮不能形成五卤化物?( 3 )为什么NO的第一电离能比N原子的小?解:( l )氮的原子半径比磷的小很多,价层中又有孤对电子,当两个氮原子靠近成键时,电子对间的排斥作用抵消了部分键能,故N-N键的键能比P-P键的小。
但正由于氮原子的半径小,且内层电子也比磷的少,有利于p 轨道的侧向重叠,氮形成多重键的倾向比磷强,故N≡N叁键的键能反比P≡P叁键的大。
( 2 )氮原子的价层只有4个价轨道,只能形成4个共价键,故不能形成含有5个N-X键的NX5。
( 3 )氮原子价电子层半满,稳定。
从NO→NO+是失去π*反键轨道上的电子,故所需的能量比N的IE1 要小得多。
13.2.请回答下列问题:( l )如何除去N2中少量NH3和NH3中的水气?( 2 )如何除去NO中微量的NO2和N2O中少量的NO ?解:( l )将含有少量的NH3的N2气,通入水中除去NH3,NH3中的水气用碱石灰吸收。
( 2 )将含有微量的NO2和N2O通入水中以吸收NO2(用碱液吸收更好)。
将含有少量NO的N2O通入FeSO4溶液中,使NO与FeSO4络合成Fe(NO)SO4。
13.3 以NH3与H2O作用时质子传递情况,讨论H2O,NH3和质子之间键能的强弱:为什么醋酸在水中是一弱酸,而在液氨溶剂中却是强酸?解:2O作用时,质子传递情况为:NH3+H2O NH4++OH-K=1.77×10-5O H3O++OH-K=1.0×10-1422从K值可知:NH3与H+结合的键能比H2O与H+间的键能大。
NH3接受H+的能力比H2O强,故醋酸在液氨中几乎完全电离,表现强酸性;而醋酸在水中则不能完全电离,表现弱酸性。
13.4.将下列物质按碱性减弱顺序排序,并给予解释。
NH2OH NH3N2H4PH3AsH3解:碱性减弱次序为:NH3、N2H4、NH2OH 、PH3、AsH3因为按此顺序,各物种中的中心原子负电荷密度减小,对质子的亲和力减弱。
13.5.请解释下列事实:( 1 )为什么可用浓氨水检查氯气管道的漏气? ( 2 )过磷酸钙肥料为什么不能和石灰一起使用贮存? ( 3 )由亚砷酸钠制备As 2O 3,为什么需要在浓的强酸溶液中? 解:( 1 ) 利用NH 3的还原性和Cl 2的氧化性,发生下列反应: 2 NH 3+ 3Cl 2 = N 2 + 6HCl产生的HCl 遇NH 3,产生NH 4Cl 白烟。
( 2 )过磷酸钙主要有效成分为酸性的Ca(H 2PO 4) 2 ,遇碱性石灰会转变为溶解度不大的CaHPO 4或不溶性的Ca 3(PO 4) 2而失去肥效。
( 3 )使AsO 33-转变为As 3+, AsO 33- + 6H + =As 3+ + 3H 2O13.6. 请解释下列有关健长和键角的问题:( 1 )在N 3-离子中.两个N -N 键有相等的键长,而在HN 3 中两个N -N 键长却不相等。
( 2 )从NO +、NO 到NO -的键长逐渐增大。
( 3 ) NO 2+、NO 2 、NO 2-分子中的键角依次为107°、93.08°、9l . 8° ,逐渐减小. ( 4 ) NH 3 、PH 3、AsH 3分子中的键角依次为107°、93.08°、9l . 8° ,逐渐减小。
解:(1)在N 3-离子中N 1- N 2和N 2-N 3间均有σ键和π34键,故两个N —N 键长相等。
而在HN 3中3个N 原子成键情况不同:靠近H 原子的N 1 – N 2间只有σ键和1/2π34键,N 2 – N 3间不仅有σ键、1/2π34键,还有p -pπ键,所以N 2-N 3间的键长比N 1-N 2间的短。
( 2 )从NO +、NO 到NO -,反键轨道上电子数按0 、l 、2 次序增加,故键级减小,键长增大。
( 3 )此小题可有两种解释:一种是按沃尔施(walsh)的轨道能一键角相关图解释。
另一种解释是从成键电子对排斥作用大小分析:在NO 2+中,N 原子采取sp 杂化,故键角为180°:在NO 2和NO 2-中,N 原子采取sp 2,分子(离子)构型为角形,但NO 2分子中由于有π34键,使N 、O 成键原子间电子密度增加,排斥作用增大,故∠ONO 比正常的120° 要大。
在NO 2-中,由于N 原子杂化轨道上孤对电子密度比NO 2大,致使键角压缩,比120°还要小。
( 4 ) NH 3分子中的N 原子价电子层充满电子,而PH 3、AsH 3分子中的P 、As 原子价电子层有空的d 轨道,前者键合电子对间的斥力大于后二者,故NH 3分子中的键角比PH 3、AsH 3 的大。
至于PH 3的键角比AsH 3的稍大,是因为P 的原子半径比As 的小,键合电子对间的排斥作用较大所致。
13.7 已知F 2 、Cl 2 、N 2 的解离能(D)分别为156.9 kJ·mol -1 、242.6 kJ·mol -1和946 kJ·mol -1 ,平均键能N -Cl 、N -F 分别为192.5 kJ·mol -1、276 kJ·mol -1。
试计算NF 3(g)和NCl 3 (l)的标准生成焓,说明何者稳定?指出在玻恩—哈伯循环中哪几步的能量变化对稳定性影响较大?(本题忽略NF 3(g)和NCl 3 (l)间的相变热效应。
) 解:( 1 )1/2 N 2(g) + 3/2 F 2 (g)N(g) + 3F(g)Δf H m (NF 3,g) = 1/2D(N 2,g) + 3/2D(F 2,g) - 3E (N —F)=1/2×946+3/2×156.9-3×276=-117.4 kJ·mol -1Δf H m1/2D -3E (N —F)1/2 N 2(g) + 3/2Cl3(g)N(g) + 3Cl(g)Δf H m (NCl 3,g)= 1/2D(N 2,g) + 3/2D(Cl 2,g) - 3E (N —Cl)=1/2×946+3/2×242.6-3×192.56=259.4 kJ·mol -1计算结果说明NF 3比NCl 3 稳定,影响稳定性的主要能量变化是离解能和键能,因为D F2 < D Cl2而E N -F >E N -Cl ,故导致Δf H m (NF 3,g)<Δf H m (NCl 3,l)13.8 为了测定铵态氮肥中含氮量,称取固体样品0. 2471g ,加过量NaOH 溶液并进行蒸馏,用50.00 mL 、0.1050 mol·dm -3 HCl 吸收蒸出的氨气,然后用0.1022 mol·dm -3NaOH 溶液滴定吸收液中剩余的HCl ,滴定中消耗了11. 69mLNaOH 溶液,试计算肥料中氮的百分含量。
解:生成氨的摩尔数=50/1000×0.1050-11.69/1000×0.1022=0.004055mol肥料中氨的百分含量=(0.004055×14)/0.2471×100%=22.98%13.9 为什么PF 3、PH 3可以和许多过渡金属形成配合物,而NF 3、NH 3几乎不具有这种性质?PF 3、PH 3和过渡金属形成配合物的能力为什么比NF 3、NH 3的强?解:PF 3、PH 3 与过渡金属形成配合物时,除了作为电子对给予体与过渡金属形成σ配位键外,P 原子价层还有空的3d 轨道,可以接受过渡金属反馈的d 电子形成π反馈键,从而增加了配合物的稳定性。
但NF 3、NH 3 中的N 原子价层无空的d 轨道可利用,与过渡金属只能形成σ配位键,无π反馈键形成,所以它们与过渡金属形成配合物的能力不如PF 3、PH 3 。
13.10 红磷长时间放置在空气中逐渐潮解,与NaOH 、CaCl 2在空气中潮解,实质上有什么不同?潮解的红磷为什么可以用水洗涤来进行处理?解:红磷在空气中缓慢被氧化为P 4O 10,由于该氧化物吸水性极强而潮解;NaOH 、CaCl 2是由于吸收水气后生成水合物而潮解,两者有本质不同。
用水洗涤是把已氧化的那部分P 4O 10溶于水后除去,而未氧化的红磷不溶于水,经小心烘干后仍可使用,但应密闭保存,防止氧化而潮解。
13.11 在同素异形体中,菱形硫和单斜硫有相似的化学性质,而O 2与O 3,黄磷和红磷的化学性质却有很大差异,试加以解释。
解: 单斜硫与斜方硫都是S 8环状分子组成,仅仅晶系不同(单斜与正交),故它们有相似的化学性质。
而O 2与O 3的分子中原子个数不同,成键情况也不同,故化学性质有很大差异。
同理,黄磷与红磷也是由于分子结构不同导致化学性质差异,前者为P 4四面体组成的分子晶体,后者则为链状结构。
13.12 回答下列有关硝酸的问题:( 1 )根据HNO 3的分子结构,说明HNO 3为什么不稳定? ( 2 )为什么久置的浓HNO 3会变黄?( 3 )若将一定质量的Ag 溶于最少量的硝酸,应使用何种浓度(浓或稀)的硝酸? 解: ( 1 ) HNO 3分子中N 处于最高氧化态,无d 轨道不能生成反馈键,分子中与H 相连的N -O 键比其它两个N -O 键较长(这两个N -O 键中有π34键成分),具有较大的不对称性, 因而不稳定。
1/2D -3E (N —Cl)Δf H( 2 )因为HNO 3 见光分解:4HNO 3 === 4NO 2↑+ 2H 2O + O 2↑ NO 2溶于HNO 3使其变黄( 3 )根据浓、稀HNO 3和Ag 的反应式:3Ag + 4HNO 3(稀)= 3AgNO 3 + NO↑+ 2H 2O Ag + 2HNO 3(浓)= AgNO 3 + NO 2↑+ H 2O 应使用稀HNO 3。
13.13若将0.0001molH 3PO 4加到PH =7 的1L 缓冲溶液中(假定溶液的体积不变),计算在此溶液中H 3PO 3、H 2PO 4-、HPO 42-、PO 43-的浓度.解:因为溶液是缓冲溶液,故假定加入H 3PO 4pH 不变,即[H +]不变,每种离子浓度的比值仅和电离常数有关。
[H 3PO 4]/ [H 2PO 4-] =[H +]/K 1 = 1.0×10-7 /7.5×10-3=1.3×10-5 [H 2PO 4-]/[ HPO 42-]=[H +]/K 2 = 1.0×10-7 /6.2×10-8=1.6 [HPO 42-]/[ PO 43-]=[H +]/K 3 = 1.0×10-7 /2.2×10-13=4.5×105 因为[H 3PO 4]/[ H 2PO 4-]比值非常小,[HPO 42-]/[ PO 43-]比值非常大,所以,四种物种中,主要存在的是H 2PO 4-和HPO 42-,两者总浓度是1.0×10-4 mol·dm -3 [H 2PO 4-]+[HPO 42-]=1.0×10-4 mol·dm -3 设[HPO 42-]=x [H 2PO 4-]=1.0×10-4-x (0.00010-x )/x =1.6 x =3.8×10-5 [H 2PO 4-]=1.0×10-4-3.8×10-5=6.2 ×10-5 [H 3PO 4] =1.3 ×10-5 ×6.2 ×10-5=8.1 ×10-10[PO 43-]=[HPO 42-]/4.5 ×105=3.8×10-5/4.5 ×105=8.4 ×10-1113.14 试从平衡移动的原理解释为什么在Na 2HPO 4或NaH 2PO 4溶液中加入AgNO 3溶液,均析出黄色的沉淀Ag 3PO 4?析出Ag 3PO 4沉淀后,溶液的酸碱性有何变化?写出相应的反应方程式。