无机化学第15章 氮族元素习题演示教学
- 格式:doc
- 大小:119.00 KB
- 文档页数:11


第十五章氮族元素一选择题 1. 氮气制备的方法是() A.将硝酸氨NHNO加热 B. 将亚硝酸氨NHNO加热 4342 C.将氯气与氨气混合 D. B和C 2. 下列化合物中与水反应放出HCl的是() A. CCl B. NCl C. POCl D.ClO 433273. NO溶解在NaOH溶液中可得到() 2A. NaNO和HO B. NaNO、O和HO 22222C. NaNO、NO和HO D. NaNO、NaNO和HO 3252322 4. 硝酸盐加热分解可以得到单质的是() A. AgNO B. Pb(NO) C. Zn(NO) D. NaNO 332323 5. 下列分子中具有顺磁性的是()A. NOB. NOC. NOD. NO 22234 6. 下列分子中,不存在离域键的是() (吉林大学《无机化学例题与习题》) 3 A. HNO B. HNO C. NO D. N322 3 7.分子中含d—p反馈键的是() (吉林大学《无机化学例题与习题》) A. HNO B. HNO C. HPO D. NH 32323 8. 下列物质中酸性最强的是() A. NH B. NHOH C. NH D. HN 242 33 9. 下列酸中为一元酸的是() (吉林大学《无机化学例题与习题》) A. HPO B. HPO C. HPOD. HPO 427323334 10. 下列各物质按酸性排列顺序正确的是()(吉林大学《无机化学例题与习题》) A. HNO>HPO>HPO B. HPO>HPO>HNO 234427427342C. HPO>HNO>HPO D. HPO>HPO>HNO 427234344272 11. 下列物质中,不溶于氢氧化钠溶液的是()(吉林大学《无机化学例题与习题》) A.Sb(OH) B. Sb(OH) C. HAsO D. Bi(OH) 35343 12. 加热分解可以得到金属单质的是() (吉林大学《无机化学例题与习题》) A. Hg(NO) B. Cu(NO) C. KNO D. Mg(NO) 323233213. NHNO受热分解产物为() 43 A. NH+HNO B. N+H OC. NO+HOD. NO+HO 3222222 14. 下列物质中受热可得到NO的是() 2A. NaNO B. LiNO C. KNO D. NHNO 33343 15. 下列氢化物中,热稳定性最差的是() A. NH B. PH C. AsH D. SbH 3333 16. 遇水后能放出气体并有沉淀生成的是()(吉林大学《无机化学例题与习题》) A.Bi(NO) B. MgN C. (NH)SO D. NCl 32324243 17. 下列物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是()A. KCrO B. NaBiO C. (NH)SO D. HIO 2273422856 18. 下列化合物中,最易发生爆炸反应的是() A.Pb(NO) B. Pb(N) C. PbCOD. KCrO 32323 24 19. 欲制备NO气体,最好的实验方法是() A. 向酸化的NaNO溶液中滴加KI溶液 2 B. 向酸化的KI溶液中滴加NaNO溶液 2-3C.Zn粒与2mol·dmHNO反应 3 D. 向双氧水中滴加NaNO溶液220. N和CH分子中都含有键,但的化学性质不活泼。


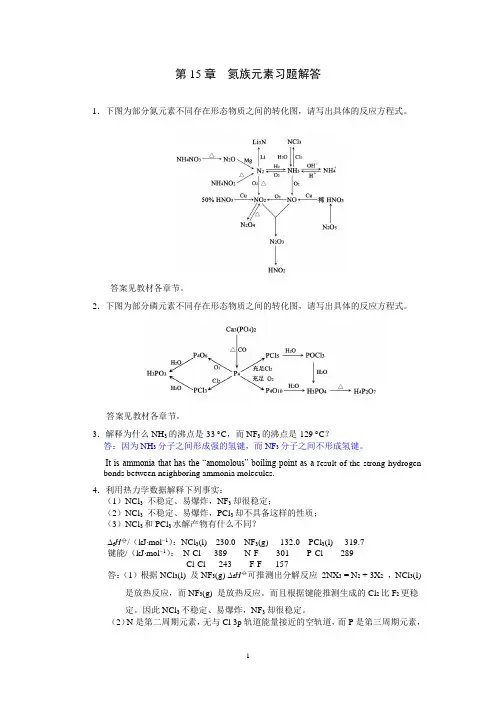
第15章氮族元素习题解答1.下图为部分氮元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为部分磷元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.解释为什么NH3的沸点是-33 ︒C,而NF3的沸点是-129 ︒C?答:因为NH3分子之间形成强的氢键,而NF3分子之间不形成氢键。
It is ammonia that has the “anomolous” boiling point as a r esult of the strong hydrogen bonds between neighboring ammonia molecules.4.利用热力学数据解释下列事实:(1)NCl3不稳定、易爆炸,NF3却很稳定;(2)NCl3不稳定、易爆炸,PCl3却不具备这样的性质;(3)NCl3和PCl3水解产物有什么不同?∆f H/(kJ⋅mol-1):NCl3(l) 230.0 NF3(g) -132.0 PCl3(l) -319.7键能/(kJ⋅mol-1):N-Cl 389 N-F 301 P-Cl 289Cl-Cl 243 F-F 157答:(1)根据NCl3(l) 及NF3(g) ∆f H可推测出分解反应2NX3 = N2 + 3X2,NCl3(l) 是放热反应,而NF3(g) 是放热反应。
而且根据键能推测生成的Cl2比F2更稳定。
因此NCl3不稳定、易爆炸,NF3却很稳定。
(2)N是第二周期元素,无与Cl 3p轨道能量接近的空轨道,而P是第三周期元素,最低空轨道是3d轨道,与Cl的3p轨道能量接近,形成的PCl3中的P-Cl键除σ键以外,还有p-d 反馈π键,使P-Cl 键键级大于1,相对稳定。
所以NCl3不稳定、易爆炸,PCl3却不具备这样的性质。
(3)NCl3水解是亲电水解,产物是NH3和HOCl;PCl3水解是亲电加亲核水解,产物H3PO3和HCl。

第15课 氮族元素(建议2课时)[课程目标]1.认识氮族元素以及在周期表中的位置和原子结构特点2.掌握N 2的性质、了解氮的主要用途3.掌握NO 、NO 2的重要性质及其与环境的关系4.了解氨的物理性质,掌握氨的化学性质及氨的实验室制法5.了解铵盐的性质,掌握铵根离子的检验方法6.掌握硝酸的化学性质,了解硝酸的用途[要点精讲]一、氮族元素氮族元素包括N (氮)、P (磷)、As (砷)、Sb (锑)、Bi (铋)5种元素。
在元素周期表中位于ⅤA 族,最高正化合价为+5价,最高价氧化物的通式为R 2O 5 ,其对应水化物通式为HRO 3或H 3RO 4 。
最低负化合价为–3价,其氢化物通式为RH 3 。
氮族元素原子结构的异同点:相同点——最外层都是5个电子;不同点——电子层数逐渐增多,原子半径逐渐增大。
氮族元素化学性质上主要递变规律:从上到下,元素的非金属性逐渐减弱,金属性逐渐增强。
最高价氧化物的水化物的酸性逐渐减弱;气态氢化物(RH 3)的热稳定性逐渐减弱,还原性逐渐增强;二、氮气与氮的固定1、氮气的物理性质:无色、无味气体,难溶于水,难液化,空气中含78%(体积分数)的氮气。
沸点为–195.8℃,熔点为–209.9℃2、分子结构:N ;N ≡N ;氮氮叁键键能很高。
3、化学性质:常温稳定,高温活泼。
(1)还原性:N 2 + O 2 ==== 2NO(2)氧化性:N 2 + 3H 2 2NH 34、用途:合成氨、制硝酸、作保护气等。
5、氮的固定:使空气中游离态的氮转化为含氮化合物的方法叫做氮的固定。
氮的固定主要有自然固氮和人工固氮。
自然固氮的途径主要有两种:一种是通过闪电等产生含氮化合物的高能固氮(约占自然固氮的10%);另一种是生物固氮,即自然界中的一些微生物种群(如豆科植物的根瘤菌)将空气中的氮气通过生物化学过程转化为含氮化合物(约占自然固氮的90%)。
合成氨属于人工固氮,即工业固氮。
此外还发现某些金属有机化合物可以起到根瘤菌的作用,以此做催化剂实现了常温、常压固氮,即仿生固氮。

第十五章氮族元素一选择题1. 氮气制备的方法是()A. 将硝酸氨NH4NO3加热B. 将亚硝酸氨NH4NO2加热C. 将氯气与氨气混合D. B和C2. 下列化合物中与水反应放出HCl的是()A. CCl4B. NCl3C. POCl3D. Cl2O73. NO2溶解在NaOH溶液中可得到()A. NaNO2和H2OB. NaNO2、O2和H2OC. NaNO3、N2O5和H2OD. NaNO3、NaNO2和H2O4. 硝酸盐加热分解可以得到单质的是()A. AgNO3B. Pb(NO3)2C. Zn(NO3)2D. NaNO35. 下列分子中具有顺磁性的是()A. N2OB. NOC. NO2D. N2O36. 下列分子中,不存在离域键的是()(吉林大学《无机化学例题与习题》)A. HNO3B. HNO2C. N2OD.7. 分子中含d—p反馈键的是()(吉林大学《无机化学例题与习题》)A. HNO3B. HNO2C. H3PO2D. NH38. 下列物质中酸性最强的是()A. N2H4B. NH2OHC. NH3D. HN39. 下列酸中为一元酸的是()(吉林大学《无机化学例题与习题》)A. H4P2O7B. H3PO2C. H3PO3D. H3PO410. 下列各物质按酸性排列顺序正确的是()(吉林大学《无机化学例题与习题》)A. HNO2>H3PO4>H4P2O7B. H4P2O7>H3PO4>HNO2C. H4P2O7>HNO2>H3PO4D. H3PO4>H4P2O7>HNO211. 下列物质中,不溶于氢氧化钠溶液的是()(吉林大学《无机化学例题与习题》)A. Sb(OH)3B. Sb(OH)5C. H3AsO4D. Bi(OH)312. 加热分解可以得到金属单质的是()(吉林大学《无机化学例题与习题》)A. Hg(NO3)2B. Cu(NO3)2C. KNO3D. Mg(NO3)213. NH4NO3受热分解产物为()A. NH3+HNO2B. N2+H2OC. NO+H2OD. N2O+H2O14. 下列物质中受热可得到NO2的是()A. NaNO3B. LiNO3C. KNO3D. NH4NO315. 下列氢化物中,热稳定性最差的是()A. NH3B. PH3C. AsH3D. SbH316. 遇水后能放出气体并有沉淀生成的是()(吉林大学《无机化学例题与习题》)A. Bi(NO3)2B. Mg3N2C. (NH4)2SO4D. NCl317. 下列物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是()A. K2Cr2O7B. NaBiO3C. (NH4)2S2O8D. H5IO618. 下列化合物中,最易发生爆炸反应的是()A. Pb(NO3)2B. Pb(N3)2C. PbCO3D. K2CrO419. 欲制备NO气体,最好的实验方法是()A. 向酸化的NaNO2溶液中滴加KI溶液B. 向酸化的KI溶液中滴加NaNO2溶液C. Zn粒与2mol·dm-3HNO3反应D. 向双氧水中滴加NaNO2溶液20. N 2和C2H2分子中都含有键,但的化学性质不活泼。



第一节 氮和磷1 关于氮族元素的说法中正确的是 ( )。
A.最高正价都是+5价,最低负价都是-3价B.随着原子序数的增大,原子半径逐渐增大C.单质的熔、沸点随着原子序数的增大而升高D.所形成的气态氢化物以BiH3最不稳定2 氮气是一种很不活泼的气体,其根本原因是( )。
A.氮元素的非金属性较弱B.氮原子半径小,核对外层电子吸引力较强C.氮气为双原子分子D.使NN键断裂需要很高的能量3 填空(1)磷在自然界里主要以___________的形式存在于矿石中。
磷的单质有多种同素异形体,其中最常见的是有毒的___________和无毒的___________。
(2)磷在不充足的氯气中燃烧的化学方程式为:___________,而在过量的氯气中燃烧的化学方程式是:___________。
(3)磷在空气中燃烧生成的氧化物通常可用作强干燥剂。
制备100g这种干燥剂所消耗的空气的体积约为___________(在标准状况下)。
4 容积为10mL的试管中充满NO2和O2的混合气体,倒立于盛水的水槽中:(1)若水全部充满试管,则原混合气体中NO2与O2的体积分别为______________mL,_____________mL。
(2)若最后剩余气体为1mL,则原混合气体中NO2的体积可能是___________mL。
第二节 氨 铵盐1 氨是一种重要的致冷剂,这是因为 ( )。
A.它在常温下是一种气体B.氨极易溶于水C.液氨气化时吸收大量的热量D.氮的化合价为-3价2 室温时,在体积相同的容器内混合下列气体,混合后压强最小的是( )。
A.100mLH2和50mLO2B.100mLHCl和100mLNH3C.100mLNO和100mLO2D.100mLN2和200mLH23 为了更简便制取干燥NH3,下列方法中适合的是( )。
A.NH4Cl与H2SO4(浓)混合加热,生成的气体用碱石灰进行干燥B.N2+H2NH3,用烧碱干燥C.加热浓氨水,气体用碱石灰干燥D.加热NH4HCO3,气体用P2O5干燥4 为确定两种氮肥的组成,进行下列实验:(1)取少量样品与消石灰共热,放出可使湿润的红色石蕊试纸变蓝的气体,此气体为___________,证明化肥中含有___________离子。
无机化学第15章氮族元素习题(总11页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除第15章氮族元素15-1 给出下列物质的化学式。
(1)雄黄;(2)雌黄;(3)辉锑矿;(4)锑硫镍矿;(5)辉铋矿;(6)砷华;(7)锑华;(8)铋华解:(1)As4S4;(2)As2S3;(3)Sb2S3;(4)NiSbS;(5)Bi2S3;(6)As2O3;(7)Sb2O3;(8)Bi2O315-2 在稀硫酸介质中完成并配平下列反应的方程式。
(1)I-+NO2- ------(2)NH4++NO2- ------(3)MnO4-+NO2- ------(4)MnO4-+As2O3------(5)NaBiO3+Mn2+ ------(6)H3PO3+NO2- ------(7)I-+AsO43- ------(8)N2H4+NO2- ------(9)N2H4+AgCl------(10)As2O3+Zn------解:(1)2I-+2NO2-+4H+ ═== I2+2NO↑+2H2O(2)NH4++NO2-∆===N2+2H2O(3)4MnO4-+5NO2-+6H+ === 2Mn2++5NO3-+5H2O(4)4MnO4-+5As2O3+9H2O+2H+ ===4 Mn2++10H2AsO4-(5)5NaBiO3+2Mn2++14H+ === 5Bi3++2MnO4-+5Na++7H2O (6)H3PO3+NO2-+2H+ === H3PO4+2NO↑+H2O(7)2I-+AsO43-+2H+ === I2+AsO33-+H2O(8)N2H4+NO2-+H+ === HN3+2H2O(9)N2H4+4AgCl === 4Ag+N2↑+4HCl(10)As2O3+6Zn+12H+ === 2AsH3↑+6Zn2++H2O15-3 完成并配平下列NaOH溶液参与的反应。
第15讲氮及其化合物【考纲要求】 1.掌握氮单质及其重要化合物的主要性质及应用。
2。
了解氮单质及其重要化合物对环境的影响。
考点一|氮气和氮的氧化物(基础送分型—-自主学习)授课提示:对应学生用书第74页[巩固教材知识]1.氮气写出有关化学方程式:①N2+3Mg错误!Mg3N2;②N2+3H2错误!2NH3;③N2+O2错误!2NO。
2.氮的氧化物氮有多种价态的氧化物,如N2O、NO、N2O3、NO2、N2O4、N2O5等NO NO2物理性质通常为无色气体,难溶于水通常为红棕色、有刺激性气味的气体化学性质与O2反应2NO+O2===2NO2与H2O反应不反应3NO2+H2O===2HNO3+NO与人体、环境的关系①NO与人体血红蛋白结合,使人中毒;②NO转化成NO2,形成酸雨,光化学烟雾,破坏臭氧层(1)标准状况下,6.72 L NO2与水充分反应转移的电子数目为0。
1N A.()(2)制二氧化氮时,用水或NaOH溶液吸收尾气.( )(3)工业上利用合成氨实现人工固氮涉及氧化还原反应。
()(4)NO2与水反应的离子方程式:3NO2+H2O===2H++2NO错误!+NO。
( )(5)NO2通入FeSO4溶液中始终无明显现象.()(6)在实验室里,NO和NO2均可用排水法收集。
( )(7)NO能够与人体里血红蛋白结合,造成人体缺氧中毒.( )答案:(1)×(2)×(3)√(4)√(5)×(6)×(7)√[练透基础小题]题点一NO、NO2的性质及对环境的影响1.下列环境问题与NO2的排放有关的是________。
(填字母)A.酸雨 B.臭氧空洞C.温室效应D.光化学烟雾E.PM2。
5F.水体富营养化答案:ABDF2.写出俗语“雷雨发庄稼”中所涉及的三个化学反应方程式。
(1)________________________________________________________________________;(2)________________________________________________________________________;(3)________________________________________________________________________。
第15章氮族元素15-1 给出下列物质的化学式。
(1)雄黄;(2)雌黄;(3)辉锑矿;(4)锑硫镍矿;(5)辉铋矿;(6)砷华;(7)锑华;(8)铋华解:(1)As4S4;(2)As2S3;(3)Sb2S3;(4)NiSbS;(5)Bi2S3;(6)As2O3;(7)Sb2O3;(8)Bi2O315-2 在稀硫酸介质中完成并配平下列反应的方程式。
(1)I-+NO2- ------(2)NH4++NO2- ------(3)MnO4-+NO2- ------(4)MnO4-+As2O3------(5)NaBiO3+Mn2+ ------(6)H3PO3+NO2- ------(7)I-+AsO43- ------(8)N2H4+NO2- ------(9)N2H4+AgCl------(10)As2O3+Zn------解:(1)2I-+2NO2-+4H+ ═== I2+2NO↑+2H2O(2)NH4++NO2-∆===N2+2H2O(3)4MnO4-+5NO2-+6H+ === 2Mn2++5NO3-+5H2O(4)4MnO4-+5As2O3+9H2O+2H+ ===4 Mn2++10H2AsO4-(5)5NaBiO3+2Mn2++14H+ === 5Bi3++2MnO4-+5Na++7H2O (6)H3PO3+NO2-+2H+ === H3PO4+2NO↑+H2O(7)2I-+AsO43-+2H+ === I2+AsO33-+H2O(8)N2H4+NO2-+H+ === HN3+2H2O(9)N2H4+4AgCl === 4Ag+N2↑+4HCl(10)As2O3+6Zn+12H+ === 2AsH3↑+6Zn2++H2O15-3 完成并配平下列NaOH溶液参与的反应。
(1)NaOH+P4------(2)NaOH(过量)+H3PO2------(3)NaOH+As2S3------(4)NaOH+Sb(OH)3------(5)NaOH+NCl3------(6)NaOH+NO2------(7)NaOH(过量)+As 2O 3------(8)NaOH(过量)+H 3PO 3------解:(1)3NaOH+P 4+3H 2O === 3NaH 2PO 2+PH 3↑(2)NaOH(过量)+H 3PO 2=== NaH 2PO 2+H 2O(3)6NaOH+As 2S 3 === Na 3AsO 3+Na 3As 3+3H 2O(4)3NaOH+Sb(OH)3 === Na 3SbO 3+3H 2O(5)3NaOH+NCl 3 === NH 3+3NaClO(6)2NaOH+2NO 2 === NaNO 2+NaNO 3+H 2O(7)6NaOH(过量)+As 2O 3 === 2Na 3AsO 3+3H 2O(8)2NaOH(过量)+H 3PO 3 === Na 2HPO 3+2H 2O15-4 完成并配平下列浓硝酸参与的反应。
(1)HNO 3(浓)+As------(2)HNO 3(浓)+Bi------(3)HNO 3(浓)+Sb 2O 3------(4)HNO 3(浓)+NaNO 2------(5)HNO 3(浓)+ Bi 2S 3------解:(1)5HNO 3(浓)+As === H 3AsO 4+5NO 2↑+H 2O(2)6HNO 3(浓)+Bi === Bi(NO 3)3+3NO 2↑+3H 2O(3)4HNO 3(浓)+Sb 2O 3+H 2O === 2H 3SbO 4+4NO 2↑(4)2HNO 3(浓)+NaNO 2 === 2NO 2↑+NaNO 3+H 2O(5)30HNO 3(浓)+ Bi 2S 3 === 2Bi(NO 3)3+3H 2SO 4+24NO 2↑+12H 2O15-5 给出下列物质受热分解的反应方程式。
(1)LiNO 3; (2)KNO 3; (3)AgNO 3;(4)Bi(NO 3)3; (5)Pb(NO 3)2; (6)Fe(NO 3)2;(7)NH 4NO 3; (8)(NH 4)2CO 3; (9)(NH 4)2Cr 2O 7;(10)NH 4Cl ; (11)NaNH 2; (12)Pb(N 3)2;(13)NaNO 2; (14)AgNO 2;解:(1)4LiNO 3 ===2 Li 2O+4NO 2↑+O 2↑(2)2KNO 3 === 2KNO 2+O 2↑(3)2AgNO 3 === 2Ag+2NO 2↑+O 2↑(4)4Bi(NO 3)3 === 2Bi 2O 3+12NO 2↑+3O 2↑(5)2Pb(NO 3)2 === 2PbO+4NO 2↑+O 2↑(6)4Fe(NO 3)2 === Fe 2O 3+8NO 2↑+O 2↑(7)NH 4NO 3 C︒>===200 N 2O↑+H 2O2NH 4NO 3 C ︒===300 2N 2↑+O 2↑+4H 2O(8)(NH4)2CO3 === 2NH3↑+CO2↑+H2O(9)(NH4)2Cr2O7 === Cr2O3+N2↑+4H2O(10)NH4Cl === NH3↑+HCl↑(11)2NaNH2 === 2Na+N2↑+2H2↑(12)Pb(N3)2 === Pb+3N2↑(13)2NaNO2 === Na2O+NO2↑+NO↑(14)AgNO2 === Ag+NO2↑15-6 给出下列物质的水解反应方程式,并说明NCl3水解产物与其他化合物的水解产物有何本质区别?为什么?(1)NCl3;(2)PCl3;(3)AsCl3;(4)SbCl3;(5)BiCl3;(6)POCl3;解:(1)NCl3+3H2O === NH3↑+3HClO(2)PCl3+3H2O === H3PO3+3HCl(3)AsCl3+3H2O === H3AsO3+3HCl(4)SbCl3+H2O === SbOCl↓+2HCl(5)BiCl3+H2O === BiOCl↓+2HCl(6)POCl3+3H2O === H3PO4+3HClNCl3水解产物既有酸HClO,又有碱NH3,而同族AsCl3和PCl3水解产物为两种酸。
P和As的电负性都小于Cl,AsCl3和PCl3水解时呈正电性的P3+和As3+与水解离出的OH—结合,呈负电性的Cl—与水解离出的H+结合,生成两种酸。
周期数较高的Sb和Bi金属性较强,Sb3+和Bi3+与OH-的结合较弱,故SbCl3和BiCl3水解不彻底,分别生成SbOCl,BiOCl沉淀和HCl。
N和Cl的电负性相近,NCl3中半径小的N的孤电子对向H2O中的H配位,N 与H成键并脱去Cl,最终生成NH3;NCl3中半径大的Cl和由水释放出的OH—结合,生成HClO。
15-7 用反应方程式表示下列制备过程。
(1)由NaNO3制备HNO2溶液;(2)由BiCl3制备NaBiO3;(3)由SbCl3制备较纯净的Sb2S5。
解:(1)将NaNO3制备加热分解,得到NaNO2固体。
2NaNO3 ∆===2NaNO2+O2↑将NaNO2配制成饱和溶液,冰浴冷却至近0℃,加入在冰浴中冷却至近0℃的稀硫酸:NO2-+H+ === HNO2(2)向BiCl3溶液中加入过量NaOH溶液,滴加氯水或NaClO溶液,水浴加热,有土黄色NaBiO3沉淀生成:BiCl3+3NaOH === Bi(OH)3+3NaClBi(OH)3+Cl2+3NaOH === NaBiO3↓+3H2O+2NaCl(3)向SbCl3溶液中加入适量NaOH溶液和氯水,生成Sb(OH)5沉淀生成:SbCl3+Cl2+5NaOH === Sb(OH)5↓+5NaCl过滤洗涤Sb(OH)5沉淀。
加入过量Na2S溶液,生成Na3SbS4溶液:Sb(OH)5+4Na2S === Na3SbS4+5NaOH向溶液中小心滴加稀盐酸,析出Sb2S5沉淀:2Na3SbS4+6HCl === Sb2S5↓+3H2S↑+6NaCl15-8 如何配制SbCl3和Bi(NO3)3溶液?解:SbCl3和Bi(NO3)3都易水解生成沉淀:SbCl3+H2O === SbOCl↓+2HClBi(NO3)3+H2O === BiONO3↓+2HNO3为避免水解,在配制溶液时先将一定量的盐溶于酸中,再稀释到所需体积即可。
配制SbCl3溶液时,先将SbCl3水合晶体溶于1:1盐酸中;配制Bi(NO3)3溶液时,先将Bi(NO3)3水合晶体溶于1:1硝酸中。
15-9 分别用三种方法鉴定下列各对物质。
(1)NaNO2和NaNO3;(2)NH4NO3和NH4Cl;(3)SbCl3和BiCl3;(4)NaNO3和NaPO3;(5)Na3PO4和Na2SO4;(6)KNO3和KIO3解:(1)向两种盐的溶液中分别加入酸性KMnO4溶液,能使KMnO4溶液褪色的是NaNO2,另一种盐是NaNO3:2MnO4-+5NO2-+6H+ === 2Mn2++5NO3-+3H2O将两种盐的溶液分别用HAc酸化,再加入KI,颜色变黄、有I2生成的是NaNO2,无明显变化的是NaNO3:2HNO2+2I-+6H+ === I2+2NO↑+2H2O向两种盐的溶液中加入AgCl溶液,有黄色沉淀生成的是NaNO2,另一种盐是NaNO3:Ag++NO2- === AgNO2↓(2)向两种盐的溶液中加入AgNO3溶液,有黄色沉淀生成的是NH4NO3,另一种盐是NH4Cl:Ag++Cl- === AgCl↓向两种盐的溶液中分别加入酸性KMnO4溶液,能使KMnO4溶液褪色的是NH4NO3,另一种盐是NH4Cl:10Cl-+2MnO4-+16H+ === 2Mn2++5Cl2↑+8H2O取少量两种盐晶体分别装入两支试管中,加入FeSO4,加水溶解后沿着试管壁加浓硫酸,在浓硫酸与上层溶液的界面处有棕色环生成的是NH4NO3,另一种盐是NH4Cl:NO3-+3Fe2++4H+ === NO+3Fe3++2H2ONO+Fe2+ === Fe(NO)2+ (棕色)(3)将两种盐溶于水,分别滴加NaOH溶液至过量,先有白色沉淀生成而后沉淀又溶解的是SbCl3,加NaOH溶液生成的白色沉淀不溶于过量NaOH溶液的是BiCl3:Sb3++3OH- === Sb(OH)3↓Sb(OH)3+3OH- === SbO33-+3H2OBi3++3OH- === Bi(OH)3↓将两种盐溶于稀盐酸,分别加入溴水,能使溴水褪色的是SbCl3,另一种盐是BiCl3:Sb3++Br2 === Sb5++2Br-向两种盐溶液中加入NaOH和NaClO溶液,微热,有土黄色沉淀生成的是BiCl3,另一种盐是SbCl3:Bi3++ClO-+4OH-+Na+ === NaBiO3↓+2H2O+Cl-(4)向两种盐溶液中加入AgNO3溶液,有白色沉淀生成的是NaPO3,另一种盐是NaNO3:Ag++PO3- === AgPO3↓分别将两种盐酸化后煮沸,这时偏磷酸盐PO3-将转化为正磷酸盐PO43-。