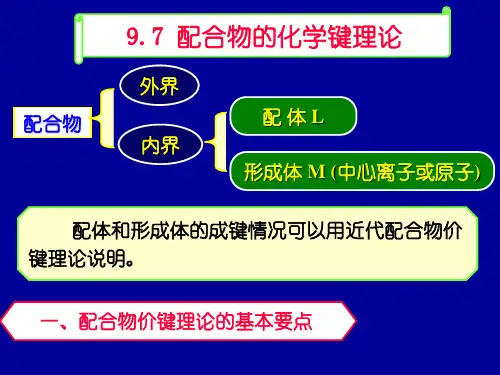
高中化学 配合物的配位键理论
- 格式:pdf
- 大小:524.74 KB
- 文档页数:3

第二章配合物的化学键理论配合物的化学键理论:中心离子与配位体之间的化学键。
第一节配合物的静电理论静电理论的基本观点:认为中心离子是带正电荷的粒子,而配位体是带负电荷的粒子,配合物中的配位键是由单纯的静电相互吸引而形成的,形成配合物的结合能有两项:1 配体与中心离子的吸引能2 配体与配体之间的排斥能U结合=U吸引+U排斥有一些现象不能很好解释:配体一定时,半径相近的金属离子与之形成的配合物的稳定性应相近。
如Na b半径为0.95, Cu+半径为0.96形成的配合物的稳定性却相差很大改进的静电理论:静电极化理论,即中心离子和配位体在静电的作用下,相互会产生变形,中心离子的正电荷可吸引配体的电子,而配体的负电荷则排斥中心离子的电子。
1 自己变形两方面的作用2 使对方变形Na b , K+ , Mg2+ , Ca2+等离子,具有8电子结构,极化弱,因而与配体配位时,变形小Cu2+,Ag+ , Zn2+ , Cd2+等离子,具有18电子结构,极化强,与配体配位时,变形大规则:中心离子具有较强的极化作用或变形性强,与变形性强的配位体配位时,形成的配合物稳定静电理论的评价:提出较早,对早期的配合物的化学键理论有贡献。
不足之处:1 不能解释象Ni(CO)4这样的配合物2 不能解释配合物的磁性和光谱第二节价键理论Sidywich 的配键理论主要的价键理论 Pauling 的电价和共价配位理论 Taube 的内轨和外轨理论主要介绍的价键理论的内容:1 Pauling 提出的杂化轨道理论 2 Taube 提出的内轨和外轨理论 IIIB IVB VB VIB VIIB VB IB IIB Sc Ti V Cr Mn Fe Co Ni Cu Zn 3d 1 4S 2 3d 2 4S 2 3d 3 4S 2 3d 5 4S 1 3d 5 4S 2 3d 6 4S 2 3d 7 4S 2 3d 8 4S 2 3d 94S 13d 10 4S 2Pauling 杂化轨道理论,用于处理配合物的形成其基本假设:中心离子,主要指过渡金属离子的价电子层中能量相近的(n-1)d, ns, np 或nd 轨道杂化后,形成能量等同的杂化轨道,接受配体的孤对电子而形成配合物,Pauling 称这种成键方式形成的为共价配合物。



第3课时配合物理论简介一配位键1.配位键的概念是成键原子一方提供孤电子对,另一方提供空轨道形成的共价键,是一类特殊的共价键。
2.配位键表示方法:A→B,其中A是,B是。
如:NH4+3.配位键的形成条件①成键原子一方能提供孤电子对。
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
①成键原子另一方能提供空轨道。
如H+、Al3+、B及过渡金属的原子或离子。
4.配位键的特点:配位键是σ键,特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
5.常见含配位键的物质:NH+4、H3O+、CO、AlO2-、[B(OH)4]-、H2SO4二配位化合物1.配合物的概念把与某些以结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH、NH4Cl等均为配合物。
2.配合物的形成上述实验现象产生的原因主要是配离子的形成。
以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为3.配合物的组成配合物[Cu(NH3)4]SO4其组成如下图所示:(1)中心原子是提供空轨道接受孤电子对的原子。
中心原子一般都是带正电荷的阳离子(此时又叫中心离子),过渡金属离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。
(2)配体是提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。
配体中直接同中心原子配位的原子叫做配位原子。
配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O 中的O原子等。
(3)配位数是直接与中心原子形成的配位键的数目。
如[Fe(CN)6]4-中Fe2+的配位数为6。
形成配合物的条件形成配合物的中心原子(离子)必须存在空轨道,配体一般都存在着孤电子对。



化学配合物的知识点总结1. 配位键与配合物的结构配合物的形成是通过中心金属离子和配体之间的配位键建立起来的。
配位键是指配体中的一个或多个原子通过配位作用共享其电子对与中心金属离子相结合形成的一种化学键。
在配合物中,中心金属离子通常有一个或多个孤对电子,这些孤对电子能够与配体的空轨道形成配位键,从而形成稳定的配合物结构。
配合物的结构通常由中心金属离子的电子排布、配体的类型和数目、配合物的对称性等因素决定。
各种类型的配合物可以表现出不同的结构特征,包括线性、方形平面、正八面体、正六面体等。
这些结构不仅影响着配合物的稳定性和性质,还为配合物的合成、分离和应用提供了重要的参考依据。
2. 配合物的性质化学配合物具有一系列独特的性质,这些性质不仅由中心金属离子和配体的性质决定,还与配合物的结构、对称性以及化学环境等因素密切相关。
首先,配合物具有特定的颜色。
这是因为配合物中的中心金属离子处于不同的价态或配位数时,会吸收或发射特定波长的光,从而表现出不同的颜色。
例如,铬离子在不同的配位环境中可以呈现出不同的颜色,从淡黄色到深绿色不等。
其次,配合物的稳定性和溶解性也是其重要的性质之一。
稳定性取决于中心金属离子和配体之间的配位键的强度和配位数,而溶解性则受到配合物结构的影响。
一般来说,高配位数的配合物在水溶液中较为稳定,且溶解度较高;而低价态的配合物则通常在有机溶剂中更为稳定。
此外,配合物还具有一定的化学反应活性。
例如,配合物中的配体通常可以发生置换反应或配体开环反应,从而形成新的配合物结构。
这些反应活性不仅为配合物的合成和应用提供了可能,还为配合物在生物学、医学及环境保护等领域的应用打下了基础。
3. 配合物的合成与应用配合物可以通过许多不同的合成方法来制备,包括溶液法合成、固相反应合成、气相反应合成等。
这些方法通常根据中心金属离子和配体的性质、反应条件的选择以及所需的配合物结构来进行优化,以获得高收率和高纯度的产物。

大一配位化学知识点配位化学是无机化学中的重要分支,研究金属离子和配体之间的配位作用及配位化合物的性质。
在大一的学习中,我们也会接触到一些基本的配位化学知识点,下面将介绍其中几个重要的概念和原理。
一、配位键理论配位键理论是配位化学的基础,它描述了金属离子和配体之间形成的配位键。
根据配体对金属离子的电子供应方式,配位键可以分为配体给电子对金属离子的配位键和金属离子给电子对配体的配位键。
这两种配位键分别被称为配体基团和中心离子。
二、配位数配位数指的是金属离子周围配体的个数。
配位数主要受到金属的电子构型、配位基团的空间取向及大小以及配体的种类等多种因素的影响。
常见的配位数有2、4、6等。
三、配位化合物的结构配位化合物的结构多样,常见的结构类型包括线性型、方形平面型、四面体型和八面体型等。
这些结构类型受到金属离子的配位数、配体的种类及其构型的影响。
四、配位化合物的命名配位化合物的命名是大一配位化学中的重要内容。
根据国际纯化学和应用化学联合会(IUPAC)的规定,配位化合物的命名需要遵循一定的原则,例如先写配体,再写中心金属离子的化学符号等。
五、配位溶剂和配位化合物的溶解度在溶液中,配位化合物的性质和溶剂密切相关。
一些溶剂可以与金属离子或配体进行配位作用,从而改变配位化合物的结构和溶解度。
六、配位反应配位反应是指金属离子和配体之间发生的置换反应。
配位反应类型多样,包括配体置换反应、配位体分解反应和配体配位和插入反应等。
配位反应常常伴随着配位键的生成或断裂。
七、配位化合物的性质与应用配位化合物的性质与应用广泛,例如具有强氧化性或还原性的过渡金属配位化合物常用于催化剂和电子器件中,而具有特殊荧光性质的配位化合物则常被应用于荧光探针和生物成像等领域。
总结:大一配位化学知识点主要包括配位键理论、配位数、配位化合物的结构、配位化合物的命名、配位溶剂和配位化合物的溶解度、配位反应以及配位化合物的性质和应用等方面。
通过学习这些基本概念和原理,可以为进一步深入了解配位化学打下良好的基础。
2020届高三化学选修三物质结构与性质常考题型——配位键和配合物【方法和规律】1、配位键(一种特殊的共价键)(1)孤电子对:分子或离子中没有跟其他原子共用的电子对称为孤电子对(2)配位键的形成:成键的两个原子或离子一方提供孤电子对,一方提供空轨道而形成的共价键。
即:共用电子对由一个原子单方向提供给另一原子共用所形成的共价键(3)成键的性质:共用电子对对两个原子的电性作用(4)配位键的表示方法:常用“―→”来表示配位键,箭头指向接受孤电子对的原子即:BA电子对接受体电子对给予体−→−,如:NH+4可表示为(5)成键条件:其中一个原子提供孤对电子,另一原子提供空轨道2、配合物(1)中心原子:提供空轨道接受孤对电子的原子叫中心原子。
中心原子一般是带正电荷的金属离子(此时又叫中心离子),过渡元素最常见如:Fe3+、Cu2+、Zn2+、Ag+(2)配位体:含有并提供孤电子对的分子或离子,即电子对的给予体。
常见的配位体:H2O、NH3、SCN—、CO、N2、X—、OH—、CN—(3)配位原子:配体中提供孤对电子的原子叫配位原子,如:H2O中的O原子,NH3中的N原子(4)配离子:由中心原子(或离子)和配位体组成的离子叫做配离子,如:[Cu(NH3)4]2+、[Ag(NH3)2]+(5)配位数:作为配位体直接与中心原子结合的离子或分子的数目,即形成的配位键的数目称为配位数如:[Cu(NH3)4]2+的配位数为4,[Ag(NH3)2]+的配位数为2(6)配离子的电荷数:配离子的电荷数等于中心离子和配位体电荷数的代数和(7)内界和外界:配合物分为内界和外界,期中配离子称为内界,与内界发生电性匹配的的阳离子(或阴离子)称为外界,如:[Cu(NH3)4]SO4的内界是[Cu(NH3)4]2+,外界是SO42—,配合物在水溶液中电离成内界和外界两部分即:[Cu(NH3)4]SO4===[Cu(NH3)4]2++SO42—,而内界很难电离,其电离程度很小,[Cu(NH3)4]2+ Cu2++4NH33、配位键的强弱:配位键的强弱取决于配位体给电子的能力,配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定【例题精讲】配位键的形成条件答题策略其中一个原子提供孤对电子,另一原子提供空轨道答题模×××提供孤对电子,×××提供空轨道1、[2019·全国卷Ⅰ·节选]乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______________________________________________,其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)2、[2019·海南卷·节选]CuCl难溶于水但易溶于氨水,其原因是__________________________________________,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______3、Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为___________________________________________________________________4、研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
.配位化合物的价键理论配合物的晶体场理论一.配合物的构型与中心的杂化方式二中心杂化轨道的形成1. ns np nd 杂化1 个 4s 空轨道,3 个 4p 空轨道和2 个 4d 空轨道形成 sp3d2杂化轨道,正八面体分布。
6 个F-的 6 对孤对电子配入sp3d2空轨道中,形成正八面体构型的配合单元。
例 2 Ni(CO)4的成键情况在配体 CO 的作用下,Ni 的价层电子重排成 3d104s0形成 sp3杂化轨道,正四面体分布,4 个CO 配体与 sp3杂化轨道成配键,形成的 Ni(CO)4构型为正四面体。
例 1 和例 2 的相同点是,配体的孤对电子配入中心的外层空轨道, 即 ns np nd 杂化轨道, 形成的配合物称外轨型配合物. 所成的键称为电价配键. 电价配键不是很强.例 1 和例 2 的不同点是,CO 配体使中心的价电子发生重排,这样的配体称为强配体。
常见的强配体有 CO、 CN-、NO2-等;例1 中 F-不能使中心的价电子重排,称为弱配体。
常见的弱配体有 F-、Cl-、H2O 等。
而 NH3等则为中等强度配体。
对于不同的中心,相同的配体其强度也是不同的。
2. (n-1) d ns np 杂化例 3 讨论的成键情况形成 d2sp3杂化,使用 2 个 3d 轨道, 1 个 4s 轨道,3个4p 轨道。
用的内层 d 轨道。
形成的配离子为正八面体构型。
空出 1 个内层 d 轨道,形成 dsp2杂化轨道,呈正方形分布。
故构型为正方形。
例 3 和例 4 中,杂化轨道均用到了 ( n - 1 ) d 内层轨道,配体的孤对电子进入内层,能量低,称为内轨配合物,较外轨配合物稳定。
所成的配位键称为共价配键。
三价键理论中的能量问题内轨配合物稳定,说明其键能 E内大,大于外轨的 E外,那么怎样解释有时要形成外轨配合物呢?其能量因素如何?上面的例题中我们看到,形成内轨配合物时发生电子重排,使原来平行自旋的 d 电子进入成对状态,违反洪特规则,能量升高。