ISO 6888 食品和动物饲料的微生物学金黄色葡萄球菌检验
- 格式:doc
- 大小:72.50 KB
- 文档页数:10


按照现行的国标方法,金黄色葡萄球菌检测方法分为第一法定性检验、第二法平板计数法(适用于金黄色葡萄球菌含量较高的食品),以及第三法M P N 计数法(适用于金黄色葡萄球菌含量较低的食品)。
第一法定性检验过程包括样品处理、样品增菌、平板分离划线、初步鉴定、确证鉴定这5个步骤,整个流程全部完成至少需要5天时间。
第二法平板计数法包括5个步骤——样品稀释、样品接种涂布、典型菌和可疑菌计数、鉴定试验、结果计算,整个流程全部完成至少需要4天时间。
第三法M P N 计数法同样包括5个步骤,即样品稀释、样品增菌、平板分离划线、鉴定试验、查MPN 表确认结果,整个流程全部完成至少需要5天时间。
以下将对金黄色葡萄球菌的检测流程进行简单介绍,并对难点、注意事项进行梳理和讲解。
1 第一法:金黄色葡萄球菌定性1.1 样品处理固态和半固态样品:称取25g样品至盛有225mL 7.5%氯化钠肉汤中,充分混匀。
液体样品:吸取25m L 样品至盛有225m L 7.5%氯化钠肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀。
1.2 样品增菌将上述样品匀液置于金黄色葡萄球菌检验技术介绍及分析□ 李留洋 锐德检测技术(天津)有限公司重的感染。
该菌对营养的要求不高,在普通培养基上生长良好,需氧或兼性厌氧。
容易受金黄色葡萄球菌污染的食品主要为乳制品、蛋及蛋制品、各类熟肉制品,其次是含有乳类的冷冻食品等,因此对于该菌的检验也被确定为食品致病性菌种检验中的重要项目。
图1 样品处理36±1℃的恒温培养箱中培养18~24h 。
1.3 平板分离划线该步骤是整个金黄色葡萄球菌检测环节中最重要的步骤之一,因为平板划线分离的效果决定了可疑菌落的判定和选择。
平板划线选择三分法或四分法则分离效果较好,更容易出现单菌落平板。
1.4 初步鉴定分离的培养基选用B a i r d -Pa r k e r 平板(B P 平板)和血平板。
结果显示,金黄色葡萄球菌在B a i r d -Pa r k e r 平板上呈圆形,表面光滑、凸起、湿润,菌落直径为2~3m m ,颜色呈灰黑色至黑色、有光泽,常有浅色(非白色)边缘,周围绕以不透明圈(沉淀),其外常有一清晰带,当用接种针触及菌落时具有黄油样黏稠感;有时可见到不分解脂肪的菌株——除没有不透明圈和清晰带外,其他外观基本相同;从长期贮存的冷冻或脱水食品中分离的菌落,其颜色常较典型菌落略浅,且外观可能较为粗糙,质地较干燥。

食品微生物学检验金黄色葡萄球菌能力验证技术方案根据《新项目论证技术要求》,为保证此次能力验证数据准确,结果可靠,特制定如下技术方案:一、检验依据《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验GB4789.10-2016 》(第二法金黄色葡萄球菌平板计数法)二、检品蜜饯、牛肉、酱油三种物质形态不同种类的典型性样品三、人员比对a、b分别试验进行数据比对(双人双平行)四、准备工作仔细核对试验使用试剂及相关培养基,灭菌试验所需要的试剂、耗材以及玻璃器皿等。
五、质量控制1、按照国家标准规定准确称取样品和试剂并进行前处理。
2、仪器设备性能和检测环境的确认(1)依据《消毒与灭菌效果的评价方法与标准GB15981-1995》定期对高压蒸汽灭菌锅的灭菌效果进行检测评价并记录;(2)依据《无菌室消毒灭菌操作规程》定期对对无菌室、生物安全柜、超净台、无菌衣进行清洁消毒灭菌并记录;(3)依据《实验室质量控制规范食品微生物检测GB/T27405-2008》定期对对无菌室、生物安全柜及超净台进行沉降菌检测并记录。
3、培养基性能测试依据《食品安全国家标准食品微生物学检验培养基和试剂的质量要求GB4789.28-2013》对此参数涉及到的Baird—Parker琼脂培养基进行验证并记录。
4、菌株确认依据《实验室质量控制规范食品微生物检测GB/T 27405-2008》和《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验GB4789.10-2016 》对试验所用到的血浆凝固酶试验阳性和阴性葡萄球菌菌株确认。
5、对照每次实验均应进行阳性、阴性和空白对照确保实验数据的可靠性。
六、注意事项1、所用平板应事先放在培养箱里干燥,直到平板表面的水珠消失;2、实验后对本实验所涉及到含阳性菌的耗材、容器、玻璃器皿、培养基、菌株等进行灭菌处理并做好记录;3、实验人员要严格按照《无菌检查系统操作规程》进出无菌室;4、严格按照《食品微生物学检验总则GB4789.1-2016》进行采样和实验。



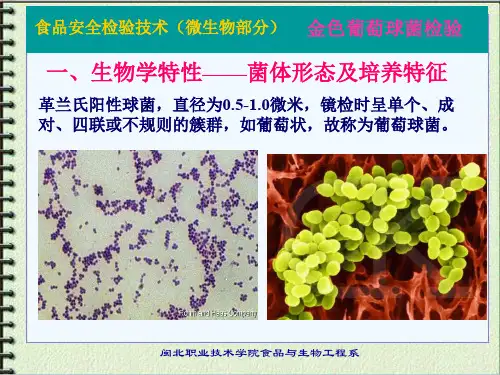
金黄色葡萄球菌检验技术介绍及分析金黄色葡萄球菌(Staphylococcus aureus,简称SA),是一种常见的致病菌,可引起人体多种感染疾病,如皮肤感染、软组织感染和食源性疾病等。
因此,快速、准确地诊断和鉴定SA的存在非常重要,不仅是保障人类健康的关键,也是食品、药品等行业的质量控制的重要保障。
SA的检验技术包括传统培养鉴定、分子生物学方法鉴定等,下面分别介绍。
一、传统培养鉴定1.概述传统培养鉴定方法通过对细菌在液体或固体培养基上的形态、生化代谢和生长特性等进行分析,来确定细菌种类和数量。
该方法操作简单、成本低廉,适合用于常规样品的检测。
2.样品处理对于皮肤、鼻腔等来源的样品,可以将样品用生理盐水进行处理,通过溶解和过滤的方式获得拍平涂片,然后接种于液体和固体培养基上进行培养。
对于食品、药品等物品样品,需要先进行样品预处理,如研磨、加试剂等处理,以提高检测效果。
3.培养基传统SA的培养基包括营养琼脂(Nutrient agar)、大肠杆菌肉汤(Luria-Bertani broth)、普兰尼克琼脂(tryptic soy agar)等,其中普兰尼克琼脂是比较常用的一种。
4.鉴定方法常见的SA鉴定方法有以下几种:(1)目测识别:SA属于黄色或金黄色,对光有反射。
(2)形态鉴定:SA呈球形,成群分布,可以用显微镜观察。
(3)生化鉴定:SA产生多种酶和氧化还原酶等特殊代谢酶,如可溶性蛋白酶、卵白素酶等,通过对这些酶的检测进行SA的鉴定。
(4)生长特性:SA生长速度较快,一般在37℃条件下生长速度更快,一般24小时内能形成典型的菌落。
二、分子生物学方法鉴定分子生物学方法是指利用DNA序列差异、RNA表达水平、蛋白质组数据等高分辨率生物信息学技术,对细菌进行鉴定和分类。
与传统培养鉴定相比,其速度和准确性更高,但成本较高,不适合于大规模的检测。
2.核酸特异性PCR检测法核酸特异性PCR检测法是一种基于聚合酶链反应(PCR)的SA检测方法。


食品安全国家标准金黄色葡萄球菌检验1 范围本标准规定了食品中凝固酶阳性的金黄色葡萄球菌(Staphylococcus aureus)的检验方法。
本标准第一法适用于食品中凝固酶阳性的金黄色葡萄球菌的定性检验;第二法适用于金黄色葡萄球菌含量较高的食品中凝固酶阳性的金黄色葡萄球菌的计数;第三法适用于金黄色葡萄球菌含量较低而杂菌含量较高的食品中凝固酶阳性的金黄色葡萄球菌的计数。
2 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:2.1 恒温培养箱:36 ℃±1 ℃。
2.2 冰箱:2 ℃~5 ℃。
2.3 恒温水浴箱:37 ℃~65 ℃。
2.4 天平:感量0.1 g。
2.5 均质器。
2.6 振荡器。
2.7 无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸头。
2.8 无菌锥形瓶:容量100 mL、500 mL。
2.9 无菌培养皿:直径90 mm。
2.10 L涂布棒。
2.11 pH 计或pH 比色管或精密pH 试纸。
3 培养基和试剂3.1 7.5 %氯化钠肉汤:见附录A 中A.1。
3.2 血琼脂平板:见附录A 中A.2。
3.3 Baird-Parker 琼脂平板:见附录A 中A.3。
3.4 兔血浆纤维蛋白原(RPF)琼脂培养基:见附录A 中A.4。
3.5 脑心浸出液肉汤(BHI) :见附录A 中A.5。
3.6 兔血浆:见附录A 中A.6。
3.7 稀释液:磷酸盐缓冲液:见附录A 中A.7。
3.8 营养琼脂小斜面:见附录A 中A.8。
3.9 革兰氏染色液:见附录A 中A.9。
3.10 无菌生理盐水:见附录A 中A.10。
第一法金黄色葡萄球菌定性检验4检验程序金黄色葡萄球菌定性检验程序见图1。
图1 金黄色葡萄球菌检验程序5 操作步骤5.1 样品的处理称取25 g 样品至盛有225 mL 7.5 %氯化钠肉汤的无菌均质杯内,8000 r/min~10000 r/min 均质1 min~2 min,或放入盛有225 mL 7.5 %氯化钠肉汤无菌均质袋中,用拍击式均质器拍打1 min~2 min。

金黄色葡萄球菌国家标准检验方法一、国家标准检验办法参见GB 4789.10-2010《食品平安国家标准食品微生物学检验金黄色葡萄球菌检验》其次法和第三法。
1、Baird-Parker平板计数(其次法)本办法适用于金黄色葡萄球菌含量较高的食品中金黄色葡萄球菌的计数。
1.1、检验流程 1.2、试验步骤 (1)样品的稀释①固体和半固体样品:称取25g样品置盛有225mL 缓冲液或生理盐水的无菌均质杯内,8000-10000r/min均质1-2min,或置盛有225mL稀释液的无菌均质袋中,用拍击式均质器拍打1~2min,制成1:10的样品匀液。
②液体样品:以无菌吸管吸取25mL样品,置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
③用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL 稀释液的无菌试管中(注重吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打使其混合匀称,制成1:100的样品匀液。
④按③操作程序,制备10倍系列稀释样品匀液。
每递增稀释一次,换用1次1mL无菌吸管或吸头。
(2)样品的接种按照对样品污染情况的估量,挑选2-3个相宜稀释度的样品匀液(液体样品可包括原液),在举行10倍递增稀释时,每个稀释度分离吸取1mL样品匀液以0.3mL, 0.3mL, 0.4mL接种量分离加入三块Baird-Parker平板,然后用无菌L棒涂布囫囵平板,注重不要触及平板边缘。
用法前,如Baird-Parker平板表面有水珠,可放在25-50℃的培养箱里干燥,直到平板表面的水珠消逝。
(3)培养在通常状况下,涂布后,将平板静置l0min,如样液不易汲取,可将平板放在培养箱((36±1)℃培养1h;等样品匀液汲取后翻转平皿,倒置于培养箱,(36±1)℃培养,45一48h。
ISO 6888-1:1999食品和动物饲料的微生物学血清凝固酶阳性葡萄球菌(金黄色葡萄球菌和其他球菌)序ISO是国际标准的全球性组织。
准备国际标准这项工作通常由ISO技术联盟来完成。
每一个团体成员负责各自的学科。
与ISO有合作的国际性机构、政府与非政府机构,也有参与这项工作。
ISO与国际电子组织(IEC)在电子标准化方面有着密切的合作关系。
国际性标准的起草原则在《ISO/IEC 细则》第三部分中有给出。
起草的国际性标准被技术委员会采用是通过全体成员投票决定的。
发布一个国际性标准需要至少75%成员投赞成票。
国际性标准ISO 6888-1 由ISO/IEC 34技术委员会(农产品,小组委员会SC9,微生物)起草的。
ISO 6888-1的第一个版本,以及ISO 6888-2,取代ISO 6888:1983,做了计数上的修改。
ISO 6888由以下部分组成,一般标题为食品与动物饲料微生物学——一般方法计数血浆凝固酶阳性葡萄球菌(金黄色葡萄球菌和其它种类):——第一部分:方法使用BP琼脂培养基;——第二部分:方法使用兔血浆纤维蛋白琼脂培养基。
0. 绪论0.1 由于食品与饲料的种类繁多,这个标准不一定适合某一类产品。
在这种情况下,可使用不同的方法,但必须有绝对的技术上的理由。
否则,要尽可能地完全遵循本标准。
当这个标准下一次回顾时,将会对这个标准的使用做数据统计,特殊产品偏离本标准使用也会做相关统计。
同一类产品的检测方法也有可能不统一,国际性标准和/或国家标准也不一定完全与本标准相符合。
希望相关标准做回顾时,会遵循本标准做出相关的修改,以使只有已被证明的技术上的理由才能与本标准偏离。
0.2 ISO 6888描述了两种平行的方法(第一部分和第二部分)来检测血浆凝固酶阳性葡萄球菌,其中以证明该菌产生肠毒素。
其中较大可能是金黄色葡萄球菌,也有可能是中间链球菌或猪葡萄球菌。
0.3 ISO 6888本部分的目的在于,葡萄球菌的证实基于血浆凝固酶的阳性反应,但也有研究证明一些受损的金黄色葡萄球菌会出现血浆凝固酶弱阳性。
这种细菌可能会和其它种类的细菌混淆,但它能通过后续的试验区分开来,在本标准中没有做说明,例如溶葡球菌酶敏感性,产生溶血素、耐热核酸酶,发酵甘露醇产酸(见参考文献2)。
1 范围本标准适用于检测人类食物或动物饲料产品的血浆凝固酶阳性葡萄球菌的检测,通过计数BP平板35℃或37℃培养后的菌落数。
2 参考标准以下标准文件是本标准的参考标准。
已过期的文献,后来改善或修订的,部分这种文献已经不适用。
然而,有大部分学者正在争取发布最新版的文献如以下列出。
对于无限期的文献,最新版本都是适用的。
ISO和IEC成员保存当前有效国际性标准的记录。
ISO 6887-1,食物与动物饲料原料微生物学——样品准备原则,微生物检测样品原液及十倍法稀释——第一部分:样品原液和十倍法稀释的指导准则。
ISO 7218,食物与动物饲料原料微生物学——微生物检验指导准则。
3 术语与定义本标准中使用的相关术语与定义如下。
3.1 血浆凝固酶样品葡萄球菌在选择性平板上的典型和/或不典型菌落,按照本标准操作呈现凝固酵素阳性反应。
3.2 血浆凝固酶阳性葡萄球菌计数按照本标准操作,得出血浆凝固酶阳性葡萄球菌每克或每毫升样品的含量。
4 原理4.1 接种固体选择性培养基表面,做两个平行,如果为液体样品,接种一定体积的样品,如果是其它类型的样品,接种一定体积的样品悬液。
在同样的条件下,接种样品或样品悬液的十倍稀释溶液,每个梯度两个平行。
4.2 在需氧条件下35℃或37℃培养,然后24h和48h检查。
4.3 计算每克或每毫升样品中血浆凝固酶阳性葡萄球菌的数量,稀释梯度的选择和平板上典型与不典型菌落的数量都有重要的意义,并通过凝固酵素试验确证。
5 稀释液与培养基 5.1 概要正确的实验室操作,参照ISO 7218。
5.2 稀释液参照ISO 6887-1 和特殊产品的相关标准。
5.3 BP 琼脂培养基注意:商业上可买到的培养基可以使用。
必须参照厂商的说明书操作。
5.3.1 基础培养基 5.3.1.1 成分5.3.1.2 准备将所有成分或培养基干粉溶解于水中并煮沸。
如需要,调整pH 值至7.2±0.2,在25℃下。
将培养基转移至适当容量的三角瓶中,每瓶100ml 。
121℃灭菌15min 。
5.3.2 配套试剂 5.3.2.1 亚碲酸盐钠 5.3.2.1.1 成分5.3.2.1.2 准备将亚碲酸盐钠充分溶解在水中,最小程度加热。
固体粉末应该是易溶的。
如果有白色的不溶物出现,丢弃该粉末。
过滤0.22µm孔膜灭菌。
在3℃±2℃保存期不超过1个月。
如有白色混浊,丢弃它。
5.3.2.2 蛋黄乳状液注意:如果有商业的成品,可以使用。
使用有完整外壳的新鲜鸡蛋。
用液体清洁剂将表面刷干净。
在流动水下冲洗干净。
然后在70%乙醇中浸泡30s消毒,自然晾干,或者喷射酒精后用火焰灭菌。
在无菌环境下,打开鸡蛋并将蛋黄从蛋白中分离出来。
将蛋黄放入灭菌三角瓶中,加入四倍体积无菌水。
充分混匀。
在47℃水浴锅中加热2h,然后在3℃±2℃下保存18h~24h,使之形成沉淀物。
无菌的收集澄清液体至无菌容器中待使用。
该乳状液在3℃±2℃下最大保存期为72h。
5.3.2.3磺胺二甲嘧啶溶液注意:该溶液仅使用于容易变化的样品中。
5.3.2.3.1 成分5.3.2.3.2 准备将磺胺二甲嘧啶溶解在氢氧化钠溶液中,用水稀释至100ml。
过滤0.22µm 孔膜灭菌。
在3℃±2℃保存期不超过1个月。
5.3.3 完全培养基5.3.3.1 成分5.3.3.2 准备融化基础培养基,水浴冷却至47℃。
然后,在无菌条件下,添加亚碲酸钠溶液和蛋黄乳状液,如有必要,添加将磺胺二甲嘧啶溶液。
每一种溶液都必须水浴预热至47℃。
然后充分混匀。
5.3.4 准备琼脂平板倾注适当量培养基至无菌平皿中,以获得4mm厚度平板,并凝固。
在使用之前,要烘干平板表面水分,可在25℃~50℃培养箱中烘干。
5.4 脑心浸液肉汤5.4.1 成分5.4.2 准备将各成分或脱水干粉培养基于水中,如需要可加热。
调整pH值至7.2±0.2,在25℃下。
将培养基转移至适当容积的玻璃管中,每管5ml~10ml。
121℃灭菌15min。
5.5 兔血浆使用商业成品并根据厂商说明再水化。
如果购买不到成品兔血浆,用三倍体积无菌水稀释灭菌的新鲜兔血。
添加EDTA,使其在溶液中的含量为0.1%,如果兔血中含有柠檬酸钾或柠檬酸钠。
再水化或自制的兔血浆须立即使用。
在使用之前,用血浆凝固酶阳性葡萄球菌做阳性质控。
6 设备及玻璃器皿一般的微生物实验室设备(参照ISO 7218),特别的,增加以下几项。
6.1 干热灭菌和湿热灭菌设备6.2 培养箱,可恒温35℃±1℃或37℃±1℃6.3 干燥箱或培养箱,可恒温25℃±1℃和50℃±1℃6.4 水浴锅,可恒温47℃±2℃6.5 试管,三角瓶带螺帽6.6 灭菌平皿,玻璃或塑料的6.7 接种针和接种环6.8 移液器,1ml,2ml和10ml,分割分别为0.1ml,0.1ml和0.5ml6.9 灭菌的涂布棒,玻璃或塑料的6.10 pH计7 取样ISO 6888中并不涉及取样。
如果没有相关的国际标准,建议需经过多方同意。
微生物实验室接收到的样品必须是真实代表样品的,并在运输和储藏期间没有损坏或改变微生物的性状。
8 样品前处理参照样品的相关国际标准进行前处理。
如果没有相关的国际标准,建议需经过多方同意。
9 程序9.1 测试部分,样品原始悬液和稀释参照ISO 6887-1,相关细节可参考各个样品的标准。
9.2 接种9.2.1如果样品为液体,各吸取0.1mL样液至两个BP平板上,涂布平板,如果样品为非固体,则吸取1:10稀释度样液0.1mL至BP平板上,依次类推,检测1:100或更多的稀释度。
9.2.2若是样品的金黄色葡萄球菌限度较低,可吸取1.0mL样液涂布平板,得到更低检出结果。
1mL样液可涂布到一个大的140mm直径平板,或三个小的90mm 平板上。
9.2.3小心涂布平板,注意不要涂到平板的边缘上。
涂布完毕,盖好平板,室温静置15min至干燥。
9.3 培养35℃或37℃培养,24h和48h观察结果。
9.4 挑选平板及计数9.4.1 平板计数培养24h后,在平板背面标识典型菌落。
继续培养24h,标识新长出的典型菌落。
(典型菌落为黑色或灰色,光亮凸起,培养24h 后,直径为1~1.5mm ,培养48h 后,直径为1.5~2.5mm 。
周围有部分不透明的浑浊圈。
非典型菌落和典型菌落的大小一致,黑色光亮有乳白色边缘,不带浑浊圈,或者是灰色菌落。
)挑取菌落总数小于300个,含有15~150个典型或非典型菌落的平板计数。
挑取5个菌落做证实试验(若平板中只有典型菌落,则挑取5个典型菌落;若只有非典型菌落,则挑取5个非典型菌落;若同时存在典型和非典型菌落,则挑取5个典型菌落和5个非典型菌落)。
如果最低稀释度平板上少于15个典型或非典型菌落,可按照9.4.3和10.2估计读数。
9.4.2若取1mL 涂布到三个平板上,计数三个平板的菌落总数。
9.4.3估计平板的金黄色葡萄球菌菌落总数,保留存在典型或非典型菌落的平板,把所有菌落跳出做鉴定试验。
9.5证实试验将挑选的菌落接种至脑-心浸萃液态培养基中,35℃或37℃培养24h 。
在0.3mL 的培养液中加入0.1mL 兔血浆,35℃或37℃培养。
培养4~6h 后,倾斜培养管检查是否凝固。
若为阴性反应,延长培养时间至24h 。
10 结果表达10.1计算每个平板上金黄色葡萄球菌的菌落数,记为a其中A c ——选取做证实试验的典型菌落数; A nc ——选取做证实试验的非典型菌落数; b c ——血浆凝固酶阳性的典型菌落数; b nc ——血浆凝固酶阳性的非典型菌落数; c c ——平板上典型菌落总数; c nc ——平板上非典型菌落总数。
10.2计算样品中金黄色葡萄球菌菌落数,记为Nc b nc A nc+× c nc其中∑a——所有平板上阳性菌落的总数; V ——每个平板上接种体的体积,mL ; n1——第一个稀释度被选用的平板数; n2——第二个稀释度被选用的平板数; d ——第一个稀释梯度的稀释度(如10-1)。
11 精密度 11.1 概述方法的精密度可表现为重复性和再现性,在ISO 5725-2中有定义。
然而,ISO 5725-2中基于这个定义的计算,并不适用于所有微生物分析。
因此,本标准也参考ISO 16140,它已将微生物分析独立开来。