第二章 烷烃汇总
- 格式:ppt
- 大小:1.39 MB
- 文档页数:15

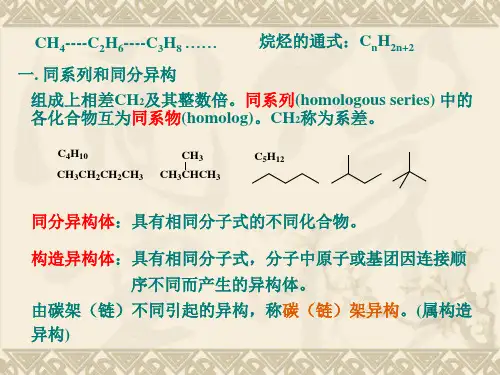





第二章 烃一、烷烃(一)定义:碳原子之间都以单键结合,剩余碳原子全部跟氢原子结合,使每个原子的化合价都达到“饱和”的链烃叫饱和链烃,或叫烷烃 (二)通式:C n H 2n+2(n ≥1) (三)物理性质:1、随着碳原子数的增多,熔沸点依次升高,密度依次增大(密度小于水);C 1——C 4为气态(新戊烷为气体),C 5——C 16为液态,C 17以上的为固态2、溶解性:不溶于水,易溶于有机溶剂。
液态烷烃都可做有机溶剂3、质量分数:随着碳原子数的增多,氢原子的质量分数逐渐减小,碳原子的质量分数逐渐增大,所以CH 4是氢原子质量分数最大的烷烃4、同分异构体的熔沸点:支链越多,熔沸点越低(四)结构特点:烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp 3杂化,以伸向四面体4个顶点方向的sp 3杂化轨道与其他碳原子或氢原子结合,形成σ键。
烷烃分子中的共价键全部是单键。
既有极性键又有非极性键(甲烷除外)。
(五)烷烃的存在形式天然气、液化石油气、汽油、柴油、凡士林、石蜡等,它们的主要成分都是烷烃。
(六)代表物——甲烷1、物理性质:甲烷是一种无色、无臭的气体,在相同条件下,其密度比空气小,难溶于水2、化学性质:甲烷的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。
甲烷的主要化学性质表现为能在空气中燃烧(可燃性)和能在光照下与氯气发生取代反应。
(1)氧化反应:CH 4+2O 2−−→−点燃CO 2+2H 2O (淡蓝色火焰) 使用前要验纯,防止爆炸 (2)受热分解:CH 4−−→−高温C+2H 2(隔绝空气) (3)取代反应:CH 4+Cl 2−−→−光照CH 3Cl+HCl(七)化学性质:通常状况下,很稳定,不与强酸、强碱或酸性KMnO 4反应1、氧化反应(可燃性):C n H 2n+2+2O 2−−→−点燃nCO 2+(n+1)H 2O注:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生 2、取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应(1)烷烃取代反应的特点:①在光照条件下;②与纯卤素反应;③1mol 卤素单质只能取代1molH④连锁反应,有多种产物(卤代烃和卤化氢气体)(2)举例:CH 3CH 3+Cl 2−−→−光照CH 3CH 2Cl+HCl3、受热分解:烷烃在隔绝空气的条件下,加热或加催化剂可发生裂化或裂解 通式:一分子烷烃催化剂 △一分子烷烃+一分子烯烃(八)同系物1、定义:结构相似,在分子组成上相差一个或若干个CH 2原子团的化合物互称为同系物2、特点:(1)通式相同,结构相似,化学性质相似,属于同一类物质;(2)物理性质一般随碳原子数目的增多而呈规律性变化。


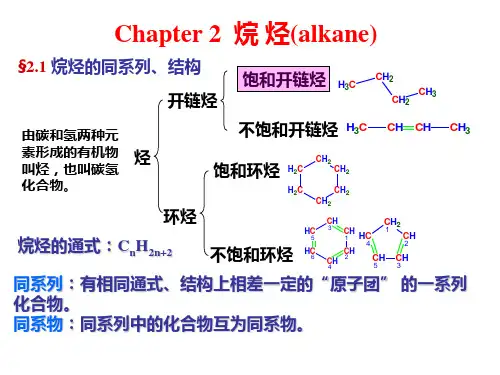
第二章 烷烃和环烷烃2.1 烃: 碳氢化合物(hydrocarbons)C: 1s22s22p2 最外层4个价电子,碳是四价的 中等电负性 可通过与其它原子共享电子满足八隅体(成共价键), 碳与碳之间,碳与氢之间可以成键,形成复杂化合物HCH H C H HHC HHHC H乙烷甲烷(CH4)饱和烃 :烷烃 脂肪烃 烃 芳香烃 不饱和烃:( 烯烃、炔烃)H H C HH C H HH C C HH HHCCH烷烃烯烃炔烃芳香烃2.2 饱和烃:烷 烃(Alkanes, Paraffins)烷烃——饱和烃,只含单键CH3 H3C CH2 CH2 CH3 H3C CH CH CH3 CH3 H2CCH2 CH2 H2C CH2直链带侧链环状同系物:有相同通式、 (例:CH4, C2H6, C3H8, C4H10…) 结构上相差CH2及其整 数倍的一系列化合物 同系列 (同系物, Homologs)烷烃的通式:CnH2n+2H H C H HH H H C C H H HH H H H C C C H H H HH H H H H C C C C H H H H H甲烷乙烷丙烷丁烷2.3. 烷烃的结构 A. 烷烃的立体结构1.09 Å σ键(sp3-s)H109.5oC H H HH C H H109.3oH H1.10 Å σ键(sp3-s)C H1.54 Å σ键(sp3-sp3)Ball and Stick ModelC: sp3 杂化,成 σ 键B. 同分异构现象和同分异构体 C4 以上烷烃出现同分异构现象H3C CH2 CH2 CH3H 3CCH CH3C H3C4H10 同分异构体:具有相同的分子式的不同的化合物 构造异构体:具有相同的分子式,但原子的连接顺序不同的分子 正丁烷、异丁烷属于同分异构体中的构造异构体(碳架异构体)C1~C3烷烃无异构现象CH4 C2 H 6 C3 H 8 无异构体C4 以上烷烃出现同分异构现象 同分异构体数C4H10 2C5H123C6H145C20H42366,319同分异构体是不同的化合物,具有不同的性质,例如:H 3CCH2CH2CH3H 3CCH CH3 CH3沸点:-0.5 ℃-11.73℃C. 碳原子的四种类型(与其化学性质相关) 当分子中的某一个碳原子与一个、两个、三个、四个碳 原子相连时,该原子分别称为伯、仲、叔、季碳原子 1° H(伯氢)H3C CH2 CH22° H(仲氢)CH31° C(伯碳,一级碳)primary carbon2° C (仲碳,二级碳)secondary carbonCH3 H3 C CH3° H(叔氢)CH3CH3 H3C C CH3 CH33° C (叔碳,三级碳)tertiary carbon4° C (季碳,四级碳)quaternary carbon2.4. 烷烃的命名普通命名法用于简单化合物的命名IUPAC命名法(系统命名法)(IUPAC: 国际纯化学与应用化学联合会,I nternational U nion of P ure and A pplied C hemistry)碳原子轨道sp 3杂化2.5 烷烃的结构2s 2p x 2p y2p z2s 2p x 2p y2p z跃迁原子轨道重组4个sp 3轨道C: 1s 22s 22p 2sp 3杂化109.5o四面体型甲烷(CH 4)σ 键轴对称方式交叠σ键的形成:原子轨道沿键轴(核间连线)相互交盖,形成沿键轴对称的共价键称为σσ键的特性•成键原子可沿键轴自由旋转;•键能较大,可极化性较小H Hvan der Walls 距离:分子间所能达到的最小距离,此时分子间的吸引力与电子云间的斥力达到平衡时。