第11章-氢和稀有气体习题
- 格式:doc
- 大小:32.00 KB
- 文档页数:2

第11章习题解答第11章(03525)重水是由H和18O组成的水。
.()解:错第11章(03526)氢在自然界中主要以单质形式存在。
()解:错第11章(03527)由于H2是双原子分子,所以H2比He的扩散速率小。
.()解:错第11章(03528)氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
.()解:错第11章(03529)因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
.()解:对第11章(03530)常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。
()解:对第11章(03531)实验室所用氢气钢瓶应放在室外,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:C第11章(03532)水煤气的主要成分是.()。
(A)CO和N2;(B)CO和O2;(C)CO和H2;(D)CO2和H2O。
解:C第11章(03533)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)活泼金属与酸反应。
解:D第11章(03534)下列反应方程式中,不适用于工业制氢的是()。
(A)H2O(电解)→H2+O2;(B)Zn+H2SO4→ZnSO4+H2;(C)C+H2O(g)∆−CO+H2;−→(D)CH4+H2O(g)∆,Ni,Co−−−−CO+H2。
−→解:B第11章(03539)在某些工厂用氢气做冷却剂,这是因为氢气.()。
(A)密度小;(B)扩散快;(C)易燃易爆;(D)导热性好。
解:D第11章(03535)下列氢气制法中,工业上不常采用的是.()。
(A)电解法;(B)水煤气法;(C)甲烷转化法;(D)碱金属氢化物与水反应。
解:D第11章(03536)下列分子或离子不能存在的是.()。
(A)H2;(B)H2+;(C)H22+;(D)H-。
解:C第11章(03537)下列原子、离子和分子中属于反磁性的是.()。


无机化学课后答案 第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么? 1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制; (2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境; (4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态 液态 固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH 2;SiH 4;NH 3;AsH 3;PdH 0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点 、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a )温度最低的液体冷冻剂;(b )电离能最低 安全的放电光源;(c )最廉价的惰性气氛。
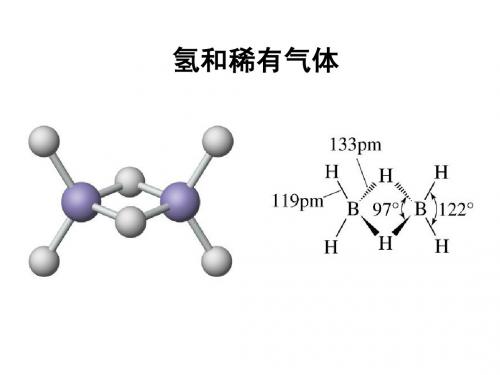
13-6用价键理论和分子轨道理论解释HeH 、HeH +、He 2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4XeF 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。

无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
无机化学课后练习题解答第二章物质的状态2.一敝口烧瓶在280K时所盛的气体,需加热到什么温度时,才能使其三分之一逸出?解:由题知要使三分之一的气体逸出瓶外,即体积为原来的1.5倍,而这一过程压力始终保持不变,故有:(P0V1)/T1= (PV2)/T2所以有 T2 = (T1V2)/V1= 280×1.5=420K答:略。
4.容器中有4.4 g CO2,14 g N2,12.8g O2,总压为2.026105Pa,求各组分的分压。
解:由题意知:CO2: n= 4.4/44 = 0.1molN2: n=14/28=0.5molO2: n=12.8/32=0.4mol有道尔顿分压定律:CO2: p=2.026×104PaN2: p=1.013×104PaO2: p=8.104×104Pa答:略。
8.在291K和总压为1.013×105Pa时,2.70 dm3含饱和水蒸汽的空气,通过CaCl2干燥管,完全吸水后,干燥空气为3.21 g,求291K时水的饱和蒸汽压。
解:3.21g空气在291K,2.7L的容积中其压力为: PV=Nrt所以 P空气=3.21×291×8.31/29×0.0027=99185PaP水蒸气=P总压- P空气=101300-99185=2.12×103Pa答:略第三章原子结构4.已知M2+离子3d轨道中有5个电子,试推出:(1)M原子的核外电子排布;(2)M原子的最外层和最高能级组中电子数;(3)M元素在周期表中的位置。
答:(1)Mn 1s22s22p63s23p63d54s2(2) 最外层2个电子,最高能级组中5个电子(3) 第四周期,第VIIIB族6.据原子结构的知识,写出第17号、23号、80号元素的基态原子的电子结构式。
答:17号元素Cl,其电子结构式为1s22s22p63s23p523号元素V, 其电子结构式为1s22s22p63s23p63d34s280号元素Hg, 其电子结构式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s29.列各组量子数哪些是不合理的,为什么?(1)n=2,l=1,m=0 (2)n=2,l=2,m=-1(3)n=3,l=0,m=0 (4)n=3,l=1,m=1(5)n=2,l=0,m=-1 (6)n=2,l=3,m=2答:(2)、(5)、(6)不合理10.列说法是否正确?不正确的应如何改正?a)s电子绕核运动,其轨道为一圆周,而电子是走 S形的;b)主量子数n为1时,有自旋相反的两条轨道;c)主量子数n为4时,其轨道总数为16,电子层电子最大容量为32;d)主量子数n为3时,有3s,3p,3d三条轨道。
第5章氢和稀有气体一、填空题1.人们将氢化物分为______氢化物,______氢化物和______氢化物三种类型。
【答案】离子型,分子型,金属型。
2.拉姆齐和雷利在1894年从空气中第一次分离出的稀有气体是______;l962年巴特利特第一次合成出来的稀有气体化合物是______,该化合物是模仿______合成出来的。
【答案】Ar(或氩);3.用Xe和F2直接反应合成出的化合物有______、______和______。
【答案】三、完成方程式并配平1.氙的化合物与水反应。
答:2.氢化物LiH与下列化合物反应。
答:3.完成下列氟化物与水反应的方程式。
答:4.完成并配平下列反应方程式。
答:四、问答题1.举例说明氢气都有哪些重要的化学性质。
答:氢气的化学性质主要有以下几种:(1)与活泼金属在加热条件下反应,生成离子型氢化物。
(2)与非金属元素形成分子型氢化物。
H2与氧化能力强的F2在低温下即可剧烈反应。
存光照或引燃的条件下,H2与Cl2和O2等反应。
H2是合成氨的重要原料,与N2在高温、加压和催化剂存在的条件下反应。
(3)在加压条件下与过渡金属形成金属型氢化物。
(4)在高温条件下,H2作为反应的还原剂。
(5)利用H2在有机合成中进行加氢反应,在催化剂作用下合成特定的化合物。
2.氢作为能源,其优点是什么?目前开发中的困难是什么?答:氢作为能源其优点如下:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用。
3.由氙的元素电势图计算的值。
答:酸性溶液中氙的元素电势图为说明H4XeO4具有很强的氧化性。
4.为什么XeOF4不能用玻璃容器储存?并指出应该用什么容器储存?答:XeOF4会与SiO2发生如下反应:可用镍容器(因氟与镍反应生成致密的保护膜)和某些塑料容器(如聚四氟乙烯)。
化学式与化合价一、化学式与化学用语1.用表示纯净物组成的式子叫做化学式。
2.化学式的书写物质类别书写方法举例单质金属直接用元素符号来表示(I 2除外)铁:稀有气体氖气:固体非金属碳:气态非金属(稀有气体除外)在元素符号的右下角写上原子个数氢气:臭氧:化合物正左负右硫酸铝:3.化学式表示的意义(由分子构成的物质)分类意义以H 2O 为例宏观表示一种物质水表示物质的组成元素水是由氢、氧两种元素组成的微观表示1个分子1个水分子表示分子的构成1个水分子是由2个氢原子和1个氧原子构成的二、化学式中数字的含义1.写在元素符号或化学式前面的数字,表示原子或分子个数。
如:2S 表示2个硫原子,2H 2O 表示2个水分子,只表示微观意义,不表示宏观意义。
2.写在化学式中元素符号右下角的数字,表示1个分子中所含该元素的原子个数。
如:H 2O 中“2”表示1个水分子中有2个氢原子。
三、化合价1.意义:化合价是元素的一种性质,它用来表示原子之间相互化合的数目。
2.数值:由1个原子或形成的对决定的。
3.表示方法:在元素符号或原子团的,先写,再写,数值是1时,。
4.常见元素化合价:K 、、Ag 、是+1价;Ca 、、Ba 、、Hg 是+2价;是+3;是-2价,是+2或+3,Cl 是-1最常见,单质价永不变。
5.规律(1)单质中元素化合价为;(2)在化合物中,各元素正负化合价的代数和为。
(3)在同一物质中,同种元素化合价可以,如:NH 4NO 3(4)同一元素在不同化合物中可以显示化合价。
(5)金属元素与非金属元素形成的化合物,化合价为正,化合价为负。
如:NaCl 非金属元素组成的化合物正价元素在前,负价元素在后。
6.化合价的计算考点1:化学式与意义【例1】(2024·陕西宝鸡·三模)含义丰富的化学符号是独特的化学语言,根据下列符号回答:原子团SO 4NO 3OHNH 4名称硫酸根碳酸根硝酸根铵根化合价-2价-2价-1价-1价+1价离子符号CO 32-OH -NO-⑤N2①2CH4②Al3+③2H④3(1)具有宏观含义的是(填序号)。
第11章氢和稀有气体习题
1.选择题
11-1根据价层电子对互斥理论,判断RnF4的空间结构式为………………( )
(A) 正八面体(B) 正四面体(C) 平面正方形(D) 变形四面体
11-2 稀有气体氙能与下列哪种元素形成化合物……………………………( )
(A) F (B) K (C) Na (D) Br
11-3氙的氟化物是很好的氧化剂,其原因是………………………………( )
(A) 氧化性强 (B) 还原到氙 (C) 不污染反应体系 (D) 前三者都是
11-4下列氢化物中,在室温下与水反应不产生氢气的是……………………( )
(A) LiAlH4(B) CaH2(C) SiH4(D) NH3
11-5在周期表中氡(Rn,原子序数86)下面的另一个未发现的稀有气体元素的原子序数应是………………………………………………………………………( )
(A) 109 (B) 118 (C) 173 (D) 222
11-6在化合物O2[PtF6]中,氧成键属于类型…………………………………( )
(A) O2 (B) +
O (C) -22O(D) -2O
2
2.填空题
11-7稀有气体的第一个化合物_____________,是由______ 于_________年制备的。
11-8根据价层电子对互斥理论,XeF2分子中,中心原子的价电子对构型为,XeF2分子稳定构型为_____________ 。
11-9稀有气体能被液化,是由于_____________。
最难被液化的稀有气体是_____________。
11-10XeO3是一种易潮解和易爆炸的固体化合物,其水溶液是一种极强的______,XeO3的水溶液能迅速地将氨氧化成______。
11-11由三氧化氙制高氙酸钠的反应方程式是__________________________。
3.简答题
11-12通常说“氢和氧可以化合成水”,即发生下面反应:
1
2H2(g) + O2(g) →1
2H2O(g) m
r
ΔH(H2O, g) = -241.8 kJ · mol-1
但在常温时却看不到反应发生,并且在温度达到4000 K高温时,将有70 %的水分解为H2和O2。
试解释之。
4.计算题
11-13某气态氟化氙在298 K,1.55 kPa时密度为1.535 × 10-4g · cm-3,试确定其分子式(F的相对原子质量为18.998;X e的相对原子质量为131.293)。
11-14已知XeF 4(g)的标准生成热为-215.476kJ ·mol-1,求XeF 4的平均键能(F–F 的键能为155 kJ ·mol-1)。