1.1.4原子的核外电子排布图
- 格式:pptx
- 大小:278.43 KB
- 文档页数:14

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1 [4]Be铍1s2 2s2 [5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s1 [12]Mg镁1s2 2s2 2p6 3s2 [13]Al铝1s2 2s2 2p6 3s2 3p1 [14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3 [16]S硫1s2 2s2 2p6 3s2 3p4 [17]Cl氯1s2 2s2 2p6 3s2 3p5 [18]Ar氩1s2 2s2 2p6 3s2 3p6 [19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s21s2 2s2 2p6 3s2 3p6 3d2 4s2 [23]V 钒1s2 2s2 2p6 3s2 3p6 3d3 4s2 *[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s21s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3 [34]Se硒1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5[36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
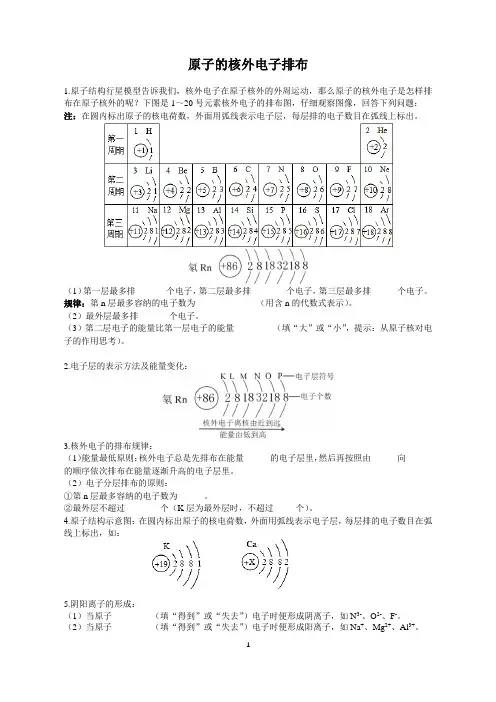
原子的核外电子排布1.原子结构行星模型告诉我们,核外电子在原子核外的外周运动,那么原子的核外电子是怎样排布在原子核外的呢?下图是1~20号元素核外电子的排布图,仔细观察图像,回答下列问题:注:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出。
(1)第一层最多排_______个电子,第二层最多排________个电子,第三层最多排______个电子。
规律:第n层最多容纳的电子数为______________(用含n的代数式表示)。
(2)最外层最多排_______个电子。
(3)第二层电子的能量比第一层电子的能量_________(填“大”或“小”,提示:从原子核对电子的作用思考)。
2.电子层的表示方法及能量变化:3.核外电子的排布规律:(1)能量最低原则:核外电子总是先排布在能量______的电子层里,然后再按照由______向______的顺序依次排布在能量逐渐升高的电子层里。
(2)电子分层排布的原则:①第n层最多容纳的电子数为______。
②最外层不超过________个(K层为最外层时,不超过_____个)。
4.原子结构示意图:在圆内标出原子的核电荷数,外面用弧线表示电子层,每层排的电子数目在弧线上标出,如:5.阴阳离子的形成:(1)当原子_________(填“得到”或“失去”)电子时便形成阴离子,如N3-、O2-、F-。
(2)当原子_________(填“得到”或“失去”)电子时便形成阳离子,如Na+、Mg2+、Al3+。
规律:a.当原子的最外层电子数大于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
b.当原子的最外层电子数小于4时,原子易______(填“得”或“失”)电子形成_____离子(填“阴”或“阳”)。
6.“8e”稳定结构:___________________________________________。
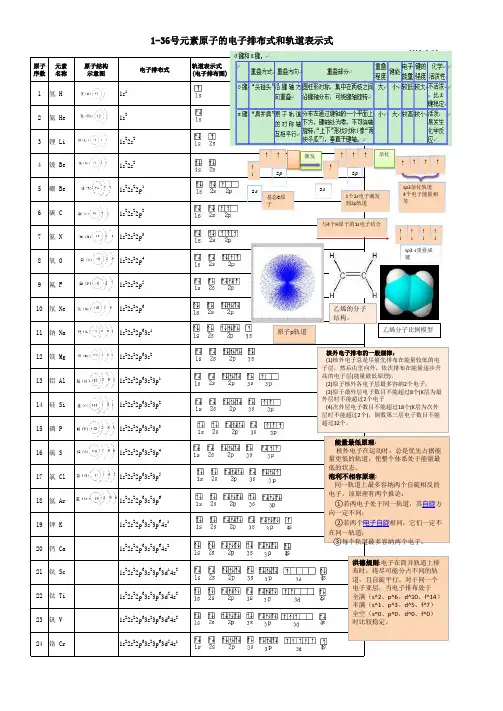
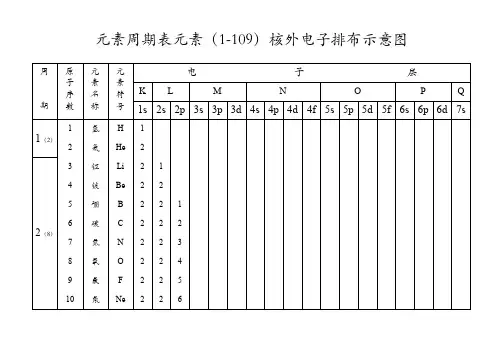




[1]H氢1s1 [2]He氦1s2 [3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1 [6]C碳1s2 2s2 2p2 [7]N氮1s2 2s2 2p3 [8]O氧1s2 2s2 2p4 [9]F氟1s2 2s2 2p5 [10]Ne氖1s2 2s2 2p6 [11]Na钠1s2 2s2 2p6 3s11s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s21s2 2s2 2p6 3s2 3p6 3d3 4s2*[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p31s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 [35]Br溴1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 [36]Kr氪1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E )如下图所示。



核外电子排布★★★★★核外电子排布的原则(1 泡利不相容原理(2 能量最低原理(3 洪特规则【泡利不相容原理】根据光谱实验和周期率,泡利(W.Pauli)提出了著名的泡利不相容原理:在一个原子中,不可能有四个量子数完全相同的两个电子。
因此,在一个轨道中,最多可容纳两个自旋方向相反的电子。
由此可以计算出电子层的最大容量。
下表列出了1~4电子层中电子的最大容量以及主层、亚层、轨道与量子数的关系。
【能量最低原理】核外电子在各轨道上的分布应使原子处于能量最底的状态。
多电子原子在基态时,核外电子总是尽可能分布到能量最低的轨道,这称为能量最低原理。
【洪特规则】n、l相同的轨道,即同一亚层上的各个轨道叫做等价轨道,亦称为简并轨道。
电子分布到能量相同的等价轨道时,将尽可能地分占不同的轨道且自旋平行。
洪特规则应用举例25Mn原子的电子排布式为:1s22s22p63s23p63d54s23d5 ×√★★——全充满、半充满规则(洪特规则的特例)在等价轨道上(n, l相同的亚层),处于全充满(p6、d10、f14)半充满(p3、d5、f7)或全空(p0、d0、f0)的状态时,体系能量较低,状态较稳定。
示例:24Cr 3d54s1而不是:3d44s242Mo 4d55s1而不是:4d45s229Cu 3d104s1而不是:3d94s2▲上述几条分布规律主要是由实验归纳而得,有助于我们掌握、推测大多数元素原子的的核外电子分布状况。
倘有个别原子例外,其电子排布并不符合上述规律。
例如,41Nb是4d45s1 而不是4d35s244Ru是4d75s1而不是4d65s2各元素原子中电子分布的实际情况,最终只能由光谱等实验来确定。
【原子轨道能级的顺序】为了掌握多电子原子的核外电子排布规律,必须了解各种原子轨道的能级高低。
对于多电子原子,每个电子不仅受到原子核的吸引,还受到同原子内其它电子的排斥。
这两种作用的相对大小,决定了原子轨道的能级高低。