分子构型与物质的性质第2课时
- 格式:ppt
- 大小:168.00 KB
- 文档页数:19

第二课时 杂化轨道理论 配合物理论课后篇素养形成 A 组 定向巩固定向巩固一、杂化轨道理论1.下列分子中的中心原子采取sp 2杂化的是( )3H 8223,采取sp 3杂化;CO 2分子中碳原子采取sp 杂化;氯化铍分子中铍原子采取sp 杂化;三氧化硫分子中S 原子采取sp 2杂化。
2.在乙烯分子中有5个σ键、1个π键,它们分别是( )2杂化轨道形成σ键,未杂化的2p 轨道形成π键 2杂化轨道形成π键,未杂化的2p 轨道形成σ键C.C —H 之间是sp 2杂化轨道形成的σ键,C —C 之间是未参加杂化的2p 轨道形成的π键 D.C —C 之间是sp 2杂化轨道形成的σ键,C —H 之间是未参加杂化的2p 轨道形成的π键 解析乙烯分子中的两个碳原子都是采取sp 2杂化,C —H 键是碳原子的杂化轨道与氢原子的s 轨道形成的σ键,C C 键中一个是sp 2杂化轨道形成的σ键,另一个是未杂化的2p 轨道形成的π键。
3.下列推断不正确的是( )3为平面三角形分子H 4+的电子式为[H ∶∶H]+4分子中的4个C —H 键都是氢原子的1s 轨道与碳原子的2p 轨道形成的sp σ键4分子中的碳原子以4个sp 3杂化轨道分别与4个氢原子的1s 轨道重叠,形成4个C —H σ键3为平面三角形;N H 4+为正四面体形;CH 4中碳原子的1个2s 轨道与3个2p 轨道形成4个sp 3杂化轨道,然后与氢原子的1s 轨道重叠,形成4个σ键。
4.下列说法正确的是( )3杂化的分子,其立体构型都是正四面体形2中,中心原子S 采取sp 杂化轨道成键3型的共价化合物,其中心原子A 均采用sp 3杂化形式成键3分子中,中心原子采取sp 3杂化,但NH 3分子为三角锥形,A 错误;在SCl 2中,中心原子S 与2个Cl 形成2个σ键,同时有2对孤电子对,价层电子对数为4,采取sp 3杂化轨道成键,B 错误;杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对,C 正确;AB 3型的共价化合物,当中心原子周围存在一对孤电子对时才采用sp 3杂化形式成键,D 错误。


杂化轨道理论简介配合物理论简介(建议用时:45分钟)[学业达标]1.鲍林是两位获得诺贝尔奖不同奖项的人之一,杂化轨道是鲍林为了解释分子的立体结构提出的。
下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( ) A.sp杂化轨道的夹角最大B.sp2杂化轨道的夹角最大C.sp3杂化轨道的夹角最大D.sp3、sp2、sp杂化轨道的夹角相等【解析】sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°。
【答案】 A2.了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。
下列关于有机物分子成键方式的描述不正确的是( )A.烷烃分子中碳原子均采取sp3杂化成键B.炔烃分子中的碳碳三键由1个σ键、2个π键组成C.苯分子中所有碳原子均采取sp2杂化成键,苯环中存在6个碳原子共有的大π键D.甲苯分子中所有碳原子均采取sp2杂化成键【解析】烷烃分子中碳原子均采取sp3杂化成键,由甲烷得到的甲基上的碳原子也采取sp3杂化,A正确、D错误;三键一定是由1个σ键、2个π键组成的,B正确;苯环上的碳原子都采取sp2杂化,C正确。
【答案】 D3.sp3杂化形成的AB4型分子的立体构型为( )A.平面四边形B.正四面体形C.四角锥形D.平面三角形【解析】sp3杂化形成的AB4型分子的立体构型应该为正四面体形,例如甲烷、四氯化碳等。
【答案】 B4.下列分子的立体构型可用sp2杂化轨道来解释的是( ) 【导学号:90990047】①BF3②CH2===CH2③④CH≡CH⑤NH3⑥CH4A.①②③ B.①⑤⑥C.②③④ D.③⑤⑥【解析】①②③均为平面形分子,中心原子是sp2杂化;④为直线形分子,中心原子是sp杂化;NH3是三角锥形、CH4是正四面体形分子,中心原子均是sp3杂化。
【答案】 A5.下列关于杂化轨道的叙述中,不正确的是( )A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对C.NH3和CH4两个分子中中心原子N和C都是通过sp3杂化轨道成键D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾【解析】中心原子采取sp3杂化轨道成键的分子可能是正四面体(如CH4)、三角锥(如NH3)或者V形(如H2O),A正确;π键是由未参与杂化的轨道“肩并肩”形成的,B正确;正四面体形的CH4和三角锥形的NH3中,中心原子N和C都是通过sp3杂化轨道成键,C正确;杂化轨道理论和VSEPR模型都是为了解释分子的空间结构而提出的理论,两者不矛盾,可以先通过VSEPR模型判断出分子的构型,再判断出中心原子的杂化类型,D错误。



第2课时分子的极性(时间:30分钟)考查点一等电子原理1. 1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。
等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:和;和.(2)此后,等电子原理又有所发展。
例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。
在短周期元素组成的物质中,与NO2-互为等电子体的分子有:、。
解析(1)第2周期元素中,只有B、C、N、O、F可形成共价型分子,同素异形体间显然不能形成等电子体,若为含2个原子的等电子体,则可能是某元素的单质与其相邻元素间的化合物,如N2和CO,在此基础上增加同种元素的原子可得其他的等电子体,如N2O和CO2。
(2)NO2-的最外层的电子数为:5+6×2+1=18,平均每个原子的最外层电子数为6,则可能为O3或SO2,经过讨论知其他情况下,只能形成离子化合物,不合题意.答案(1)N2CO CO2N2O (2)SO2O32。
1949年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。
臭氧能吸收有害紫外线,保护人类赖以生存的空间。
O3分子的结构如图:呈V形,键角116.5°。
三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等的享有着4个电子。
请回答:(1)题中非极性共价键是键,特殊的化学键是键。
(2)臭氧与氧气是。
(3)下列物质的分子与O3分子的结构最相似的是____________________。
A.H2OB.CO2C。
SO2 D。
BeCl2(4)分子中某一原子有1对没有跟其他原子共用的电子叫孤电子对,那么O3分子有对孤电子对。
解析每个原子提供的一个未成对电子形成σ键,若再形成为π键,运用等电子原理找结构相似的分子。
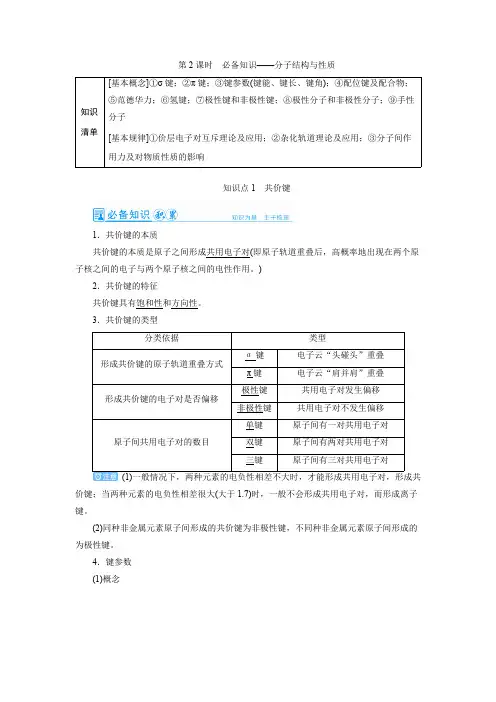
第2课时 必备知识——分子结构与性质知识清单[基本概念]①σ键;②π键;③键参数(键能、键长、键角);④配位键及配合物;⑤范德华力;⑥氢键;⑦极性键和非极性键;⑧极性分子和非极性分子;⑨手性分子[基本规律]①价层电子对互斥理论及应用;②杂化轨道理论及应用;③分子间作用力及对物质性质的影响知识点1 共价键1.共价键的本质共价键的本质是原子之间形成共用电子对(即原子轨道重叠后,高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用。
)2.共价键的特征共价键具有饱和性和方向性。
3.共价键的类型分类依据类型σ键电子云“头碰头”重叠形成共价键的原子轨道重叠方式π键电子云“肩并肩”重叠极性键共用电子对发生偏移形成共价键的电子对是否偏移非极性键共用电子对不发生偏移单键原子间有一对共用电子对双键原子间有两对共用电子对原子间共用电子对的数目三键原子间有三对共用电子对(1)一般情况下,两种元素的电负性相差不大时,才能形成共用电子对,形成共价键;当两种元素的电负性相差很大(大于1.7)时,一般不会形成共用电子对,而形成离子键。
(2)同种非金属元素原子间形成的共价键为非极性键,不同种非金属元素原子间形成的为极性键。
4.键参数(1)概念(2)键参数对分子性质的影响一般情况下,共价键的键能越大,键长越短,分子越稳定。
5.等电子原理(1)等电子体原子总数相同,价电子总数相同的粒子互称为等电子体。
例如,N 2和CO 、O 3与SO 2是等电子体。
(2)等电子原理等电子体具有相似的化学键特征,它们的许多性质相近,此原理称为等电子原理。
例如,CO 和N 2都存在三键,性质较稳定。
常见的等电子体及其空间构型微粒通式价电子总数空间构型CO 2、SCN -、NO、N + 2- 3AX 216e -直线形CO 、NO 、SO 32-3- 3AX 324e -平面三角形SO 2、O 3、NO -2AX 218e -V 形SO 、PO 2- 43-4AX 432e -正四面体形PO 、SO 、ClO 3- 32-3- 3AX 326e -三角锥形CO 、N 2AX 10e -直线形CH 4、NH + 4AX 48e -正四面体形[通关1] (易错排查)判断正误(1)在任何情况下,都是σ键比π键强度大( )(2)ss σ键与sp σ键的电子云形状对称性相同( )(3)σ键能单独形成,而π键一定不能单独形成( )(4)σ键可以绕键轴旋转,π键一定不能绕键轴旋转( )(5)碳碳三键和碳碳双键的键能分别是碳碳单键键能的3倍和2倍( )答案 (1)× (2)√ (3)√ (4)√ (5)×[通关2] (2020·江苏卷,21A 节选)(1)与NH 互为等电子体的一种分子为________(填+4化学式)。
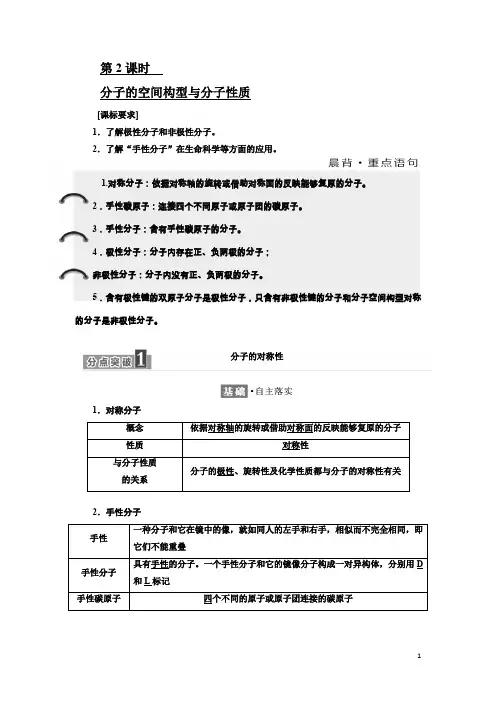
第2课时分子的空间构型与分子性质[课标要求]1.了解极性分子和非极性分子。
2.了解“手性分子”在生命科学等方面的应用。
1.对称分子:依据对称轴的旋转或借助对称面的反映能够复原的分子。
2.手性碳原子:连接四个不同原子或原子团的碳原子。
3.手性分子:含有手性碳原子的分子。
4.极性分子:分子内存在正、负两极的分子;非极性分子:分子内没有正、负两极的分子。
5.含有极性键的双原子分子是极性分子,只含有非极性键的分子和分子空间构型对称的分子是非极性分子。
分子的对称性1.对称分子2.手性分子1.在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性。
下列分子中含有“手性碳原子”的是()A.CBr2F2B.CH3CH2OHC.CH3CH2CH3D.CH3CH(OH)COOH解析:选D手性碳原子连接四个不同的原子或原子团。
2.下列分子含有“手性”碳,属于手性分子的是()A.B.H2NCH2COOHC.D.CH2CH2解析:选C抓住“手性”的含义,C原子上连接有四个不同的原子或原子团,即为手性碳原子。
分子的极性1.分子极性的实验探究2.极性分子和非极性分子[特别提醒]相似相溶原理是指极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
1.极性分子中一定含有极性键,一定不含非极性键吗? 提示:一定含有极性键,可能含有非极性键。
2.非极性分子中一定含有非极性键吗?提示:分子结构对称时,可能含有极性键,而不含有非极性键。
判断分子极性的方法 (1)根据分子的对称性判断分子结构对称,正电荷重心和负电荷重心重合,则为非极性分子,正、负电荷重心不重合,则为极性分子。
(2)根据键的极性判断(3)经验规律①化合价法:若中心原子A 的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,否则为极性分子。
②孤对电子法:若中心原子有孤对电子则为极性分子,否则为非极性分子。

第2课时杂化轨道理论简介配合物理论简介▍课标要求▍1.了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),并能根据杂化轨道理论判断简单分子或离子的构型。
2.能说明简单配合物的成键情况。
要点一杂化轨道理论简介1.来源杂化轨道理论是鲍林为了解释分子的提出的一种价键理论。
2.轨道杂化与杂化轨道甲烷分子中碳原子杂化形成sp3杂化轨道过程:在形成CH4分子时,碳原子的一个轨道和三个轨道发生混杂,形成四个能量相等的杂化轨道。
四个杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
3.杂化类型与分子构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目1个s轨道1个p轨道1个s轨道1个s轨道3个p轨道杂化轨道的数目杂化轨道间的夹角180°空间构型直线形正四面体形实例CO2、C2H2BF3、苯、乙烯CH4、CCl43要点二配合物理论简介1.配位键(1)概念:成键的一方提供孤电子对(配体),另一方面提供空轨道而形成的“电子对给予—接受键”,是一类特殊的键。
如在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供给予铜离子,铜离子接受水分子的孤电子对形成的。
(2)表示:配位键可以用A→B来表示,其中A是孤电子对的原子,叫做体;B是孤电子对的原子。
例如:2.配位化合物(1)定义:与某些(称为)以结合形成的化合物,简称配合物。
(2)配合物的形成举例Cu2++2NH3·H2O===Cu(OH)2↓+2NH+4;Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-;[Cu(NH3)4]2++SO2-4+H2O=====乙醇[Cu(NH3)4]SO4·H2O↓滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,滴加乙醇后析出深蓝色晶体Fe3++3SCN-Fe(SCN)3溶液颜色3渐溶解,为什么?考点一杂化轨道与分子的构型1.杂化与杂化轨道(1)①杂化轨道数等于参与杂化的原子轨道数。

表示形成的氢键。
(3)氢键的本质和性质氢键的本质是静电相互作用,它比化学键弱得多,通常把氢键看作是一种比较强的分子间作用力。
氢键具有方向性和饱和性,但本质上与共价键的方向性和饱和性不同。
①方向性:A—H…B 三个原子一般在同一方向上。
原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
①饱和性:每一个A—H 只能与一个B 原子形成氢键,原因是H 原子半径很小,再有一个原子接近时,会受到A 、B 原子电子云的排斥。
(4)分类:氢键可分为分子间氢键和分子内氢键两类。
存在分子内氢键,存在分子间氢键。
前者的沸点低于后者。
(5)氢键对物质性质的影响:氢键主要影响物质的熔、沸点,分子间氢键使物质熔、沸点升高,分子内氢键使物质熔、沸点降低。
3.溶解性(1)“相似相溶”规律非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂,如蔗糖和氨易溶于水,难溶于四氯化碳;萘和碘易溶于四氯化碳,难溶于水。
(2)影响物质溶解性的因素①外界因素:主要有温度、压强等。
①氢键:溶剂和溶质之间的氢键作用力越大,溶解性越好(填“好”或“差”)。
①分子结构的相似性:溶质和溶剂的分子结构相似程度越大,其溶解性越大,如乙醇与水互溶,而戊醇在水中的溶解度明显减小。
二、分子的手性1.概念(1)手性异构体:具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
(2)手性分子:具有手性异构体的分子。
2.手性分子的判断(1)判断方法:有机物分子中是否存在手性碳原子。
(2)手性碳原子:有机物分子中连有四个各不相同的原子或基团的碳原子。
如,R 1、R 2、R 3、R 4互不相同,即C *是手性碳原子。
课时训练 1.下列说法正确的是A .白磷和单质硫融化时,克服的微粒间作用力类型相同B .在有机物CH 3COOH 中,所有原子均形成了8电子稳定结构C .H 2O 分子中H -O 键键能很大,故水的沸点较高D .NaHSO 4固体中,阴阳离子的个数之比为1:22.下列关于氢键的说法正确的是A .由于氢键的作用,3NH 、2H O 、HF 的沸点反常,且沸点高低顺序为23H O HF NH >>B .氢键只能存在于分子间,不能存在于分子内C .水在1000①以上才会部分分解是因为水中含有大量的氢键D .邻羟基苯甲醛的沸点低于对羟基苯甲醛的原因是前者不存在氢键3.下列有关物质性质的比较,结论不正确的是A .离子还原性:S 2->Cl ->Br ->I -B .酸性:HClO 4>HClO 3>HClOC .键角:SiH 4>PH 3>H 2SD .结合质子能力:OH ->CH 3COO ->Cl -4.下列说法正确的是A .冰和碘晶体中相互作用力相同B .在所有的元素中,氟的第一电离能最大C .共价键的成键原子只能是非金属原子D .元素“氦、铷、铯”等是通过原子光谱发现的5.下列化合物的沸点,前者低于后者的是A .乙醇与氯乙烷B .C 3F 8(全氟丙烷)与C 3H 8C .对羟基苯甲醛与邻羟基苯甲醛D .邻羟基苯甲酸()与对羟基苯甲酸() 6.下列说法正确的是A .化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成B .H 2和Cl 2在光照条件反应生成HCl ,一定有共价键的断裂和形成C .在O 2、CO 2和He 中,都存在共价键,它们均由分子构成D.硫酸钾和硫酸溶于水都电离出硫酸根离子,所以它们在熔融状态下都能导电7.下列关于Si、P、S、Cl及其化合物结构与性质的论述错误的是A.中心原子的半径依次减小是H4SiO4、H3PO4、H2SO4、HClO4中羟基的数目依次减小的原因之一B.结构简式为Cl-的物质中含有不对称原子P,该物质可能有旋光性C.SiCl4、PCl3、SCl2中键角最大的是PCl3D.实验测定分子的极性大小可以区别顺—1,2—二氯乙烯和反—1,2—二氯乙烯8.下列现象,不能用氢键知识解释的是A.葡萄糖易溶于水B.在4①时水的密度最大C.HClO4是一种强酸D.水通常情况下是液态9.(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置___________。

促敦市安顿阳光实验学校杂化轨道理论、配合物理论一、选择题1.下列分子的中心原子是sp 2杂化的是 09440309( )A .PBr 3B .CH 4C .H 2OD .BF 3答案:D解析:杂化轨道数=中心原子的孤电子对的对数+中心原子的σ键个数,A 、B 、C 采用的都是sp 3杂化。
2.(双选)下列各组离子中,中心原子的杂化轨道类型相同的是 09440310( )A .NO -3、ClO -3 B .SO 2-3、CO 2-3C .NH +4、PH +4 D .SO 2-3、SO 2-4答案:CD解析:可以由VSEPR 模型来判断离子的立体构型,再判断杂化轨道类型。
NO -3中N 原子上无孤电子对[12(5+1-3×2)=0],ClO -3中Cl 原子上孤电子对数为1[12(7+1-3×2)=1],分别为平面三角形和三角锥形,N 、Cl 原子采取sp2和sp 3杂化。
同理,SO 2-3中S 原子上孤电子对数为1、CO 2-3中C 原子上无孤电子对,S 、C 原子分别采取sp 3、sp 2杂化。
因此,SO 2-3、SO 2-4中S 原子均为sp 3杂化。
3.用过量硝酸银溶液处理0.01 mol 氯化铬水溶液,产生0.02 mol AgCl沉淀,则此氯化铬最可能是 09440311( )A .[Cr(H 2O)6]Cl 3B .[Cr(H 2O)5Cl]Cl 2·H 2OC .[Cr(H 2O)4Cl 2]Cl·2H 2OD .[Cr(H 2O)3Cl 3]·3H 2O答案:B解析:0.01 mol 氯化铬能生成0.02 mol AgCl 沉淀,说明1 mol 配合物的外界含有2mol Cl -。
4.由配位键形成的离子[Pt(NH 3)6]2+和[PtCl 4]2-中,中心原子铂的化合价是 09440312( )A .都是+8B .都是+6C .都是+4D .都是+2答案:D解析:NH 3是中性配位体,Cl -带一个单位的负电荷,所以配离子[Pt(NH 3)6]2+和[PtCl 4]2-中,中心原子铂的化合价都是+2。
分子结构与物质的性质第2课时◆教学目标1. 认识分子间存在相互作用,知道范德华力是常见的分子间作用力;能说明范德华力对物质熔沸点等性质的影响,形成“结构决定性质”的基本观念。
2. 知道氢键使常见的分子间作用力;能说明氢键对物质熔点、沸点等性质的影响,能举例说明氢键对于生命的重大意义。
◆教学重难点分子间作用力、氢键及其对物质性质的影响。
◆教学过程一、新课导入为什么气体在降温加压时会液化?液体在降温时会凝固?从微观过程来看,气体在液化、液体在凝固的过程中,分子间的平均距离在逐渐减小。
固体、液体在宏观上能够彼此凝聚在一起,说明分子间存在着相互作用力。
液化、凝固的过程中,随着分子间距离减少,分子间这种普遍的作用力逐渐增强;同理,在熔化、汽化的过程中,随着分子间距离增大,分子间这种普遍的作用力逐渐减弱。
二、讲授新课二、分子间的作用力1. 范德华力及其对物质性质的影响范德华是最早研究分子间普遍存在作用力的科学家,因而把这类分子间作用力称为范德华力。
范德华力很弱,比化学键的键能小1~2个数量级。
其强度一般是2~20 kJ/mol。
【提问】(1)下表列举了某些分子间的范德华力,结合分子结构的特点和数据,可以得出怎样的结论?【讲解】1.HCl、HBr、HI三者分子结构结构相似,均为直线形。
HCl、HBr、HI的相对分子质量逐渐增大,范德华力逐渐增大。
2.Ar的相对分子质量大于CO和HCl,但CO、HCl分子间的范德华更大,因为CO和HCl是极性分子。
分子的极性越大,范德华力越大。
【提问】(2)下表列举了卤素单质的熔点和沸点,怎样解释卤素单质从F2~I2的熔点和沸点越来越高?【讲解】相对分子质量从F2~I2逐渐增大,且它们均为非极性分子,因此卤素单质分子间的范德华力从F2~I2逐渐增大。
熔化或沸腾过程中分子距离增大,分子间的范德华力被破坏。
范德华力越强,破坏所需的条件就更为剧烈,所需外界提供的能量就越多。
因此微观上分子间的范德华力越强,宏观上物质表现为在更高的温度下才发生熔化和沸腾,物质拥有更高的熔点、沸点。
促敦市安顿阳光实验学校杂化轨道理论与配合物理论1.关于原子轨道的说法正确的是( )A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的一个s轨道和3个p轨道混合起来形成的一组能量相同的轨道D.凡AB3型的共价化合物,其中心原子A均采取sp3杂化轨道成键解析:中心原子采取sp3杂化,四个sp3杂化轨道在空间的形状是正四面体,但如果中心原子还有孤电子对,分子的空间结构不是正四面体。
CH4分子中的sp3杂化轨道是C原子的一个2s轨道与三个2p轨道杂化而成的。
AB3型共价化合物,A原子可能采取sp2杂化或sp3杂化。
答案:C2.已知次氯酸分子的结构式为H—O—Cl,下列说法正确的是( )A.O原子发生sp杂化B.O原子与H、Cl都形成π键C.该分子为V型分子D.该分子的电子式是H∶O∶Cl解析:中心原子O与H和Cl分别形成了2个σ键,另外还有两对孤电子对,所以O采取的是sp3杂化方式;由于孤电子对的影响,分子结构是V形;单键都是σ键;电子式中该写出孤电子对。
答案:C3.下列关于配位化合物的叙述不正确的是 ( )A.配位化合物中必存在配位键B.配位化合物中只有配位键C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键D.配位化合物在半导体尖端技术、医学、催化反和材料化学领域都有广泛的用解析:配位化合物中一含有配位键,但也含有其他化学键;Cu2+提供空轨道,H2O中的O原子提供孤电子对,两者结合形成配位键。
答案:B4.如图是卟啉配合物叶绿素的结构示意图,有关的叙述正确的是( )A.该叶绿素只含有H、Mg、CB.该叶绿素是配合物,中心离子是镁离子C.该叶绿素是配合物,其配体是ND.该叶绿素不是配合物,而是高分子化合物解析:Mg的最高化合价为+2,而化合物中Mg与4个氮原子作用,由此可以判断该化合物中Mg与N间形成配位键,该物质为配合物,B项正确,D项错误;该化合物组成中还含有氧元素和氮元素,A项错误;该化合物中配位原子为N,而不能称为配体,同样也不能称配体是氮元素,因为配体一般可以是离子或分子,C项错误。
第2课时共价键的键参数等电子原理▍课标要求▍能用键能、键长、键角等说明简单分子的某些性质。
要点一键参数——键能、键长与键角1.键参数概念意义键能气态基态原子形成1 mol化学键的键能越大,键越,越不易键长形成共价键的两个原子之间的键长越短,键能,键越键角两个共价键之间的夹角表明共价键有,决定分子的空间构型思考1:如何比较不同分子中相同类型共价键的键能的大小?要点二等电子原理思考2:根据所学知识和等电子原理,试举出几种等电子体。
考点一键参数意义及应用1.键能的应用(1)判断共价键的稳定性。
共价键的键能越大,共价键越牢固。
原子间形成共价键时,原子轨道重叠程度越大,体系能量降低越多,释放能量越多。
(2)判断分子的稳定性。
一般来说,结构相似的分子,共价键的键能越大,分子越稳定。
(3)判断物质反应活性的大小。
H—F键、O—H键、N—H键的键能依次是568 kJ/mol、462.8 kJ/mol、390.8 kJ/mol,N—H键、O—H键、H—F键键能依次增大,形成这些键时放出的能量依次增多,化学键稳定性依次增强,所以N2、O2、F2与H2的反应的难易程度为由难到易。
(4)利用键能计算反应热。
键能与反应热的关系为ΔH=E(反应物总键能)-E(生成物总键能)。
若反应物总键能>生成物总键能即ΔH>0,则反应吸热;若反应物总键能<生成物总键能即ΔH<0,则反应放热。
2.键长的影响因素及意义(1)影响因素影响共价键键长的因素是成键原子的半径。
原子半径越小,键长越短。
例如,H—H键的键长是0.74×10-10m,Cl—Cl键的键长是1.98×10-10m。
(2)意义一般来说,形成共价键的键长越短,则键能越大,共价键越牢固,含有该共价键的分子越稳定。
如HF、HCl、HBr、HI中,H—F键、H—Cl键、H—Br键、H—I键的键长逐渐增大,键的稳定性逐渐减弱,从HF、HCl、HBr到HI,分子越来越不稳定;无氧酸水溶液酸性:HF<HCl<HBr<HI;同理,氧族元素氢化物的稳定性:H2O>H2S>H2Se>H2Te,而水溶液的酸性:H2S<H2Se<H2Te。
知识目标第一章分子结构与性质第二节分子的立体结构:(第二课时)能力目标1.认识杂化轨道理论的要点2.进一步了解有机化合物中碳的成键特征3.能根据杂化轨道理论判断简单分子或离子的构型过程重点杂化轨道理论的要点难点杂化轨道理论教学过程备注[复习]共价键类型:σ、π键,价层电子对互斥模型。
[质疑] 我们已经知道,甲烷分子呈正四面体形结构,它的4个C--H键的键长相同,H—C--H的键角为109~28°。
按照我们已经学过的价键理论,甲烷的4个C--H单键都应该是π键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的ls原子轨道重叠,不可能得到四面体构型的甲烷分子。
为什么?[讲]碳原子具有四个完全相同的轨道与四个氢原子的电子云重叠成键。
[引入]碳原子的价电子构型2s22p2,是由一个2s轨道和三个2p轨道组成的,为什么有这四个相同的轨道呢?为了解释这个构型Pauling提出了杂化轨道理论。
[板书]三、杂化轨道理论简介1、杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
[讲]杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体结构提出的。
为了解决甲烷分子四面体构型,鲍林提出了杂化轨道理论,它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当碳原子跟4个氢原子结合时,碳原子以4个sp3杂化轨道分别与4个氢原子的ls轨道重叠,形成4个C--Hσ键,因此呈正四面体的分子构型。
[投影][讲]杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。
但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。