高中化学 4.1《分子构型与物质的性质》教案苏教版选修3
- 格式:doc
- 大小:797.50 KB
- 文档页数:7


第一单元分子构型与物质的性质第1课时分子的空间构型●课标要求1.能根据有关理论判断简单分子或离子的构型。
2.结合实例说明“等电子原理”的应用。
●课标解读1.能准确判断共价分子中中心原子的杂化轨道类型。
2.能用杂化轨道理论和价层电子对互斥理论判断分子的空间构型。
3.利用“等电子原理”推测分子或离子中中心原子的杂化轨道类型及空间构型。
●教学地位本节主要内容有:(1)杂化轨道的类型;(2)分子的空间构型;(3)等电子原理。
上述内容在近几年的高考试题中,重现率较高,是各级考试命题的热点内容。
●新课导入建议研究表明,CH4分子为正四面体构型,所以CH2Cl2的结构只有一种,为四面体形。
最新研制的一种分子式为PtCl2(NH3)2的抗癌药,其有2种固体,一种为淡黄色,在水中的溶解度较小,有抗癌作用;一种为黄绿色,在水中的溶解度较大,但没有抗癌作用。
(1)PtCl2(NH3)2是否和CH2Cl2一样具有四面体结构?(2)两种固体溶解度不同的原因是什么?若解决上述问题,请学习“分子构型与物质的性质”。
●教学流程设计课前预习安排:阅读教材P66~72。
⇒步骤1:引入新课⇒步骤2:处理CH4的空间完成[课前自主导学]构型:(1)sp3杂化。
(2)CH4分子中化学键的形成。
(3)空间构型。
其中:师生一起突破sp3杂化。
⇒步骤3:BF3、BeCl2的空间构型:模仿处理CH4的空间构型的模式,通过同学之间交流讨论,老师轮回指导完成,同时完成[探究1],将分析中心原子杂化方式上升到一般规律高度。
⇓步骤7:布置作业:完成[课后知能检测]⇐步骤6:处理[当堂双基达标]⇐步骤5:课堂小结⇐4(1)杂化轨道的形成碳原子2s 轨道上的1个电子进入2p 空轨道,1个2s 轨道和3个2p 轨道“混合”,形成能量相等、成分相同的4个sp 3杂化轨道。
图示为:(2)sp 3杂化轨道的空间指向碳原子的4个sp 3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子。


《分子构型与物质的性质复习课》导学案[考纲分析]①了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布。
了解原子核外电子的运动状态。
②了解元素电离能的含义,并能用以说明元素的某些性质。
③了解电负性的概念,知道元素的性质与电负性的关系。
④了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3)。
⑤能用价层电子对互斥理论或者杂化轨道理论、等电子体原理推测常见的简单分子或者离子的空间结构。
⑥能够根据晶胞确定晶体的组成并进行相关的计算。
⑦能判断物质所属的晶体类型,并能比较熔沸点的高低。
⑧能画出简单配离子的结构式。
⑨了解共价键的形成。
[写一写]边听歌边默写出1~36号的元素符号[忆一忆]原子的电子排布式和轨道表示式(1)电子排布式的书写格式:(2)轨道表示式的书写格式:[考考你]:1.第四周期中未成对电子数最多的原子是(填元素符号),写出其基态原子的核外电子排布式。
2、Cu的价电子排布式为,Cu+的价电子排布式为,Cu2+的电子排布式为。
3.As的价电子排布图为; As的基态原子中能量最高的能级符号为,其电子云图的形状为。
[讨论并归纳]请同学们总结出确定ABm型中心原子的杂化类型的方法。
[归纳总结] 请同学们总结出确定分子或离子几何构型的方法。
[考考你]:1.正四面体形的分子或离子有:,其中心原子的杂化方式为,可归类为AB 型,键角为,中心原子(填有或无)孤电子对。
2.三角锥形的分子或离子有:,其中心原子的杂化方式为,可归类为AB 型,中心原子有孤电子对。
3.V形的分子或离子有:,中心原子可采用的杂化方式为,可归类为AB 型,中心原子有孤电子对。
4.平面三角形的分子或离子有:,其中心原子的杂化方式为,若为正三角形则键角为。
5.直线形的分子或离子有:,其中心原子的杂化方式为,键角为。
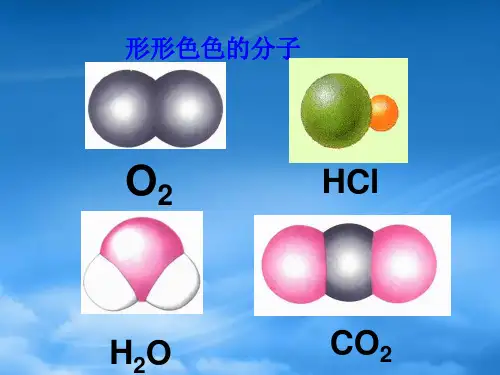
6、写出CO2、H2O、NH3、HCHO、CH4等分子的电子式、结构式及分子的空间结构。

4.1 分子构型与物质的性质学案(苏教版选修3)背景链接现代化学键理论随着20世纪以来各种物理实验方法的发展,人们对电子、原子等微观粒子运动规律的认识不断深入。
1990年普朗克提出能量量子理论,冲破了经典物理学中能量连续变化的框框。
1911年卢瑟福提出了行星绕日的原子模型。
在这些实验和理论的基础上,1913年玻尔提出著名的原子结构模型,它能很好地解释氢原子定态结构和光谱,但在研究多电子原子或分子时,得不到满意解释。
1923年德布罗意对光具有波粒二象性的假设,于1927年被戴维森电子衍射实验证实。
1926年薛定谔提出了波动方程,将电子波动性用函数来描写。
1927年海特勒与伦敦在解薛定谔方程式时,经假设、光谱证明:H2中的两个电子是自旋反平行的一对,两个氢原子结合成稳定的氢分子,是由于电子分布主要集中在两个原子核之间;从而产生了新的化学键概念。
为了阐明共价键的形成,20世纪30年代初期建立两种化学键理论:一种是价键理论,另一种是分子轨道理论。
知识链接1.化学键相邻的原子之间强烈的相互作用。
(1)原子是广义上的原子,既包括中性原子,也包括带电原子或原子团。
(2)相邻原子间的相互作用。
物质内不相邻的原子间也有相互作用,它们之间的相互作用不是化学键。
(3)原子间强烈的相互作用。
如果物质内相邻的两个原子间的作用很弱,如氦气中相邻的氦原子之间的作用,就不是化学键。
2.共价键原子之间通过共用电子对所形成的相互作用。
(1)共用电子对:共用电子对可以是两原子共同提供的,也可以是某原子单方面提供的,可位于两原子中间,也可以产生偏向和偏离。
(2)共价键可以存在于单质分子中,如H2中;但单质分子中不一定存在共价键,如He分子中,共价键还要存在于化合物分子之中,如HCl中。
(3)共价化合物中一定有共价键,离子化合物中可能存在共价键(如NH4Cl),也可能不存在共价键(如NaCl)。
酸不论强弱,分子中只存在共价键,不存在离子键。

高中化学专题4 分子空间结构与物质性质 4.1.1 分子的空间构型学案苏教版选修3编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学专题 4 分子空间结构与物质性质4.1.1 分子的空间构型学案苏教版选修3)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学专题4 分子空间结构与物质性质 4.1.1 分子的空间构型学案苏教版选修3的全部内容。
专题4 分子空间结构与物质性质第一单元分子构型与物质的性质第1课时分子的空间构型学习目标能用杂化轨道理论、价层电子对互斥模型及等电子原理解释或预测一些分子或离子的空间构型。
一、杂化轨道及其类型1.杂化轨道(1)碳原子的电子排布式为__________,当2s的一个电子被激发到2p空轨道后,电子排布式为____________.(2)在外界条件影响下,原子内部能量________的原子轨道_________________的过程叫做原子轨道的杂化,重新组合后的新的原子轨道,叫做________________________,简称________________.(3)参与杂化的原子轨道数等于________________________.(4)原子轨道的杂化改变了原子轨道的____________________。
原子轨道的杂化使原子的成键能力增加。
(5)杂化轨道为使相互间的排斥力最小,故在空间取最大夹角分布,不同的杂化轨道伸展方向________。
在多原子分子中,两个化学键之间的夹角叫做__________。
键角与分子的形状(立体构型)有密切联系。
2.杂化轨道类型和空间构型(1)sp型杂化对于非过渡元素,由于n s、n p能级的能量接近,往往采用sp型杂化,而sp型杂化又分为sp杂化:________s轨道和________p轨道间的杂化。

高中化学专题4第1单元分子构型与物质的性质第3课时分子的极性手性分子教案苏教版选修3第3课时分子的极性手性分子[核心素养发展目标] 1.了解极性分子、非极性分子、手性分子的概念,能从微观角度理解分子具有极性(或非极性)、手性的原因。
2.会判断分子的极性,了解分子的极性对分子性质的影响。
一、分子的极性1.分子的极性(1)极性分子和非极性分子(2)键的极性与分子极性之间的关系①只含非极性键的分子一定是非极性分子。
②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子,否则为极性分子。
2.分子的极性对物质溶解性的影响(1)相似相溶规则:极性分子(如HCl)易溶于水等极性溶剂,非极性分子(如I2)易溶于苯、四氯化碳等非极性溶剂。
(2)一般来说,同是非极性分子,相对分子质量越大,溶解度越大。
(1)键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
(2)极性分子中一定有极性键,非极性分子中不一定含有非极性键。
例如CH4是非极性分子,只有极性键。
(3)含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
例1下列各组物质中,都是由极性键构成的极性分子的是( )A.CH4和H2O B.CO2和HClC.NH3和H2S D.HCN和BF3答案 C解析极性键是存在于不同元素原子之间的共价键;极性分子是分子的正电中心和负电中心不重合的分子。
NH3是呈三角锥型的极性分子;CO2是呈直线形的非极性分子;H2O、H2S都是呈V形的极性分子;HCl、HCN都是呈直线形的极性分子;CH4是呈正四面体型的非极性分子,BF3是呈平面三角形的非极性分子。
思维启迪——判断分子极性的一般思路例2碘单质在水中溶解度很小,但在CCl 4中溶解度很大,这是因为( )A.CCl4和I2都不含氢元素,而H2O中含有氢元素B.CCl4和I2都是非极性分子,而H2O是极性分子C.CCl4与I2都是直线形分子,而H2O不是直线形分子D.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大答案 B解析CCl4和I2都是非极性分子,而H2O是极性分子,根据“相似相溶”规则可知碘单质在水中溶解度很小,但在CCl4中溶解度很大,与相对分子质量、是否是直线形分子、是否含有氢元素等没有直接的关系,B正确。

第一单元 分子构型与物质的性质1.初步认识分子空间构型、键角、极性分子、非极性分子、手性分子等概念。
2.了解杂化轨道的类型(sp 3、sp 2、sp),并能运用杂化轨道理论判断分子的空间构型。
3.能根据价层电子对互斥模型判断简单分子或离子的空间构型。
4.结合实例说明“等电子原理”的应用。
5.认识分子的空间构型与极性的关系,能运用有关理论预测分子的极性。
分子的空间构型1.杂化轨道理论 (1)轨道的杂化原子内部能量相近的原子轨道重新组合,形成与原轨道数目相等的一组新轨道的过程。
(2)杂化轨道杂化后形成的新的能量相等、成分相同的一组原子轨道。
(3)杂化类型 ①sp 杂化sp 杂化轨道是由一个n s 轨道和一个n p 轨道组合而成的,每个sp 杂化轨道都含有12s和12p 轨道的成分,杂化轨道间的夹角为180°,呈直线形。
②sp 2杂化sp 2杂化轨道是由一个n s 轨道和两个n p 轨道组合而成的,每个sp 2杂化轨道都含有13s和23p 轨道的成分,杂化轨道间的夹角为120°,呈平面三角形。
③sp 3杂化sp 3杂化轨道是由一个n s 轨道和三个n p 轨道组合而成的,每个sp 3杂化轨道都含有14s和34p 轨道的成分,杂化轨道间的夹角为109.5°,空间构型为正四面体形。
(1)在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化。
双原子分子中,不存在杂化过程。
(2)只有能量相近的轨道才能杂化(n s ,n p)。
(3)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化的原子轨道数目相等。
(4)杂化过程中,轨道的形状发生变化。
2.价层电子对互斥模型(1)分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
电子对之间的夹角越大,排斥力越小。

[课后练习]一、选择题1.最早提出轨道杂化理论的是()A.美国的路易斯B.英国的海特勒C.美国的鲍林D.法国的洪特2.下列关于杂化轨道理论的说法不正确的是()A.原子中能量相近的某些轨道,在成键时,能重新组合成能量相等的新轨道B.轨道数目杂化前后可以相等,也可以不等C.杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理D.杂化轨道可分等性杂化轨道和不等性杂化轨道3.用杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是()A.C原子的四个杂化轨道的能量一样B.C原子的sp3杂化轨道之间夹角一样C.C原子的4个价电子分别占据4个sp3杂化轨道D.C原子有1个sp3杂化轨道由孤对电子占据4.关于原子轨道的说法正确的是()A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键5.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是()A.sp杂化轨道的夹角最大 B.sp2杂化轨道的夹角最大C.sp3杂化轨道的夹角最大D.sp3、sp2、sp杂化轨道的夹角相等6.乙烯分子中含有4个C—H和1个C=C双键,6个原子在同一平面上。
下列关于乙烯分子的成键情况分析正确的是()A.每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道B.每个C原子的1个2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道C.每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道D.每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道7.下列分子中心原子是sp2杂化的是()A.H2SB.CH4C.BF3D.H2O8.下列含碳化合物中,碳原子发生了sp3杂化的是()A.CH4B.CH2=CH2C.CH≡CHD.9.已知次氯酸分子的结构式为H—O—Cl,下列有关说法正确的是()A.O原子发生sp杂化 B.O原子与H、Cl都形成σ键C.该分子为直线型分子D.该分子的电子式是H︰O︰Cl10.对SO2与CO2说法正确的是()A.都是直线形结构B.中心原子都采取sp杂化轨道C.S原子和C原子上都没有孤对电子D.SO2为V形结构,CO2为直线形结构11.下列分子中的中心原子杂化轨道的类型相同的是()A.CO2与SO2B.CH4与NH3C.BeCl2与BF3D.C2H2与C2H4 12.(06高考广东)研究发现,烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃。
[课后练习]一、选择题1.下列说法中不正确的是()A.共价化合物中不可能含有离子键B.有共价键的化合物,不一定是共价化合物C.离子化合物中可能存在共价键D.原子以极性键结合的分子,肯定是极性分子2.下列四种分子中,只含极性键而没有非极性键的是()A.CH4B.CH3CH3C.CH2=CH2D.CH≡CH3.下列分子中,属于含有极性键的非极性分子的一组是()A.CH4、CCl4、CO2B.C2H4、C2H2、C6H6C.Cl2、H2、N2D.NH3、H2O、SO24.下列现象不能用“相似相溶”规律解释的是()A.氯化氢易溶于水B.氯气易溶于NaOH溶液C.碘易溶于CCl4 D.碘难溶于水5.下列物质易溶于苯的是()A.NH3 B.HF C.I2 D.Br26.下列分子中,属于含有极性键的非极性分子的一组是()A.CH4、CCl4、CO2B.C2H4、C2H2、C6H6C.Cl2、H2、N2D.NH3、H2O、SO27.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。
下列分子中含有“手性碳原子”的是()A.CBr2F2 B.CH3CH2OH C.CH3CH2CH3 D.CH3CH(OH)COOH8.下列有机物分子中带“*”碳原子就是手性碳原子。
该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是()A.与乙酸发生酯化反应B.与NaOH水溶液反应C.与银氨溶液作用只发生银镜反应D.催化剂作用下与H2反应9.已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论错误的是()A.氯化铝是电解质B.固体氯化铝是分子晶体C.可用电解熔融氯化铝的办法制取金属铝D.氯化铝为非极性分子10.根据“相似相溶”的规律,下列溶剂可以用来从溴水中萃取溴的是()(1)酒精(2) CCl4(3)液氨(4)苯(5)直馏汽油A.(1)(2)(4)(5)B.(2)(4)(5)C.(1)(3)(5)D.(1)( 3)(4)11.根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是()A .乙烯B .二氧化碳 C.二氧化硫 D.氢气二、填空题12.我们可把共价键按分为极性键和非极性键,而共价键产生极性的根本原因是,故此有人这样判断键的极性:凡是同种元素原子间形成的共价键属极性键,凡是异种元素原子间形成的共价键属非极性键。
分子构型与物质的性质[学习内容]二、分子的极性1.非极性分子和极性分子(1)极性分子:正电荷重心和负电荷重心不相重合的分子(2)非极性分子:正电荷重心和负电荷重心相重合的分子23⑴只含有非极性键的单质分子是非极性分子。
⑵含有极性键的双原子化合物分子都是极性分子。
⑶含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的为极性分子。
注意:判断ABn型分子可参考使用以下经验规律:①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子;(CH4)②若中心原子有孤对电子(未参与成键的电子对)则为极性分子,若无孤对电子则为非极性分子。
③常见的极性分子:CH3Cl、CHCl3、CH2Cl2、H2O、H2O2、HCl等常见的非极性分子:H2、O2、CO2、CS2、P4、BF3、SO3、 CH4、CCl4、乙烷、乙烯、乙炔、苯4.应用:(1)相似相溶(2)极性分子与非极性分子在电场作用下的偏转二、手性分子1.手性异构体和手性分子一对分子,组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间无论如何旋转不能重叠,这对分子互称手性异构体。
有手性异构体的分子称为手性分子。
中心原子称为手性原子。
2.手性碳原子手性碳原子:是指连有四个不同的原子或原子团的碳原子3.注意:(1)手性分子之间互为同分异构体,称为手性异构体。
(2)手性分子在生命化学中的重要作用。
[习题研究]在有机物分子中,常把连有四个不同原子或原子团的碳原子称为“手性碳原子”,可用“C*”标记。
如:含有生命活性的物质不少都含有“手性碳原子”。
具有某些光学活性的有机分子中必含有“手性碳原子”。
某新合成的化合物A 经测定具有光学活性,其结构简式为:若通过适当的反应使A失去光学活性,请回答下列问题:(1)保持A分子中碳原子数不变(两种方法):①有机反应类型:反应,对应有机物的结构简式:②有机反应类型:反应,对应有机物的结构简式:(2)使A的分子中碳原子数增加2:有机反应类型:反应,对应有机物的结构简式:(3)使A的分子中碳原子数减少2:有机反应类型:反应,对应有机物的结构简式:。
第一单元分子构型与物质的性质
第一课时分子的空间构型
【学习目标】
1.理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;
2.学会用杂化轨道原理解释常见分子的成键情况与空间构型;
3.掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;
4.了解等电子原理及其应用。
【学习重点】杂化轨道理论、价层电子对互斥理论、分子空间构型的简易方法、等电子原理【学习难点】杂化轨道理论、价层电子对互斥理论
【学习方法】讲解法、归纳法
【教学过程】
〖你知道吗〗
1.O原子与H原子结合形成的分子为什么是H2O,而不是H3O或H4O?
2.C原子与H原子结合形成的分子为什么是CH4,而不是CH2?CH4分子为什么具有正四面体结构?
3.为什么H2O分子是“V”型.键角是10
4.5°,而不是“直线型”或键角是“90°”?
一、杂化轨道理论(1931年,美国化学家鲍林L.Pauling提出)
1. CH4—— sp3杂化
轨道排布式:
电子云示意图:
(1)能量相近的原子轨道才能参与杂化;
(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以C原子与H原子结合成稳定的CH4,而不是CH2。
(3)杂化轨道能量相同,成分相同,如:每个sp3杂化轨道占有个s轨道、个p轨
道;
(4)杂化轨道总数等参与杂化的原子轨道数目之和,如个s轨道和个p轨道杂化成个sp3杂化轨道
(5)正四面体结构的分子或离子的中心原子,一般
..采取sp3杂化轨道形式形成化学键,如CCl4、NH4+等,原子晶体金刚石、晶体硅、SiO2等中C和Si也采取sp3杂化形式,轨道间夹角为。
2. BF3—— sp2杂化型
用轨道排布式表示B原子采取sp2杂化轨道成键的形成过程:
电子云示意图:
(1)每个sp2杂化轨道占有个s轨道、个p轨道;
(2)sp2杂化轨道呈型,轨道间夹角为;
(3)中心原子通过sp2杂化轨道成键的分子有、等。
〖思考、讨论〗
根据现代价键理论即“电子配对理论”,Be原子外围电子排布式为2s2,电子已配对不能形成共价键,但气态BeCl2分子却能稳定存在,为什么?
3. 气态BeCl2—— sp杂化型
用轨道排布式表示Be原子采取sp杂化轨道成键的形成过程:
电子云示意图:
(1)每个sp杂化轨道占有个s轨道、个p轨道;
(2)sp杂化轨道呈型,轨道间夹角为;
(3)中心原子通过sp杂化轨道成键的分子有、等。
〖思考〗为何不能形成气态BeCl4分子?
【例题选讲】
例1. 根据乙烯、乙炔分子的结构,试用杂化轨道理论分析乙烯和乙炔分子的成键情况。
例2:试用杂化轨理论解释石墨、苯的结构
小结:请填写下表
表1 杂化轨道类型与杂化轨道空间构型
杂化类型轨道成分轨道空间构型轨道间夹角相关实例sp
sp2
sp3
*dsp3或
sp3d
------ 三角双锥90°、120°PCl5
*d2sp3或
sp3d2
------ 八面体90°、180°SF6
〖思考、讨论〗NH3、H2O分子中键角分另为107°18′、104.5°,与109°28′相差不大,由此可推测,N、O原子的原子轨道可能采取何种类型杂化?原子轨道间夹角小于109°28′,可能说明了什么问题?
二、价层电子对互斥理论(1941年西奇威克、吉来斯比等提出)
1. 价电子对:包括孤对电子对和成键电子对,一般孤对电子对离核较近。
2. 价电子对之间存在相互排斥作用,为减小斥力,相互之间尽可能远离,因此分子的空间构型受到影响,一般,分子尽可能采取对称的空间结构以减小斥力。
相邻电子对间斥力大小顺序:
孤对电子对↔孤对电子对>孤对电子对↔成键电子对>成键电子对↔成键电子对 *叁键↔叁键>叁键↔双键>双键↔双键>双键↔单键>单键↔单键 三、不等性杂化
NH 3、H 2O 的分子构型也可通过不等性杂化解释,即中心原子的孤对电子也参与杂化,得到性质不完全等同的杂化轨道,轨道的s 成分和p 成分不全相同,孤对电子对较密集于氮原子或氧原子周围。
由于孤对电子对的杂化轨道排斥成键电子的杂化轨道,以致轨道夹角不等,氨分子和水分子成键电子对之间的夹角都小于109°28′。
水分子中的氧原子有两个孤对电子对,它的O-H 键之间的夹角比氨分子中N-H 键之间夹角受到的排斥力作用更大。
例3. BF 3是平面三角型的几何构型,但NF 3却是三角锥型的几何构型,试用所学理论加以说明。
四、确定分子空间构型的简易方法
1. 对于AB m 型分子
(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,
如:PCl 5 中52
5
15=⨯+=
n (2)O 、S 作为配位原子时按不提供价电子计算,作中心原子时价电子数为6; (3)离子的价电子对数计算 如:NH 4+
: 421415=-⨯+=
n ; SO 42- :42
2
06=++=n
2. 对于AB m 型分子的空间构型(分子空间构型指不包括孤对电子对的空间的排布)
(2)价层电子对数≠配位原子数时(一般存在孤对电子对),分子空间构型与杂化轨道空间构型不同,一般由于价层电子对之间的斥力不同导致。
确定分子的稳定构型时应考虑三种电子对之间的排斥作用:一般孤对电子对间排斥作用数最少为最稳定构型,其次考虑孤对电子对-成键电子对排斥作用数,最后考虑成键电子对-成键电子对排斥作用数。
如:XeF 4分子空间构型的确定:价层电子对为6,电子对构型为八面体,Xe 的配位原子数为4,存在两对孤对电子对,分子空间构型可能存在以下两种:
(a ) (b) 构型: (a ) (b) 孤对电子对-孤对电子对排斥作用数: 0 1
孤对电子对-成键电子对排斥作用数: 8 6 成键电子对-成键电子对排斥作用数: 4 5
构型(a )比构型(b )的孤对电子对-孤对电子对排斥作用数少,因此,构型(a )是XeF 4较稳定的空间构型。
说明:电子对空间构型与分子构型既有区别又有联系,分子构型可根据价层电子对互斥理论
从电子对空间构型推导而得,此规律一般不适用于推测过渡金属化合物的几何构型,对极少数化合物判断也不准,如:CaF2、SrF2、BaF2,是弯曲型而不是预期的直线型。
表2 部分分子的空间构型与价层电子对空间构型
价电子对数杂化轨道/电子
对空间构型
轨道夹角实例
成键
电子
对数
孤对
电子
对数
分子空间
构型
键角
n=3 平面
三角
120°
SO2、
PbCl2
2
2
1
1
V型
V型
119.5°
----
n=4 正四
面体
109°28′H2O、NH3
2
3
2
1
V型、
三角锥型
104.5°、
107°18′
*n=5 三角
双锥
90°、
120°
XeF2 2 3 直线型180°
*n=6 正八
面体
90°、
180°
XeF4
XeOF4
4
5
2
1
正方形
四方锥形
90°
-----
例5:用价层电子对互斥理论推测下列分子的空间构型
①CS2② NCl3③SO42-
④NO3-⑤SO3⑥H3O+
五、等电子原理
1. 规律内容:具有相同和相同的分子或离子具有相同的结构特征,某些物理性质也相似。
如:CO与N2,SiCl4、SiO44-与SO42-
2. 等电子原理的应用
(1)判断一些简单分子或离子的立体构型;
(2)利用等电子体在性质上的相似性制造新材料;
如、、、是良好半导体材料。
(3)利用等电子原理针对某物质找电子体;
例5:1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。
O3能吸收有害紫外线,保护人类赖以生存的空间。
O3分子的结构如图,呈V型,键角116.5℃。
三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性
共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,
构成一个特殊的化学键——三个O原子均等地享有这4个电子。
请从下
列选项中选择合适的答案:中心原子与臭氧的中心氧原子的杂化轨道类
型相同的有:。
与O3分子构型最相似的是。
A.H2O B.CO2 C.SO2D.BF3 E. NO2-。