高二化学下学期高二化学第一章第一节氮族元素复习
- 格式:ppt
- 大小:496.00 KB
- 文档页数:10

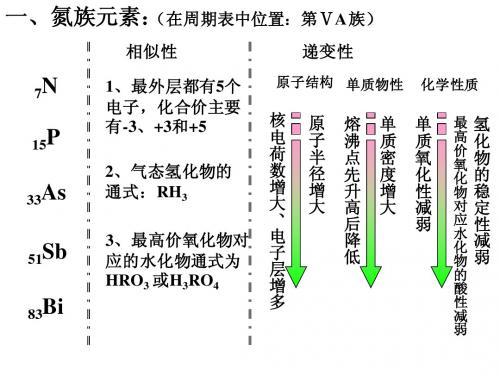
高二化学氮族元素单元复习人教版【同步教育信息】一. 本周教学内容:氮族元素单元复习二. 重点、难点1. 掌握氮族元素的原子结构特点及其在周期表的位置和性质的变化规律。
2. 掌握氨和铵盐的性质、用途及氨的实验室制法,学会检验铵离子。
3. 掌握硝酸的通性和特性,及氨氧化法制取的化学反应原理,并了解主要生产过程。
4. 了解氮气、磷的同素异形体白磷和红磷的性质和用途。
三.具体内容2. 知识网络:请你按下表要求填入你所知道的含有氮元素的物质的化学式:含氧酸 HNO 3、HNO 2、 碱 NH 3·H 2O 盐 NH 4NO 3络合物 OH NH Ag ])([23有机物C 6H 5—NO 232263)(NO H C CH - n ONO O H C ])([32276(1)氮气① 结构的稳定性 ② 氧化性——223H N +32NH2323N Mg MgN 点燃+③ 还原性——NO O N 222放电+④ 2N 的工业制法及氮的固定 (2)氮的氧化物 (3)磷及其化合物 ① 同素异形体 ② 磷的还原性③ 磷的氧化物——52O P ④ 磷酸及偏磷酸 ⑤ 磷酸盐的性质 (4)氨气及铵盐① 3NH 的结构及物理性质② 3NH 的化学性质——还原性,与水,与酸反应 ③ 3NH 的制法及用途 ④ 铵盐的四大特点: <1> 易溶于水,且吸热 <2> 与碱反应 <3> 受热易分解<4> 水解 ⑤ +4NH 的检验(5)硝酸及硝酸盐① 硝酸的强氧化性、不稳定性、有机反应 ② 工业制硝酸 ③ 硝酸盐的性质 ④ 王水【典型例题】[例1] 在一定条件下,某元素的氢化物X 可完全分解为两种单质:Y 和Z ,若已知:① 反应前的X 与反应后生成的Z 的物质的量之比3:2)(:)(=Z n X n② 单质Y 的分子为正四面体构型 请填写下列空白。
(1)单质Y 是 ,单质Z 是 (填写名称或分子式) (2)Y 分子共含 个共价键。
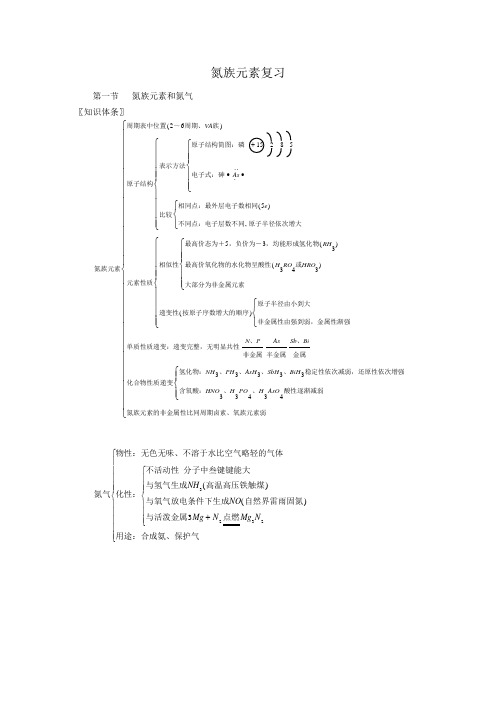
氮族元素复习第一节氮族元素和氮气〖知识体条〗氮族元素周期表中位置~周期、族原子结构表示方法原子结构简图:磷电子式:砷比较相同点:最外层电子数相同不同点:电子层数不同原子半径依次增大元素性质相似性最高价态为+,负价为-,均能形成氢化物最高价氧化物的水化物呈酸性或大部分为非金属元素递变性按原子序数增大的顺序原子半径由小到大非金属性由强到弱,金属性渐强单质性质递变:递变完整,无明显共性、非金属半金属、金属化合物性质递变氢化物:、、()...(),()()()2615285553334333VAAseRHH RO HRON P As Sb BiNH PH AsH+∙∙⎧⎨⎪⎪⎩⎪⎪⎧⎨⎩⎧⎨⎪⎪⎪⎪⎩⎪⎪⎪⎪⎧⎨⎪⎪⎩⎪⎪⎧⎨⎩⎧⎨⎪⎪⎪⎪⎩⎪⎪⎪⎪33333434、、稳定性依次减弱,还原性依次增强含氧酸:、、酸性逐渐减弱氮族元素的非金属性比同周期卤素、氧族元素弱SbH BiHHNO H PO H AsO⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪氮气物性:无色无味、不溶于水比空气略轻的气体化性:不活动性分子中叁键键能大与氢气生成高温高压铁触煤与氧气放电条件下生成自然界雷雨固氮与活泼金属点燃用途:合成氨、保护气NHNOMg N Mg N32323()()+⎧⎨⎪⎪⎪⎩⎪⎪⎪⎧⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪一氧化氮物性:无色有毒、不溶于水的气体化性除硝酸厂尾气不与碱作用生成盐,为不成盐氧化物制法实验室:和稀制只能用排水法收集工业上:和制氨催化氧化法222222222332NO O NO NO NO NaOH NaNO H O Cu HNO NO NH O NO +=++=+⎧⎨⎪⎪⎩⎪⎪⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪()()()()二氧化氮物性:红棕色有毒、有刺激性气味的气体化性与水:中要有就有氧化性:制法实验室:和浓制只能用向上排空气法收集工业上:制硝酸322222232242242233232NO H O HNO NO NO N O NO N O NO SO SO NO Cu HNO NO NH O NO O NO +=+⇔+→+⎧⎨⎪⎪⎩⎪⎪−→−−−→−−⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪()()()()[难点分析] 1. 氢化物氢几乎能与除稀有气体外的所有元素结合成二元化合物,这些二元化合物统称为氢化物。


第一章 氮族元素第一节 氮和磷教学目标1. 使学生了解氮族元素性质的相似性和递变规律。
2. 使学生掌握氮气的化学性质,充分认识结构和性质的关系。
3. 使学生了解磷的性质。
4. 培养学生运用元素周期律知识解决问题的能力。
教学重点5. 氮族元素性质的相似性和递变规律。
6. 氮气的化学性质。
教学难点氮的分子结构和化学性质的关系。
课时安排二课时教学方法1.通过元素周期律知识的复习,引导学生分析、讨论、总结氮族元素性质的相似性和递变规律。
2.通过分析氮气的分子结构,启发学生认识氮气的化学性质。
3.通过实验的研究,认识红磷和白磷的关系及性质差异。
教具准备充满NO 2试管、大烧杯、橡胶手套、石蕊试液、铁架台、长硬质玻璃管、酒精灯、红磷、白磷、火柴。
教学过程第一课时[引言]我们在高一学习了卤族、氧族、碳族三族主族元素,请同学们把这三族的元素符号填写在周期表相应的位置上。
[学生活动]填写周期表。
[过渡]位于第Ⅳ主族和第Ⅵ主族之间的第Ⅴ主族, 称之为氮族元素。
我们这节课就来学习氮族元素的性质。
[板书]第一章 氮族元素[师]从氮族元素在周期表中的位置来看,这一族元素有什么相同和不同之处?[生]最外层都应该有5个电子,不同之处是电子层数不同。
[师]结构决定性质,氮族元素原子结构的相似性决定了元素性质的相似性,但由这些元素形成的单质的性质却有很大的差异,尤其是氮和磷。
下面我们就来学习氮和磷的性质。
[板书]第一节 氮和磷[师]我们都知道,氮气占空气体积分数的78%,我们时时刻刻都在氮气的包围之中。
根据你的观察,并结合课本,总结出氮气有哪些物理性质。
ⅣA ⅤA ⅥA ⅦAC N O FSi P S Cl Ge As Se Br Sn Sb Te IPb Bi Po At[板书] 一、氮气1. 氮气的物理性质[生]无色,无味,难溶于水,比空气略轻,熔沸点低。
[师]在呼吸时,我们吸入人体内的空气中的氮气会全部呼出,氮气对维持人的生命活动似乎没有什么用处。

氮族元素【知识归纳】 一.氮族元素概况1.概况:N 2是一种无色无味的气体,密度比空气略小,不溶于水。
分子结构式为__ N ≡N ,该化学键很牢固,键能很大,难以破坏,所以通常情况下氮气性质__很稳定 。
2.化学性质:(1)工业合成氨的反应方程式:(2)高温或闪电时与O 2的反应的反应方程式:________________________ (3)点燃时与金属Mg(或Ca, Sr, Ba)的反应方程式:___________________以上反应均为__氮的固定,即将空气中_游离_态的氮气转化为化合态的氮。
三.氮的氧化物:N 2O 、(笑气 麻醉剂)NO 、N 2O 3、NO 2、N 2O 4、N 2O 5注意:N 2O 3是 HNO 2 酸酐;N 2O 5是 HNO 3 酸酐。
其它的氧化物都不是酸酐。
N 2 + 3H 22N H 3N 2+O 2 2NO高温或闪电3M g +N 2M g 3N 2点燃)3Cu(NO注意:2NO 2N2O4(通常情况下NO2气体不是纯净物)2.如何鉴别一瓶红棕色气体是二氧化氮或溴蒸气?(找出尽可能多的方法)①AgNO3 :加入少量硝酸银溶液振荡,若有浅黄色沉淀生成,是溴蒸气,若无浅黄色沉淀生成,是二氧化氮。
(二者的共同现象是红棕色消失)② H2O:加入少量的水后振荡,若红棕色消失,是二氧化氮,若红棕色不消失,是溴蒸气。
③CCl4:加入少量CCl4后振荡,若红棕色消失且CCl4由无色变为橙红色,是溴蒸气。
若红棕色不消失,是二氧化氮。
④降温:冷凝成红棕色液体的是溴蒸气,颜色变浅的是NO2。
不能用湿润的淀粉—KI试纸鉴别二者四.氨气1.概况:氨是一种无色,有刺激性气味的气体,易液化形成液氨,极易溶于水,2.性质:(1)氨水显弱碱性,在溶液中存在如下转化(方程式表示) NH3+H2O NH3·H2O NH4+ +OH—。
氨水密度小于水的密度,所以氨水的浓度越大,密度越小。