配位化学
- 格式:ppt
- 大小:3.51 MB
- 文档页数:161

无机化学中的配位化学无机化学是化学的一个分支,研究的是无机物质的性质、合成、结构和反应。
而无机化学中的配位化学则是其中一个重要的领域,研究的是配合物的性质和反应机理。
一、什么是配位化学?配位化学是指研究配合物的化学性质、结构和反应机理的一门学科。
配合物是由一个或多个叫配体的化学物质和一个中心离子或原子团通过配位键结合而成的。
二、配合物的基本结构在无机配位化学中,有一些基本的配合物结构,以下是其中几种常见的:1. 八面体型配合物八面体型配合物的一种常见形式是指一个中心金属离子被六个配体包围而成。
这种配合物包括了一些过渡金属物质,比如八面体的铁离子(Fe2+),铬离子(Cr3+)和钴离子(Co3+)等等。
2. 四面体型配合物四面体型配合物的中心离子被四个或更少的配体包围而成。
例如一个中心钴离子(Co2+)被四个氨分子包围而成的结构。
类似的四面体型配合物还包括了许多其他的过渡金属离子。
3. 矩形双桥型分子矩形双桥型分子是指由一个或多个金属中心和一个或多个桥联的配体组成的化合物。
这种化合物经常被用作催化剂。
4. 端基配位端基配位是指配体的一个原子与金属离子形成了一个配位键,而其它的配体分子则不与之配位。
这种结构的一个例子是钴离子与四个水分子和一个氯离子形成的结构。
以上这些结构只是无机配位化学中的几个例子,实际上在无机化学中还有许多其他的配合物结构。
了解这些结构的特点,可以帮助我们更好地了解配合物的性质和反应机理。
三、配位化学的应用无机配位化学有着广泛的应用,例如在工业、农业和医学等领域。
以下是其中的一些例子:1. 工业应用无机配位化学在工业生产中有着广泛的应用。
例如,许多催化剂都是配合物,它们被广泛地应用在成本高昂和复杂的化学反应中。
此外,许多电池和太阳能电池中也使用了配合物。
2. 农业应用农业领域中,配位化学也扮演着重要的角色。
例如,许多农药和肥料都是由稳定的配合物构成的。
3. 医学应用医学领域中,配位化学也有着广泛的应用。

化学配位配位化学化学配位,也被称为配位化学,是化学领域中的一个重要分支,涉及到配位化合物的合成、结构解析和反应机理等方面。
配位化学的发展对于理解和应用化学原理有着重要的意义。
本文将探讨化学配位的基本概念、配位化合物的结构和性质以及配位反应的机理等内容。
一、化学配位的基本概念在化学中,配位是指两个或多个化学物质通过共用一对或多对电子而结合在一起形成配位键的过程。
配位化学研究的主要对象是配位化合物,其中配位中心(通常是过渡金属离子)与一个或多个配体(通常是具有孤对电子的分子或离子)形成配位键。
这种配位键的形成使得配位化合物具有独特的结构和性质。
二、配位化合物的结构和性质配位化合物的结构与其性质密切相关。
在配位化合物中,配位中心与配体之间的配位键通常是通过配位基团上的孤对电子与配位中心的空轨道相互作用而形成的。
这种配位键的形成使得配位化合物呈现出各种不同的几何构型,如线性型、平面型、三角型、四角型等。
其中最常见的是八面体和四方形的结构。
配位化合物的性质主要由配位数、配位键的强度以及配体的性质等因素决定。
配位数指的是一个配位中心周围配体的数目。
根据配位中心的电子数和配体的空位数,可以分为单配位、双配位、多配位等不同类型。
配位键的强度取决于配位中心和配体之间的电荷转移情况,一般来说,配位键越强,配位化合物的稳定性越高。
此外,配体的性质也会对配位化合物的性质产生影响,常见的配体包括氨、水、羰基、氯离子等。
三、配位反应的机理配位反应是指在化学反应中,配位中心与配体之间的配位键发生断裂或形成的过程。
根据反应的特点,可以将配位反应分为配位置换反应、配位加成反应和配位消除反应等类型。
配位置换反应是最为常见的一类配位反应,指的是在配位化合物中,一个或多个配体被其他配体取代的过程。
这种反应通常涉及到金属离子与配位基团之间的键的断裂和形成。
配位置换反应的机理可以通过亲核取代机理、酸碱取代机理或配体内取代机理来解释。
配位加成反应是指在配位化合物中,通过配位中心与新的配体之间的配位键形成来实现新配位基团的引入。

配位化学的基本概念与配位化合物的性质配位化学是研究过渡金属离子或中心离子与周围配体(配位体)之间配位键形成、结构及性质的科学。
配位化合物是由一个或多个配体与一个中心离子配位形成的化合物,具有独特的结构和性质。
本文将介绍配位化学的基本概念以及配位化合物的性质。
一、配位化学的基本概念配位化学的基本概念主要围绕着配位键形成、配体和中心离子的性质以及配合物的结构与性质展开。
1. 配位键形成配位键是配体中的一对电子与中心金属离子之间的共用键。
配位键的形成需要配体提供一个或多个孤对电子与中心离子形成配位键。
配位键的形成对配位化合物的性质起着关键作用。
2. 配体的性质配体是指能够提供一个或多个电子对与中心离子形成配位键的分子或离子。
配体的性质主要影响配位键的强弱和配位化合物的稳定性。
常见的配体有氨、水、氯等。
3. 中心离子的性质中心离子是指配位化合物中与配体形成配位键的金属离子或金属原子。
中心离子的性质包括电荷数、价态和配位数等。
中心离子的性质决定了配位化合物的结构和性质。
4. 配位化合物的结构与性质配位化合物的结构与性质主要受到配体种类、中心离子性质以及配位数等因素的影响。
配位化合物可以形成各种不同的结构,如线性、方向、平面、四面体等。
这些结构决定了配位化合物的性质,如颜色、磁性、溶解性等。
二、配位化合物的性质配位化合物具有许多独特的性质,以下将介绍其中的几个重要性质。
1. 颜色许多配位化合物显示出明亮的颜色,如蓝色、红色、黄色等。
这是由于配位键形成后,中心金属离子的d轨道发生分裂,产生能量差,吸收特定波长的光而呈现有色。
2. 磁性配位化合物可以表现出不同的磁性,包括顺磁性和反磁性。
顺磁性是指配位化合物中所含的未成对电子会受到外磁场的吸引,而提高磁性。
反磁性则相反,未成对电子会被排斥。
3. 溶解性配位化合物的溶解性与配体和中心离子的性质密切相关。
一般来说,具有极性配体的配位化合物在极性溶剂中溶解度较高,而中心离子大多数情况下并不直接影响溶解性。

配位化学是一门研究物质之间相互作用的化学学科,它
研究的是物质之间的配位关系,以及配位反应的机理和动力学。
它是一门涉及到物质结构、性质和反应机理的综合性学科。
配位化学的研究对象是配位物质,它们是由配位中心和
配位基组成的。
配位中心是一种具有特定结构和性质的物质,它可以与其他物质发生配位反应,从而形成配位物质。
配位基是一种具有特定结构和性质的物质,它可以与配位中心发生配位反应,从而形成配位物质。
配位化学的研究主要集中在配位反应的机理和动力学方面。
它研究的是配位反应的反应机理,以及配位反应的反应速率、反应活性、反应热等。
它还研究配位反应的热力学和动力学,以及配位反应的稳定性和反应路径等。
配位化学的研究对于理解物质的结构和性质,以及物质
之间的相互作用具有重要意义。
它的研究结果可以为药物设计、材料科学、生物化学等领域提供重要的理论指导。
总之,配位化学是一门研究物质之间相互作用的化学学科,它研究的是物质之间的配位关系,以及配位反应的机理和动力学。
它的研究结果可以为药物设计、材料科学、生物化学等领域提供重要的理论指导。

化学反应的配位化学的计算配位化学是研究配合物形成、反应机理和性质的学科,主要涉及配合物的形成和配位键的形成与破裂等。
在化学反应中,配位化学的计算是非常重要的,可以用来预测反应的可能性、探索机理以及优化实验条件。
本文将介绍几种常见的配位化学计算方法。
一、配位化学的基础概念1. 配位化学基础知识配位化学是指中心金属离子通过配位键与一个或多个配体形成配合物的过程。
在配合物中,中心金属离子和配体之间通过配位键连接。
配位键形成与破裂过程中可以伴随电子转移,导致配合物的性质和结构发生变化。
2. 配位数与配位键数配位数指的是中心金属离子周围配体的个数。
而配位键数则是指配位键的数量。
通过计算配位键数,可以确定配位数,同时也可以判断配体与中心金属离子之间的键的类型(配位键、离子键等)。
二、计算配位化学的方法1. 密度泛函理论(DFT)密度泛函理论是研究材料和分子的基本性质的一种方法。
在配位化学中,可以使用DFT方法计算配体分子和金属离子之间的结合能、键长、结构和电荷分布等。
通过计算可以得出配体的相对稳定性以及得到反应的能垒等信息。
2. 分子力学方法分子力学方法是一种计算化学中常用的近似计算方法,适用于大分子的计算。
在配位化学中,可以使用分子力学方法计算配体和金属离子之间的键长、键能以及配位平面的稳定性等。
分子力学方法计算速度快,但对于反应动力学和电子结构等细节缺乏精确描述。
3. 自洽反应场(SCRF)模型自洽反应场模型考虑了溶剂效应对配位化学的影响。
在计算过程中,可以考虑一个或多个溶剂分子与配体和金属离子的相互作用。
通过自洽反应场模型可以预测在溶液中的反应情况,预测络合物的稳定性等。
三、配位化学计算在实际应用中的例子1. 配位键的强度与稳定性通过配位化学的计算方法,可以预测配位键的强度和稳定性。
例如,可以计算不同配体与相同金属离子结合时的配位键能,并比较它们之间的强度差异。
这些计算结果可以帮助选择更合适的配体,提高配合物的稳定性。

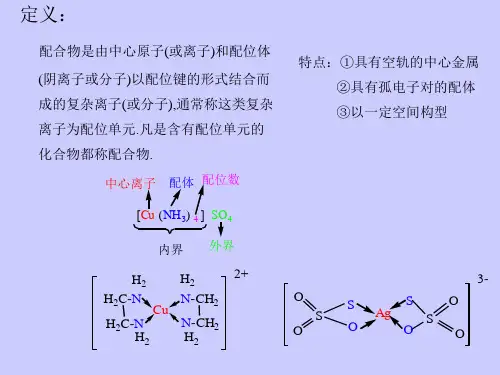
名词解释1,配位化合物:一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
2,价键轨道理论:1.两个原子的成单电子若自旋相反则可两两配对形成共价键2.共价键的形成是原子轨道的重叠,重叠程度越大,共价键越稳定3.共价键有方向性和饱和性3,晶体场理论要点:1、中心离子与配体之间看作纯粹的静电作用2、中心离子d轨道在配体(场)作用下,发生能级分裂。
3、d电子在分裂后的d轨道上重排,改变了d电子的能量。
4,分子轨道理论:分子轨道理论从分子整体出发,考虑电子在分子内部的运动状态,是一种化学键的量子理论.该理论的要点有:1.在分子中电子不是属于某个特定的原子,电子不在某个原子轨道中运动,而是在分子轨道中运动.分子中每个运动状态则用波函数表示,即分子轨道;2.分子轨道是由分子中原子的原子轨道线性组合而成,组成后形成的分子轨道数目与结合前的原子轨道数目相等(轨道杂化则是同一原子的不同原子轨道的重新组合,而且分子轨道是多中心的,原子轨道只有一个中心);3.原子轨道线性组合得到分子轨道.其中能量高于原来原子轨道者成为反键分子轨道,能量低于原来原子轨道者称为成键分子轨道;4.每个分子轨道都有对应的图像.5,晶体场稳定化能:若d轨道不是处在全满或全空时,d电子分裂轨道后的总能量低于分裂前轨道的总能量。
这个总能量的降低值,称为晶体场稳定化能。
此能量越大,配合物越稳定。
6,姜泰勒效应:电子在简并轨道中的不对称占据会导致分子的几何构型发生畸变,从而降低分子的对称性和轨道的简并度,使体系的能量进一步下降,这种效应称为姜-泰勒效应。
7,电子组态:电子组态指原子内电子壳层排布的标示。
又称电子构型或核外电子排布。
8,微观态:如果使用分子数分布并且区分具体的分子来描写的系统状态叫热力学系统的微观态。
9,单重态:根据泡里不相容原理,在同一轨道上的两个电子的自旋方向要彼此相反,即基态分子的电子是自旋成对的,净自旋为零,这种电子都配对的分子电子能态称为单重态(singlet state),具有抗磁性。




配位化学知识点总结一、配位化学的基本概念配位化学是研究金属离子(或原子)与配体之间形成的配位化合物的结构、性质和反应的化学分支。
首先,我们来了解一下什么是配体。
配体是能够提供孤对电子与中心金属离子(或原子)形成配位键的分子或离子。
常见的配体有水分子、氨分子、氯离子等。
而中心金属离子(或原子)则具有空的价电子轨道,可以接受配体提供的孤对电子。
配位键是一种特殊的共价键,由配体提供孤对电子进入中心金属离子(或原子)的空轨道而形成。
配位化合物则是由中心金属离子(或原子)与配体通过配位键结合形成的具有一定空间结构和化学性质的化合物。
二、配位化合物的组成配位化合物通常由内界和外界两部分组成。
内界是配位化合物的核心部分,由中心金属离子(或原子)与配体紧密结合而成。
例如,在Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺就是内界。
外界则是与内界通过离子键结合的其他离子。
在上述例子中,SO₄²⁻就是外界。
中心金属离子(或原子)的化合价与配体的化合价之和等于配位化合物的总化合价。
配位数指的是直接与中心金属离子(或原子)结合的配体的数目。
常见的配位数有 2、4、6 等。
三、配位化合物的结构配位化合物具有特定的空间结构。
常见的配位几何构型有直线型、平面三角形、四面体、八面体等。
例如,配位数为 2 时,通常形成直线型结构;配位数为 4 时,可能是平面正方形或四面体结构;配位数为 6 时,多为八面体结构。
这些结构的形成取决于中心金属离子(或原子)的电子构型和配体的大小、形状等因素。
四、配位化合物的命名配位化合物的命名有一套严格的规则。
先命名外界离子,然后是内界。
内界的命名顺序为:配体名称在前,中心金属离子(或原子)名称在后。
配体的命名顺序遵循先无机配体,后有机配体;先阴离子配体,后中性分子配体。
对于同类配体,按配体中原子个数由少到多的顺序命名。
如果配体中含有多种原子,先列出阴离子配体,再列出中性分子配体。
有机化学基础知识配位化学和配位反应有机化学基础知识: 配位化学和配位反应配位化学是有机化学中一个重要的分支,它研究的是配位化合物的形成、结构、性质及其反应。
配位化学广泛应用于无机领域,在有机化学中也发挥着重要作用。
本文将介绍有机化学基础知识中的配位化学和配位反应。
一、配位化学1. 配位键的形成配位化学研究的首要问题是如何形成金属与配体之间的配位键。
通常,金属原子通过空位和配体中的锯齿型电子云形成配位键。
配位键的形成可以通过配位键理论来解释,其中最常见的是单线性理论和自由电子对瓦伦希巴理论。
2. 配位数和配位几何一个金属离子可以与一个或多个配体形成配位键,其中与金属离子形成化学键的配体被称为配体场。
而金属离子与配体形成的化学键被称为配位键。
配位数指的是与金属离子形成配位键的配体数量,不同的金属离子具有不同的配位数。
配位几何是指配体在金属离子周围的三维排列方式,常见的配位几何有线性、平面四方形、正四面体和八面体等。
二、配位反应1. 配位镜像异构配位镜像异构是指当一个金属离子的配位体在一定方向上排列成对称镜像的两种形式时,这两种形式被称为配位镜像异构体。
配位镜像异构体之间可以通过外部环境的改变或者配体的交换来转化。
2. 配位取代反应配位取代反应是指当一个或多个配体被其他配体取代时发生的反应。
配位取代反应是有机化学中常见的反应类型之一,通过改变配体可以改变配位化合物的性质。
配位取代反应的速率往往受到配体的电子效应、空间位阻和化学平衡的影响。
不同的配体具有不同的取代反应活性,从而导致不同的反应速率和选择性。
3. 配位加成反应配位加成反应是指当一个或多个配体与金属离子形成新的配位键时发生的反应。
配位加成反应可以使得金属离子的配位数增加,从而改变化合物的结构和性质。
配位加成反应的选择性往往由配体的电子构型、酸碱性和空间位阻等因素决定。
不同的配体具有不同的加成反应活性,从而导致不同的反应速率和选择性。
总结:配位化学是有机化学中重要的一个分支,研究配位化合物的形成、结构和性质。
配位化学知识点总结配位化学是无机化学的一个重要分支,它研究的是金属离子或原子与配体之间通过配位键形成的配合物的结构、性质和反应。
以下是对配位化学知识点的总结。
一、配位化合物的定义与组成配位化合物,简称配合物,是由中心原子(或离子)和围绕它的配体通过配位键结合而成的化合物。
中心原子通常是金属离子或原子,具有空的价电子轨道,能够接受配体提供的电子对。
常见的中心原子有过渡金属离子,如铜离子(Cu²⁺)、铁离子(Fe³⁺)等。
配体是能够提供孤对电子的分子或离子。
配体可以分为单齿配体和多齿配体。
单齿配体只有一个配位原子,如氨(NH₃);多齿配体则有两个或两个以上的配位原子,如乙二胺(H₂NCH₂CH₂NH₂)。
在配合物中,中心原子和配体组成内界,内界通常用方括号括起来。
方括号外的离子则称为外界。
例如,Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺是内界,SO₄²⁻是外界。
二、配位键的形成配位键是一种特殊的共价键,是由配体提供孤对电子进入中心原子的空轨道形成的。
配位键的形成条件是中心原子有空轨道,配体有孤对电子。
例如,在 Cu(NH₃)₄²⁺中,氨分子中的氮原子有一对孤对电子,铜离子的价电子层有空轨道,氮原子的孤对电子进入铜离子的空轨道,形成配位键。
三、配合物的命名配合物的命名遵循一定的规则。
对于内界,先列出中心原子的名称,然后依次列出配体的名称。
配体的命名顺序是先阴离子,后中性分子;先简单配体,后复杂配体。
在配体名称之间用“·”隔开,配体的个数用一、二、三等数字表示。
如果有多种配体,用罗马数字表示其价态。
例如,Co(NH₃)₅ClCl₂命名为氯化一氯·五氨合钴(Ⅲ)。
四、配合物的空间结构配合物的空间结构取决于中心原子的杂化轨道类型和配体的空间排列。
常见的杂化轨道类型有 sp、sp²、sp³、dsp²、d²sp³等。
配位化学分类配位化学是无机化学的一个重要分支,研究的是金属离子或中心原子与周围配体之间的相互作用和配位化合物的性质。
根据配位物中配体的种类和数量,配位化学可以分为多种类型。
一、单一配体配位化合物单一配体配位化合物是指配位物中只含有一种配体的化合物。
根据配体的性质,可以将单一配体配位化合物分为阴离子配位化合物、中性配位化合物和阳离子配位化合物。
1. 阴离子配位化合物阴离子配位化合物是指配位物中的配体为阴离子的化合物。
常见的阴离子配体有氰离子(CN-)、氨基(NH2-)、氯离子(Cl-)等。
阴离子配体可以通过给予金属离子一个或多个电子对来形成配位键。
2. 中性配位化合物中性配位化合物是指配位物中的配体为中性分子的化合物。
常见的中性配体有水(H2O)、一氧化碳(CO)、氨(NH3)等。
中性配体可以通过与金属离子之间的协同作用来形成配位键。
3. 阳离子配位化合物阳离子配位化合物是指配位物中的金属离子为阳离子的化合物。
常见的阳离子配体有氯离子(Cl-)、溴离子(Br-)、碘离子(I-)等。
阳离子配体可以通过给予金属离子一个或多个电子对来形成配位键。
二、多配体配位化合物多配体配位化合物是指配位物中含有多种配体的化合物。
根据配体的数量和结构,多配体配位化合物可以进一步分为双核配位化合物、多核配位化合物和大环配位化合物。
1. 双核配位化合物双核配位化合物是指配位物中含有两个金属离子的化合物。
双核配位化合物可以通过两个金属离子之间的配位键连接起来,形成一个稳定的配位体系。
2. 多核配位化合物多核配位化合物是指配位物中含有多个金属离子的化合物。
多核配位化合物可以通过多个金属离子之间的配位键连接起来,形成一个复杂的配位体系。
3. 大环配位化合物大环配位化合物是指配位物中含有大环结构的化合物。
大环配位化合物可以通过大环结构中的配体与金属离子之间的配位键形成。
三、配位聚合物配位聚合物是指配位物中含有多个相同或不同金属离子的化合物。