基础化学——配合物
- 格式:ppt
- 大小:3.07 MB
- 文档页数:110



高中化学奥林匹克竞赛辅导配合物(配位化合物)化学基础一、配合物的基本概念1.配合物:由中心离子(或原子)和若干个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称作配位化合物,简称配合物,也叫络合物。
如[Co(NH3)6]3+、[Cr(CN)6]3-、Ni(CO)4都是配位单元,分别称作配阳离子、配阴离子、配分子。
判断物质是否是配合物的关键在于物质是否含有配位单元。
配合物和复盐的区别:前者一定含有配位键,后者没有配位键,如KCl·MgCl2·6H2O是复盐,不是配合物。
2.配合物的组成:(1)配合物的内界和外界:以[Cu(NH3)4]SO4为例,[Cu(NH3)4]2+为内界,SO42-为外界,内外界之间是完全电离的。
内界是配位单元,外界是简单离子。
又如K3[Cr(CN)6]之中,内界是[Cr(CN)6]3-,外界是K+。
配合物可以无外界,但不能没有内界,如Ni(CO)4。
(2)中心离子(原子)和配位体:a.中心离子(原子):又称配合物的形成体或中心体,多为过渡金属离子,如Fe3+、Fe2+、Co2+、Ni2+、Cu2+,也有电中性的原子为配合物的中心原子,如Ni(CO)4、Fe(CO)5中的Ni和Fe都是电中性的原子。
只要能提供接纳孤对电子的空轨道的离子或原子均可作配合物的中心体。
b.配位体:又称配体,是指含有孤对电子的阴离子或分子。
如NH3、Cl-、CN-等。
配位体中直接与中心原子配合的原子,叫做配位原子。
如[Cu(NH3)4]2+配阳离子中,NH3是配位体,其中N原于是配位原子。
配位原子经常是含有孤对电子的原子。
3.配位原子和配位数:配体中给出孤对电子与中心体直接形成配位键的原子,叫配位原子。
配位单元中,中心体周围与中心体直接形成配位键的配位原子的个数,叫配位数。
中心离子的配位数一般为2、4、6、8(配位数为8的较少见),如在[Pt(NH3)6]C14中,配位数为6,配位原子为NH3分子中的6个氮原子。

化学配合物化学配合物是由中心金属离子或原子与一定数目的配体通过化学键结合而形成的复合物。
这些配合物在化学和生物学领域都有广泛的应用。
本文将介绍几种常见的化学配合物及其应用。
一、铁氰化物铁氰化物是一种由铁离子和氰化物配体形成的配合物。
它具有良好的稳定性和溶解性,常用于金属离子的检测和分离。
铁氰化物还具有较强的氧化还原性,可以用于电化学和催化反应。
二、铂配合物铂配合物是一类具有铂离子和多种配体组成的复合物。
它们在医学和化学工业中有广泛的应用。
例如,顺铂是一种常用的抗肿瘤药物,可以通过与DNA结合而抑制细胞分裂。
其他铂配合物还可以用于催化反应和电化学领域。
三、铜配合物铜配合物是由铜离子和配体组成的化合物。
它们具有良好的催化性能和抗菌活性。
例如,铜配合物可以用于催化有机反应,如氧化反应和环化反应。
此外,铜配合物还可以作为抗菌剂用于农业和医学领域。
四、铁配合物铁配合物是由铁离子和配体组成的复合物。
它们在生物学和化学领域具有重要的应用。
例如,血红蛋白是一种含有铁离子的复合物,它在人体中负责携带氧气。
其他铁配合物还可以用于催化反应和电化学领域。
五、镍配合物镍配合物是由镍离子和配体组成的化合物。
它们在催化和电化学反应中具有重要的应用。
例如,镍配合物可以用于催化加氢反应和还原反应。
此外,镍配合物还可以用于制备材料和染料。
六、钴配合物钴配合物是由钴离子和配体组成的复合物。
它们在化学和医学领域有广泛的应用。
例如,钴配合物可以用于催化氧化反应和还原反应。
此外,钴配合物还可以作为抗菌剂用于医学和农业领域。
化学配合物在化学和生物学领域具有广泛的应用,可以用于催化反应、电化学反应、抗菌剂和药物等方面。
研究和应用化学配合物有助于我们深入了解化学反应机制,开发新的材料和药物,推动科学技术的发展。
希望本文能够为读者提供一些有关化学配合物的基础知识和应用领域的参考。

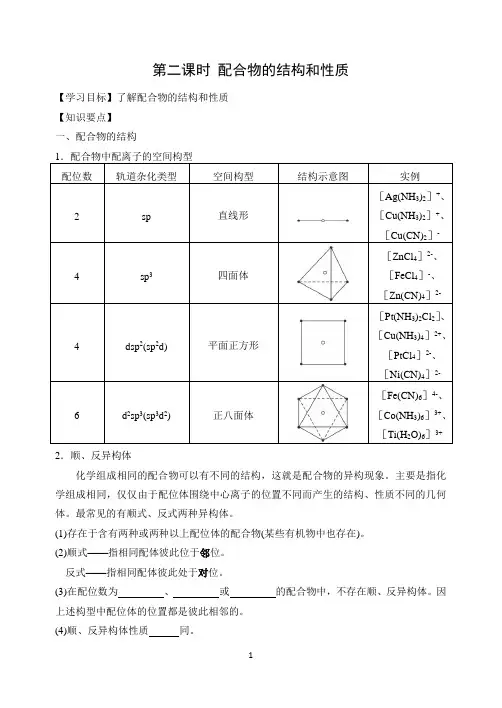
第二课时配合物的结构和性质【学习目标】了解配合物的结构和性质【知识要点】一、配合物的结构2.顺、反异构体化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配位体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位体的位置都是彼此相邻的。
(4)顺、反异构体性质同。
【基础训练】已知Pt(NH3)2Cl2有顺、反两种异构体A、B,A为棕黄色,有抗癌活性,在水中溶解度为0.2577g,B为淡黄色,无抗癌活性,在水中溶解度为0.0366g。
请指出______是顺式异构体,______是反式异构体,写出表示A、B的空间结构的结构式:A___________________________ B___________________________3.配合物的类型(了解)配合物的范围极广,主要可以分为以下几类:(1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。
这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。
(2)螯合物:具有环状结构的配合物叫螯合物。
二、配合物的性质:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________(2)配位体的碱性____________________________________________________三、配合物的应用1.银镜反应2.Fe3+的检验3.用于离子的检验用可分离CuSO4溶液和Fe2(SO4)3溶液。

《药用基础化学》配合物的生成和性质实验【实验目的】1.了解配合物的生成、组成及配离子的稳定性。
2.了解配位平衡与沉淀反应、氧化还原反应及溶液酸度的关系;3.了解螯合物的生成。
【实验原理】配合物是由中心原子与配体按一定的组成和空间构型通过配位键结合所形成的化合物。
配合物的组成一般可分为内界和外界两个部分,中心原子与配体组成配合物的内界,称为配离子,其余部分组成外界。
配合物在水中可解离出配离子,配离子可部分离解成中心离子和配位体。
如:K3[Fe(CN)6]3K+ + [Fe(CN)6]3-3-Fe3+ + 6CN-[Fe(CN)而形式上与配合物类似的复盐则完全离解为简单离子:NH4Fe(SO4)2NH4+ + Fe3+ + 2SO42-一定温度下,当溶液中配离子的生成和解离速率相等时,体系达到动态平衡,称为配位平衡。
配位平衡与其他化学平衡一样,受外界条件的影响。
当改变溶液的酸碱性或加入沉淀剂、氧化剂、还原剂时,中心原子或配体的浓度会发生变化,因而平衡将发生移动。
【仪器与试剂】仪器:试管,离心试管,试管夹,药匙,烧杯(50ml),石棉网,铁架台,酒精灯,离心机试剂: 6.0 mol/L NH3·H2O ,95%乙醇,0.1mol/LCuSO4,0.1mol/LBaCl2,0.1mol/L NaOH,0.1 mol/LFeCl3,0.1 mol/L K3[Fe(CN)6],0.1 mol/LKCNS,0.1 mol/L (NH4)2·Fe(SO4)2,0.1 mol/LAgNO3,0.1 mol/L NaCl,0.1mol/L KBr,0.1 mol/LNa2S2O3,0.1mol/L KI 0.1 mol/LFeCl3,0.1 mol/LNaF,3mol/L H2SO4 CCl4,广泛pH试纸【实验内容】(一)配合物的生成和组成1.配合物的生成:在烧杯中加入0.1mol/LCuSO45ml,再逐滴加入6.0 mol/L NH3·H2O,观察现象,继续滴加氨水至沉淀溶解而形成深蓝色溶液,然后加入5ml 95%乙醇,振荡试管,有何现象?静置2分钟,常压过滤,分出晶体,在滤纸上逐滴加6.0 mol/L 氨水溶液6ml使晶体溶解,在漏斗下端放一支试管承接此溶液,保留备用,观察溶液变化现象,写出相关离子方程式,并解释之。



第九讲配位化合物简介一、配合物简介1.配合物定义配合物是由具有接受孤对电子或多个不定域电子的空位原子或离子(中心体)与可以给出孤对电子或多个不定域电子的一定数目的离子或分子(配体)按一定的组成和空间构型所形成的物种称为配位个体,含有配位个体的化合物为配合物。
[FeF6]3-, Fe(NCS)3, [Fe(CN)6]3-, [Cu(NH3)4]2+, [AlF6]3-, [Ag(NH3)2]+等K3 [ Fe ( C N )6](中央体)中心离子配位原子2.配合物的组成从溶液中析出配合物时,配离子经常与带有相反电荷的其他离子结合成盐,这类盐称为配盐。
配盐的组成可以划分为内界和外界。
配离子属于内界,配离子以外的其他离子属于外界。
内、外界之间以离子键结合。
外界离子所带电荷总数等于配离子的电荷数。
如:K3 [Fe( C N )6] 外界:K+; 内界:[ Fe( CN )6]3—。
中央体(形成体)通常是金属离子和原子,少数是非金属元素,例如:Cu2+,Ag+,Fe3+,Fe,Ni,B(Ⅲ),PⅤ……配位体含孤电子对或离域电子的分子和离子。
如:F-,Cl-,Br-,I-,OH-,H2O,NH3,CO,CN -……配位原子具有孤电子对的原子。
如:C、N、O、F、Cl、S等。
3、配体的分类按配体所含配位原子的数目分:单齿配体:只含一个配位原子的配体(NH、Cl-、H2O、F-, NH3, H2O等)。
3多齿配体:含有两个或两个以上的配位原子的配体。
160161en 、EDTA 、OX 、bipy 等4-4. 配合物的分类:按中央体的个数分:单核: [Co(NH 3)6]Cl 3 、 Na[AlF 6]. etc 多核: K 2[Re 2Cl 8]、 [ Cr 2O(NH 3)10 ] Cl 4. etc按配体与中央体之间成环情况分:简单[Co(NH 3)5H 2O]Cl 3 、 Pt (NH 3)2 Cl 2, etc螯合物[Cr(en)3]Cl 3, etc按配位个体是否带电荷分:离子 [Cu(NH 3)4]2+ [Ag(CN)2]- . etc分子 Fe(CO)5、[Co(NH 3)3Cl 3]. etc二、配合物的价键理论1.理论要点:(1). 中央体(中心离子或原子)(M):有空轨道 配位体(L):有孤对电子OCOCHC H OC O NCH CH N O COCH C HOC O 222222162二者形成配位键M L(2). 中央体(中心离子或原子)采用杂化轨道成键. (3). 杂化方式与空间构型有关[Fe(H 2O)6]2+sp 3d 2杂化, 八面体构型,外轨型配合物[Fe(CN)6]4-d 2sp 3杂化, 八面体构型,内轨型配合物2. 内、外轨型配合物:(1) 中心原子d1 ~ d3型, 有空(n-1)d轨道,d2s p3杂化形成内轨型(2) 中心原子d4 ~ d7型,视配体的强弱:强场配体,如CN – , CO, NO2–等,易形成内轨型;弱场配体,如X –、H2O易形成外轨型中心原子d8~ d10型, 无空(n-1)d轨道,sp3 d2杂化形成外轨型外轨型配合物:sp3d2杂化,轨道能量高,配合物较不稳定,中心原子的电子结构不发生改变,未成对电子数多,µ较大,一般为高自旋。

配位化学基础一、基础知识:①定义:配合物是由能够给出孤对电子或多个不定域电子的必定数量的离子或分子(称为配体)和拥有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按必定的构成和空间构型所形成的化合物。
如[Cu(NH3)4]2+、[Ag(CN)2]—离子等均为配离子。
配离子与带有异电荷的离子构成的中性化合物,如配盐[Cu(NH3)4]SO4、[Cu(H2O)4]SO4·H2O,配酸H2PtCl6],配碱[Cu(NH3)4](OH)2等都称为配合物。
不带电荷的中性分子如Ni(CO)4,[Co(NH3)3C13],就是中性配合物,或称配位分子。
②构成:中心离子(原子)、配体、配位原子,内界、外界,配位数。
③命名:(配体数)配体名称+合+中心原子名称(氧化数)配体多种时,一般先简单后复杂,先离子后分子,先无机后有机。
同类配体按配位原子元素符号的英文字母次序。
一些常有的配合物,也可用简称或俗名。
④配合物的立体化学:a.中心离子的配位数:b.中心离子的杂化及空间立体构型c.配合物的异构现象:因空间摆列方式不一样所惹起的异构的现象——立体异构现象(几何异构及旋光异构等)。
因原子间连结方式不一样所惹起的异构现象——化学构造异构现象(键合异构、电离异构、配位异构、水合异构、配体异构及聚合异构等)。
⑤种类:※从中心离子分:单核、双核、多核※从配体中的配位原子数量分:一般(简单)配合物:中心原子一个,配体为单基(单齿);螯合物:多基(多齿)配体形成的环状配合物。
成环对配合物稳固性起加强作应(螯和合效应,S<0。
理想的螯合剂要求配位原子多(环多稳固性好);配位原子间要有二至三个原子间隔(形成五、六元环稳固)。
※从配体种类分:一般配合物、N2分子配合物、羰基配合物、大环配合物等※⑥磁性:忽视轨道对磁矩的贡献时:μ=n(n+2)⑦化学键理论价键理论(VBT):配位键的实质杂化与配离子的空间构型:配位数23456杂化方式sp sp2sp3dsp2dsp3sp3dd2sp2d2sp3sp3d2空间构型实例内轨型外轨型高自旋低自旋配体电子进入中心离子的外层空轨道nsnpnd时,中心离子的电子不发生重排,电子按自旋最大的状态排布,称为外轨型或高自旋。