高三化学 化学反应速率
- 格式:ppt
- 大小:550.00 KB
- 文档页数:5

化学反应速率和化学平衡【考试大纲要求】1.了解化学反应的可逆性.理解化学平衡的涵义。
掌握化学平衡与反应速率之间的内在联系.2.理解勒沙特列原理的涵义.掌握浓度、温度、压强等条件对化学平衡移动的影响。
3.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆。
【知识规律总结】化学反应速率概念:用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
1.表示方法:v=△c/△t2.单位:mol/(L·s);mol/(L·min);mol/L·H。
3.相互关系:4NH3+5O24NO+6H2O(g)v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6影响化学反应速率的因素1.内因:反应物本身的性质(如:硫在空气中和在氧气中燃烧的速率明显不同).2.外内:(1)浓度:浓度越大,分子之间距离越短,分子之间碰撞机会增大,发生化学反应的几率加大,化学反应速率就快;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。
增大反应物的浓度,正反应速率加快。
(2)温度:温度越高,反应速率越快(正逆反应速率都加快)。
(3)压强:对于有气体参与的化学反应,通过改变容器体积而使压强变化的情况:PV=nRT, P=CRT.压强增大,浓度增大(反应物和生成物的浓度都增大,正逆反应速率都增大,相反,亦然).(4)催化剂:改变化学反应速率(对于可逆的反应使用催化剂可以同等程度地改变正逆反应速率)。
化学平衡的概念:在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组在成分的含量保持不变的状态叫做化学平衡.1.“等”—-处于密闭体系的可逆反应,化学平衡状态建立的条件是正反应速率和逆反应速率相等.即v(正)=v(逆)≠0。
这是可逆反应达到平衡状态的重要标志。
2.“定”——当一定条件下可逆反应一旦达平衡(可逆反应进行到最大的程度)状态时,在平衡体系的混合物中,各组成成分的含量(即反应物与生成物的物质的量,物质的量浓度,质量分数,体积分数等)保持一定而不变(即不随时间的改变而改变).这是判断体系是否处于化学平衡状态的重要依据。

高三化学化学反应速率试题答案及解析1.(14分)短周期主族元素A、B、C、D、E原子序数依次增大, A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为。
⑵已知:① E-E→2E H=+a kJ/mol;② 2A→A-A H=-b kJ/mol;③ E+A→A-E H=-c kJ/mol;写出298K时,A2与E2反应的热化学方程式。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g)H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。
初始投料与各容器达到平衡时的有关数据如下:实验甲乙丙初始投料 2 mol A2、1 mol BC 1 mol X 4 mol A2、2 mol BC平衡时n(X)0.5 mol n2n3反应的能量变化放出Q1kJ吸收Q2kJ放出Q3kJ体系的压强P1P2P3反应物的转化率1232v (A2)= 。
②计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1D.P3<2P1=2P2E.n2<n3<1.0 mol F.Q3=2Q1④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。
现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。

第23讲 化学反应速率【课前预习区】预习目标: 1、能正确应用表示化学反应速率的表达式2、能正确运用影响化学反应速率的因素一、化学反应速率的计算及注意事项1、化学反应速率的表示方法:用单位时间内反应物 或者生成物 来表示,表达式: ,单位是 。
2、反应的速率用不同物质的浓度变化表示时,数值 ,意义 , 它们的比值与方程式中各物质计量系数的关系是注意:同一反应在不同条件下进行,比较反应速率时应转化为用同一物质浓度的变化来表示。
浓度的变化来表示。
3、使用范围:适用于有 和 参加的反应,对于 一般不表示化学反应速率。
二、影响反应速率的因素内因是 ,外因主要有___ ______________________________,其中 能影响任何反应的速率。
对于固体, 也影响反应速率,如合成硫酸工业中硫铁矿石的煅烧等①浓度对反应速率的影响其他条件不变,增大反应物浓度,②压强对反应速率的影响对于气体反应,在其它条件不变时,增大压强,气体体积 ,气体浓度 ,化学反应速率③温度对反应速率的影响在其它条件不变的情况下,升高温度,化学反应速率 ,一般地,温度每升高10℃ 反应速率通常增大到原来的 倍。
④催化剂【练习1】反应4NH 3(g)+5O 2(g) 4NO(g)+6H 2O(g)在10L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol ,则此反应的平均速率)(X v (反应物的消耗速率或产物的生成速率)可表示为 ( )A .)mol/(L 0.010)(NH 3s v ⋅=B .)mol/(L 0.001)(O 2s v ⋅=C .)mol/(L 0.001(NO)s v ⋅=D .)mol/(L 0.045O)(H 2s v ⋅=【练习2】将一定浓度的盐酸倒入碳酸钙中,下列改变能使最初的化学反应速率增大的是( )A 、盐酸的浓度不变,而使盐酸的用量一倍。
B 、提高反应体系的温度。
C 、盐酸的浓度和用量都不变,增加碳酸钙的量。

高三化学反应速率总结总结引言化学反应速率是描述化学反应中物质转化的速度的重要指标之一。
在高三化学学习中,反应速率的概念及其影响因素是非常重要的内容。
本文将对高三化学中的反应速率进行总结,包括反应速率的定义、计算方法和影响因素等内容。
反应速率的定义反应速率是指单位时间内反应物消失或生成物产生的物质变化量。
一般而言,反应速率可用下式表示:v = ΔC / Δt其中,v表示反应速率,ΔC表示物质浓度的变化量,Δt表示时间的变化量。
反应速率的单位一般为摩尔/升·秒或克/升·秒。
反应速率的计算方法在实际的化学实验中,我们可以通过实验数据计算得到反应速率。
常用的方法有初始速率法、平均速率法和瞬时速率法。
•初始速率法:通过在反应初期测定反应物浓度变化的方法,确定反应速率。
初始速率法常用于反应物浓度变化较大的反应。
•平均速率法:通过在一段时间内测定反应物浓度变化的方法,计算得到平均反应速率。
•瞬时速率法:通过在某一瞬间测定反应物浓度变化的方法,得到该瞬间的反应速率。
具体的计算方法要根据实际的实验情况来确定,其中涉及到测定反应物浓度的方法、时间间隔的选择等。
影响反应速率的因素化学反应速率受到多个因素的影响,包括温度、浓度、催化剂和表面积等。
•温度:温度升高会使分子热运动加剧,反应物分子的碰撞频率增加,从而增大了反应速率。
•浓度:反应物浓度的增加会增加反应物分子的碰撞几率,从而增加反应速率。
•催化剂:催化剂可以降低反应的活化能,提供新的反应路径,促进反应的进行,从而加快反应速率。
•表面积:反应物的表面积增大,会使反应物分子更容易相互碰撞,从而增大反应速率。
这些因素的综合作用会决定反应速率的大小和变化趋势。
速率定律方程实验发现,当反应具有一定的机理时,反应物浓度的变化与反应速率之间存在一定的关系,可以用速率定律方程进行描述。
一般而言,速率定律方程的形式可以表示为:v = k[A]^m[B]^n其中,v表示反应速率,k为速率常数,[A]和[B]分别表示反应物A和B的浓度,m和n表示反应物A和B的反应级数。


高三化学教案化学反应速率(精选3篇)教案一:化学反应速率的概念和影响因素教学目标:1. 了解化学反应速率的概念和计算方法;2. 掌握影响化学反应速率的因素;3. 能够分析和解释实验观察结果。
教学内容:1. 化学反应速率的定义和计算方法;2. 影响化学反应速率的因素:浓度、温度、催化剂、表面积等;3. 实验探究:观察不同因素对反应速率的影响。
教学步骤:Step 1:导入通过举例(如铁钉腐蚀、果蔬变质等),激发学生对化学反应速率的兴趣,引入化学反应速率的概念。
Step 2:概念解释讲解化学反应速率的定义和计算方法,引导学生理解速率的意义。
Step 3:影响因素讲解简要介绍影响化学反应速率的因素,并阐述其原理和影响机制。
Step 4:实验探究选择适当的实验,让学生通过观察实验现象来分析不同因素对反应速率的影响。
可以选择酸与金属反应、化学燃烧等实验。
Step 5:实验结果分析和讨论根据实验结果,让学生总结不同因素对反应速率的影响,并解释其原因。
Step 6:巩固与拓展设计一些思考题,让学生进一步思考和应用所学知识。
如,催化剂的作用机制是什么?为什么反应温度升高会加快反应速率?等等。
教学辅助工具:实验草图、实验器材、化学试剂、实验报告。
教学评估:通过学生对实验的观察和分析,以及对概念理解的回答,评估学生对化学反应速率的掌握程度。
教案二:反应速率测定实验教学目标:1. 了解化学反应速率的实验测定方法;2. 能够设计并完成测定反应速率的实验;3. 掌握数据处理和结果分析的方法。
教学内容:1. 化学反应速率的实验测定方法;2. 实验设计:选择适当的反应体系和测定方法;3. 数据处理和结果分析。
教学步骤:Step 1:导入复习化学反应速率的概念和计算方法,为实验的设计和思考提供基础。
Step 2:实验设计介绍反应速率的测定方法,引导学生根据不同反应体系的特点和要求,选择合适的实验方法。
可以选择酸碱中和、金属与酸反应等实验。

高三化学反应速率知识点理解与强化化学反应速率是化学动力学中的一个重要概念,它描述了化学反应进行的快慢程度。
对于高三学生来说,理解和掌握化学反应速率的相关知识是学习化学的重要内容。
1. 化学反应速率的定义化学反应速率是指在单位时间内反应物浓度的减少或生成物浓度的增加。
通常用反应物浓度的变化量除以时间的变化量来表示。
2. 化学反应速率的影响因素2.1 反应物本身的性质反应物的本身的性质是决定化学反应速率的基础。
不同的反应物具有不同的反应活性,即它们与其他物质发生反应的能力。
一般来说,反应物的活性越强,反应速率越快。
2.2 温度温度对化学反应速率有显著的影响。
随着温度的升高,反应物的分子运动速度增加,碰撞的频率和能量也增加,从而增加了反应的有效碰撞次数,使得反应速率增加。
2.3 浓度反应物浓度对化学反应速率也有重要影响。
在一定范围内,反应物浓度越大,反应速率越快。
因为增加浓度可以增加反应物的有效碰撞次数,从而增加反应速率。
2.4 压强对于有气体参与的化学反应,压强也会影响反应速率。
增加压强可以增加气体的浓度,从而增加反应速率。
2.5 催化剂催化剂可以改变化学反应速率,其作用机理是降低反应的活化能,从而加快反应速率。
催化剂本身在反应过程中不被消耗,因此可以多次使用。
3. 化学反应速率的计算化学反应速率的计算通常基于实验数据进行。
通过测量反应物浓度随时间的变化,可以得到反应速率与时间的关系。
常见的计算方法有瞬时速率法和平均速率法。
3.1 瞬时速率法瞬时速率法是指在很短的时间间隔内测量反应物浓度的变化,从而得到瞬时速率。
瞬时速率可以用来研究反应物的浓度与反应速率之间的关系。
3.2 平均速率法平均速率法是指在一段时间内测量反应物浓度的变化,从而得到平均速率。
平均速率可以用来计算反应物的消耗量或生成物的产生量。
4. 化学反应速率的实验测定化学反应速率的实验测定是化学实验中的重要内容。
常用的实验方法包括颜色变化法、沉淀生成法、气体的收集法等。

化学中的化学反应速率(化学知识点)化学反应速率是指单位时间内反应物消失或产物生成的速率。
反应速率的快慢对于化学反应的研究和应用具有重要的意义。
本文将介绍化学反应速率的定义、影响因素以及如何测定反应速率。
一、化学反应速率的定义化学反应速率是指在一定条件下,反应物消失或产物生成的速率。
一般情况下,反应速率可以通过反应物消失的速率来描述,以此来衡量反应进行的快慢。
化学反应速率可以用如下公式来表示:速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间的变化量。
速率的单位可以是摩尔/升·秒(mol/L·s)、分子/升·秒(molecules/L·s)等。
二、影响化学反应速率的因素化学反应速率受到多种因素的影响,主要包括以下几个方面。
1.反应物浓度:当反应物浓度增加时,反应物之间的碰撞频率增加,从而增加了反应的可能性,使得反应速率加快。
2.温度:提高温度会增加反应物的动能,使反应物之间的碰撞更加频繁且具有更高的能量。
因此,温度升高会加快反应速率。
3.催化剂:催化剂可以降低反应的活化能,使反应物更容易发生反应。
催化剂的存在可以提高反应速率,而不参与反应本身。
4.表面积:反应物的表面积越大,反应物颗粒之间的碰撞频率就越高,反应速率也会增加。
5.反应物的物理状态:气相反应相较于固相反应和液相反应具有更高的反应速率,因为气态分子之间的自由运动能带来更频繁的碰撞。
三、测定反应速率的方法测定反应速率是研究反应动力学的重要手段,常用的方法有以下几种。
1.逐点法:在反应过程中,定时取样,通过测定不同时间点上反应物消失或产物生成的量来计算反应速率。
2.连续监测法:利用分光光度计、电导计等仪器对反应过程进行实时监测,获得反应物浓度的变化曲线,从而计算反应速率。
3.消失溶液平行测定法:将相同溶液分装到多个容器中,分别对不同容器中的反应液进行逐点法测定并计算平均速率,以提高测定结果的准确性。

高三化学一轮复习化学反应速率及其影响因素真正的失败不是你没做成事,而是你甘心于失败。
——斯坦福大学校训【考纲要求】(1)了解化学反应速率的概念、反应速率的定量表示方法。
(2)了解催化剂在生产、生活和科学研究领域中的重大作用。
(3) 理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
(4)了解化学反应速率在调控在生活、生产和科学研究领域中的重要作用。
考点一 化学反应速率基本概念1.概念:化学反应速率用 来表示。
2、表示方法:通常用 内反应物 或生成物 来表示。
3.表达式:v= 单位: 4.注意:(1)一般来说,化学反应速率是指某段时间内的 速率而不是 速率。
且无论用反应物还是用生成物表示均取正值(2)同条件下,同一反应中用不同物质表示反应速率时,数值可能 ,但意义 。
即:均表示同一反应的快慢。
反应速率的数值之比等于化学方程式中各物质的___ __之比。
例如,对于反应m A(g)+n B(g)=p C(g)+q D(g),v(A)∶v(B)∶v(C)∶v(D)=__________ (3)对比同一反应在不同条件下的反应速率要 [知识运用]① 已知4NH 3+5O 2=4NO+6H 2O ,若反应速率分别为v (NH 3)、v (O 2)、v (NO)、v (H 2O)表示,则: (1)v (O 2)== ____ V(NH 3) (2)v (H 2O)== _______V(O 2)(3)v (NO)== ____ V(O 2) (4) v (NH 3)== ___ V(NO)== ___V(H 2O)② 已知aA(g)+bB(g)==cC(g)+dD(g)。
取amolA 和bmolB 置于VL 容器中,一分钟后,测得 容器内A 的浓度为Xmol/L 。
这时B 的浓度为 ,C 的浓度为 , 这段时间内以物质A 的浓度变化来表示的反应速率为 。
③ 反应A+3B==2C+2D 在四种情况的反应速率分别如下,该反应进行的快慢顺序为 (1)v (A)==0.15mol/(L •S ) (2) v (B)==0.6 mol/(L •S ) (3) v (C)==0.4 mol/(L •S ) (4)v (D)==0.45 mol/(L •S ) 考点二 影响反应速率的因素1、内因:参加反应的物质的性质。
化学反应速率与化学平衡微专题201920182017考情透析ⅠⅡⅢⅠⅡⅢⅠⅡⅢ化学反应速率化学平衡T28T27T28T28T27T28T28T27T27考向:结合图像考查化学平衡移动的原理、化学反应速率和化学平衡常数的计算是高考的重点,另外在高考中常以信息题的形式考查K sp、反应速率常数等知识化学平衡图像分析及相关计算T28T27T28T27T28T28T27T27题型:化学反应原理综合题、选择题、工艺流程题、实验题 分值:10+412化学反应速率 化学平衡一、化学反应速率1.对化学反应速率计算公式的剖析(1)公式:v (B)=Δc(B)Δt =Δn(B)VΔt。
①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
②化学反应速率是某段时间内的平均反应速率,而不是瞬时速率,且计算时取正值。
③同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。
④对于可逆反应,反应进行的净速率是正、逆反应速率之差,当达到平衡时,净速率为零(注:总反应速率也可理解为净速率)。
(2)比值法:同一化学反应,各物质的反应速率之比等于化学方程式中的化学计量数之比。
对于反应m A(g)+n B(g)p C(g)+q D(g),有v(A)m =v(B)n =v(C)p =v(D)q。
2.气体反应体系中充入惰性气体(或无关气体)时,对反应速率的影响 (1)恒容:充入惰性气体总压增大 物质浓度不变(活化分子浓度不变)反应速率不变。
(2)恒压:充入惰性气体体积增大物质浓度减小(活化分子浓度减小)反应速率减慢。
3.外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同(1)当增大反应物浓度时,v 正瞬间增大,随后逐渐减小,v 逆瞬间不变,随后逐渐增大,直至v 正和v 逆相等时达到新平衡。
(2)增大压强,向气体分子数减少的方向的反应速率变化程度更大。
(3)对于反应前后气体分子数不变的反应,改变压强可以同等程度地改变正、逆反应速率。
化学反应速率影响因素一、内部因素(主要因素):参加反应物质的性质(化学反应的本质:反应物分子中的化学键断裂、生成物分子中的化学键形成过程(旧键断裂,新键生成)二、外部因素:1、浓度:在其他条件不变时,增大反应物浓度,可以增大反应速率.规律:其他条件不变时,增大反应物的浓度,可以增大反应速率;反之,可以减小化学反应速率。
注意:a、此规律只适用于气体或溶液的反应,对于纯固体或液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率;b、一般来说,固体反应物表面积越大,反应速率越大,反之,反应速率越小; c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
2、压强:对气体来说,若其他条件不变,增大压强,就是增加单位体积的反应物的物质的量,即增加反应物的浓度,因而可以增大化学反应的速率。
规律:对于有气体参加的反应,若其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,反应速率减慢。
对于气体有下列几种情况:(1)、恒温时:p增大→体积减少→c增大→反应速率增大(2)、恒容时: A、充入气体反应物→c增大→总压增大→反应速率增大; B、通入“无关气体”(如He、N2等)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变;(3)、恒压时:冲入“无关气体”(如He等)→引起体积增大,→各反应物浓度减少→反应速率减慢。
3、温度:反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
4、催化剂:使用催化剂,能够降低反应所需的能量,这样会使更多的反应物的分子成为活化分子,大大增加单位体积内反应物分子中活化分子所占的百分数。
因而使反应速率加快。
注意:(1)、使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间;(2)、没特别指明一般指正催化剂;(3)、催化剂一定的具有选择性;(4)、催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
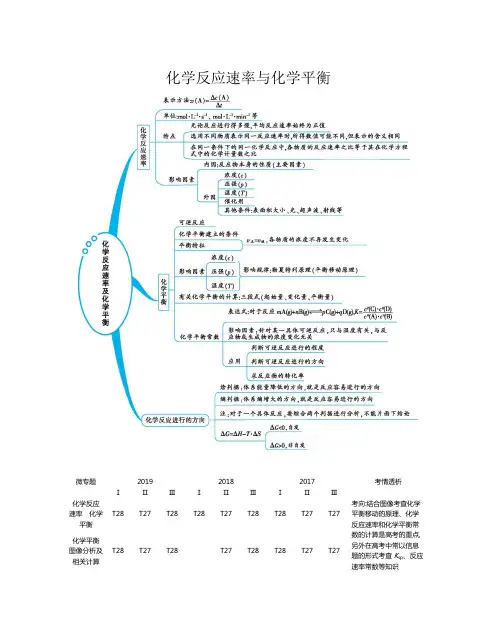
15 化学反应速率和限度知识清单【知识网络】【知识归纳】一、化学反应速率1.概念:用来衡量化学反应进行快慢的物理量 2.表示:单位时间内某种量的变化量 3.化学反应速率的计算(1)常规公式:v =t c △△=tV n△△①常用单位:mol ·L -1·s -1或mol ·L -1·min -1或mol ·L -1·h -1②适用范围:表示气体物质或溶液中可溶性物质的速率,不表示固体或纯液体物质的速率(2)非常规公式:v =t△△X(X 代表n 、P 、m 、V 等量)①常用单位:mol ·min -1、Pa ·min -1、g ·min -1、L ·min -1 ②适用范围:任何物质的反应速率 (3)利用关系式计算①应用前提:同一化学反应②常用关系:速率比=化学计量数比=物质的量浓度变化比=物质的量变化比4.大小比较(1)比较前提:同一反应,同一物质,同一单位(2)换算方法:各物质的速率除以相应的化学计量数,数大的速率快 5.说明(1)化学反应速率表示某段时间内的平均反应速率,不表示即时速率 (2)化学反应速率只有正值,没有负值(3)随着反应的进行,反应物的浓度等量逐渐减小,反应速率越来越慢 二、影响化学反应速率的因素 1.主要原因:反应物本身的性质2.基本规律:外界条件越高,速率越快(1)温度:温度越高,化学反应速率越快(2)压强:气体反应的压强越大,化学反应速率越快(3)浓度:浓度越大,化学反应速率越快(4)催化剂:显著的改变(加快或减慢)正逆反应速率,一般有催化剂,化学反应速率越快(5)接触面积:反应物的颗粒越小,接触面积越大,化学反应速率越快(6)原电池:形成原电池,可以加快氧化还原反应的速率3.特殊情况(1)温度①催化反应,升高温度,催化剂可能失活,反应速率减慢②有机反应,升高温度,有可能发生副反应,主反应速率减慢(2)压强①改变非气体反应的压强,反应速率不变②改变等体反应的压强,v正和v逆变化幅度相同(3)浓度①固体和纯液体的浓度为定值,改变固体或纯液体的用量,反应速率不变②加入固体物质,有可能改变接触面积,反应速率可能加快(4)无关气体①恒容容器通无关气体,压强增大,浓度不变,速率不变②恒压容器通无关气体,体积变大,浓度减小,速率减慢4.活化分子、有效碰撞与反应速率的关系实质5.速率-时间图像(1)温度:升高温度,瞬间v正和v逆均增大或(2)压强:增大压强,气体物质的浓度均增大,瞬间v正和v逆均增大或(3)浓度①增大反应物浓度,瞬间v正增大,v逆不变②增大生成物浓度,瞬间v正不变,v逆增大或③恒压:增大反应物浓度,瞬间v正增大,v逆减慢④恒压:增大生成物浓度,瞬间v正减慢,v逆增大(4)催化剂:能够同等程度改变正逆反应速率6.全程速率-时间图像(1)OB段反应速率变化的可能原因为:①反应放热,使温度升高,反应速率加快②反应生成催化剂,反应速率加快(2)BC段反应速率变化的可能原因为:反应物浓度降低,反应速率减慢7.探究外界条件对化学反应速率的影响(1)方法:控制变量法(2)溶液反应:加水调节溶液的总体积不变,以保证某种成分的浓度不变(3)实例:探究Y溶液浓度对反应速率的影响实验(混合溶液) 1 2 3 4 5 64mol/LX溶液/mL 60 60 60 60 60 60饱和Y溶液/mL 0 1.0 5.0 10 2040H2O/mL 4039353020 0 8.速率方程(1)意义:表示反应物浓度与反应速率的定量关系(2)举例:A2(g)+B2(g)2AB(g),v=kcα(A2)·cβ(B2)(3)测定方法:α、β必须通过实验测定,无法直接写出。
高三化学第一轮复习:化学反应速率和化学平衡(一)全国通用【本讲主要内容】化学反应速率和化学平衡(一)化学反应速率【知识掌握】【知识点精析】一. 化学反应速率1. 概念:用单位时间内反应物浓度的减少或生成物浓度的增大来表示化学反应的快慢。
公式:v=∆c / t单位:mol/(L·S)或mol/(L·min)2. 注意事项(1)化学反应速率与两个因素有关:一个是时间,另一个是反应物或生成物的浓度变化。
反应物的浓度随反应的进行而减少,生成物的浓度则不断增加。
(2)化学反应速率是某段时间内的平均速率,而不是即时速率,不可为负值。
(3)固体、液体在反应中可视为浓度不变,故一般不用固体或液体来表示反应速率。
(4)在同一反应中用不同物质来表示反应速率时,其数值可能是不同的,但意义相同。
因此,表示反应速率时要注明具体物质。
对可逆反应还要指明反应的方向。
(5)化学反应速率与化学方程式计量数的关系对于反应:m A+n B=p C+q D(各物质都不是固态或液态)v(A):v(B):v(C):v(D)=m:n:p:q=c (A): c (B):c (C):c (D)利用上式:①同条件下的同反应,不同物质之间表示的速率可以相互换算。
②不同条件下的同反应,可比较速率值的大小,比值越大,表明用该物质表示的反应速率越快③要特别注意,比较速率大小时,先换算成同一单位。
二. 影响化学反应速率的因素1. 内因(决定性因素)反应物本身的性质。
化学反应的实质是旧键的断裂、新建的生成。
反应物分子中键能越大,断裂就越难,其反应速率就越小。
2. 外因对同一个反应,外界条件不同,反应速率也不同。
外界条件主要指以下几个方面。
(1)浓度的影响在其他条件不变时,增加反应物的浓度可以增大化学反应速率;减小反应物的浓度可以降低化学反应速率。
注意:改变固体或纯液体的量对化学反应速率无影响。
固体或纯液体的浓度可视为常数,改变固体表面积会影响化学反应速率,因为当固体或液体参加反应时,反应速率只和接触面积、扩散速率大小有关,所以增大接触面积(将固体粉碎)或增大扩散速率(对反应物进行搅拌)均可提高反应速率。
化学反应的快慢与限度知识再现一、化学反应进行的快慢1、化学反应速率(表12-1):2、影响化学反应速率的因素:(1)内因:参加反应的物质的自身性质是影响化学反应速率的决定因素。
如:①相同大小的铁片和镁片与同浓度的盐酸反应,镁片的反应速率要比铁片快得多。
(原因:金属镁的活泼性强于金属铁)②反应Cl2 + H2 = 2HCl(快)和反应N2 +3H2 = 2NH3(慢)(原因:氯气的活泼性强于氮气,根本原因是分子内化学键的不同)③和金属钠反应的速率CH3COOH> H2O > CH3CH2OH (原因:H原子的活泼性不同)(2)外因:同一反应在不同条件下,反应的速率不同,浓度、温度、催化剂等外界条件对化学反应的速率有影响①浓度对化学反应速率的影响:其它条件不变的情况下,增大反应物的浓度,可以加快反应的速率。
实例:a、相同大小的铁片和不同浓度的盐酸反应。
b、硫粉在空气中燃烧和在氧气中燃烧。
②温度对化学反应速率的影响:其它条件不变的情况下,升高温度,可以加快反应的速率,通常情况下温度每升高10度,化学反应的速率增大到原来的2至4倍。
实例:a、相同大小的铁片和不同温度的盐酸(浓度相同)反应。
b、火越烧越旺。
③反应物间的接触面积对化学反应速率的影响:其他条件不变,增大反应物间的接触面积,能增大反应的速率。
实例:a、相同质量块状碳酸钙和粉末状碳酸钙分别和同体积同浓度的盐酸反应。
b、锅炉中燃煤时为了加快燃烧的速率和效率经常使用煤粉而不用煤块。
④催化剂对化学反应速率的影响:其他条件不变的情况下,使用催化剂能改变化学反应的速率。
实例:a、H2O2分别在MnO2、FeCl3、过氧化氢酶的催化作用下分解。
b、铁粉和碘粉混合物中滴入水(水做催化剂)c、使用催化剂可以促使汽车尾气中的CO和NO迅速变成无毒N2和CO2减少对大气的污染。
⑤其他因素:除了上述因素外,压强、光波、电磁波、超声波、溶剂等因素对化学反的速率也有影响。