高一化学从海水中提取溴和碘2
- 格式:pdf
- 大小:1.07 MB
- 文档页数:8

海水是化学元素宝库,海水中溶解了大量气体物质和各种盐类。
人类在陆地上发现的l00多种元素,在海水中可找到80多种。
海水是人类获取氯、溴、碘、镁及其化合物的重要资源。
一、氯、溴、碘的提取 (一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业我国主要以海盐为原料。
海盐中含硫酸钙、硫酸镁、氯化镁等杂质,要净化后制成饱和食盐水再电解。
2NaCl + 2H 2O == 2NaOH + H 2↑ +Cl 2↑氯碱工业面临问题:①产品对设备腐蚀严重、环境污染显著。
②电能消耗量大。
(二)从海水中提取溴的常见工艺①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl 2=Br 2+2NaCl ②向含溴单质的水溶液中通空气和水蒸汽,将溴单质吹入盛二氧化硫溶液的吸收塔内以达到富集的目的:Br 2+SO 2+2H 2O==2HBr+H 2SO 4(也可用NaOH 或Na 2CO 3溶液吸收) ③向吸收塔内的溶液中通入适量的氯气:2HBr+Cl 2==2HCl+Br 2 ④用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
(三)从海洋植物中提取碘的主要工艺①用水浸泡海带或海藻灼烧后的灰烬②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl 2 == I 2+2NaCl ③过滤,用有机溶剂萃取碘单质。
二、氯、溴、碘的性质和用途 (一)氯气的性质和用途氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:①原理:MnO 2+4HCl(浓) △ MnCl 2+Cl 2↑+2H 2O ②装置:固液加热型 ③收集:向上排空气法 ④验满:湿润的淀粉-碘化钾试纸等 ⑤尾气吸收:NaOH 溶液。
1、物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体。
能溶于水,有毒。
2、化学性质:氯原子易得电子,氯是活泼的非金属元素。
氯气与金属、非金属等发生氧化还原反应,一般作氧化剂。
与水、碱溶液则发生自身氧化还原反应,既作氧化剂又作还原剂。

第一单元氯、溴、碘及其化合物第四课时溴、碘的提取1.下列溶剂能溶解单质碘和溴,但不.能把碘和溴从碘水和溴水中提取出来的是()A.苯B.汽油C.酒精D.四氯化碳2.将适量的Cl2通入溴化钠溶液中,等反应停止后,实验室从该溶液中提取溴通常所需的主要仪器和方法是()A.蒸发皿;蒸发后灼烧B.烧杯;冷却、结晶、过滤C.分液漏斗;分液D.分液漏斗;加萃取剂,振荡静置后分液3.在a、b、c、d四个集气瓶中分别盛有H2、Cl2、HCl、HBr中的任一种气体,若将a和d两瓶气体混合后见光爆炸;若将a和b两瓶气体混合后,瓶壁上出现暗红色液滴,则a、b、c、d四个集气瓶中分别盛放的气体是()A.Cl2、H2、HCl、HBr B.Cl2、HCl、HBr、H2C.Cl2、HBr、H2、HCl D.Cl2、HBr、HCl、H24.(2011年启东中学高一检测)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是()①②③④A 黄绿色橙色蓝色白色B 无色橙色紫色白色C 黄绿色橙色蓝色无色5.(2011Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为()A.1∶2 B.2∶1C.1∶3 D.3∶16.有不纯的氯化铜粉末13.5 g(内含一种杂质),当与足量的AgNO3溶液反应时,生成29 g AgCl沉淀,则粉末中的杂质可能是()A.FeCl3B.KClC.ZnCl2D.BaCl27.用作麻醉剂的氯仿(CHCl3)常因保存不慎而被空气氧化,产生剧毒的光气(COCl2),反应的化学方程式为2CHCl3+O2===2HCl+2COCl2。
为了防止事故,使用前可用于检验氯仿是否变质的试剂是(注:CHCl3不与AgNO3溶液反应产生沉淀)()A.酚酞试液B.用硝酸酸化后的AgNO3溶液C.NaOH溶液D.用硝酸酸化后的Ba(NO3)2溶液8.(2010年扬州高一期中测试)溴化碘(IBr)是一种卤素互化物,它的化学性质活泼,能与大多数金属反应,也能与某些非金属单质反应,并能与水发生反应:IBr +H2O===HBr+HIO。



【 第3章 自然界中的元素】之小船创作第4节 海水中的元素 第2课时一、教材分析 (一)知识脉络本节教材内容以海水中化学资源的开发利用为线索展开,简单介绍了海水中化学元素的种类和存在形式,重点介绍了金属镁的提取原理、重要的化学性质和主要用途;然后通过实验探究,得出溴和氯、碘的氧化性强弱关系,以此为启示,介绍溴单质的提取原理和主要用途。
(二)知识框架1、学生预习枣庄编《学生自主学习丛书》P81页【预习导学】部分。
指导学生在自学过程中可以查阅手中的各种参考资料,学会自学。
2、高一化学(必修1)本来没有多少学生进行实验探究的机会,这一节可以尝试在老师的指导下,学生自己设计、讨论和确定实验方案,并亲自实施实验,使其体验科学探究的过程。
特别是有关颜色的变化会使学生影响更深刻。
3、最后由老师引导,让学生把上节课的知识和本节课氯、溴、碘单质之所学的知识进行概括、整合,使学生认识到海水对人类的重要性,同时回归到第四节“海水中的化学元素”是本章题目“自然界中的元素”的一部分,以此体现化学与社会生活的密切相关。
三、教学目标知识与技能1)通过实验能比较出氯、溴、碘单质氧化性强弱顺序;2)理解海水提溴的反应原理及步骤。
过程与方法通过对氯、溴、碘单质的氧化性强弱比较的探究活动,使学生亲身体会科学探究的过程和方法,并学会运用氧化还原反应的原理来设计实验,探究比较物质的氧化性和还原性相对强弱的方法。
情感态度与价值观让学生体验科学探究成功的喜悦,同时培养他们的表述能力和与他人合作的良好心理素质。
通过对海水中化学资源的开发利用的学习,使学生产生人类与环境友好相处的情感,激发他们运用化学知识解决环境和资源问题的兴趣和热情。
【教学重点、难点】重点:通过实验比较氯、溴、碘单质氧化性强弱;难点:如何设计实验,观察现象、分析推理得出结论。
四、教学准备:1、演示实验用品:药品:溴单质1瓶、碘单质1瓶、水1瓶、酒精1瓶、碘升华瓶;仪器:中试管6支、酒精灯、火柴。


高一化学必修一溴碘提取知识点溴碘提取是一种常见的化学实验技术,可以用于从溶液或混合物中分离提取溴或碘元素。
本文将介绍高一化学必修一课程中与溴碘提取相关的知识点,包括溴碘提取的基本原理、实验操作步骤以及常见应用。
一、溴碘提取的基本原理溴碘提取的基本原理是基于溴和碘元素在溶液中的溶解度差异。
在一定条件下,溴可以溶解于有机溶剂中,而碘则更易溶解于水。
通过不同溶解度的差异,可以实现溴和碘的分离提取。
二、实验操作步骤1. 准备实验器材和试剂:玻璃容器、溴或碘的混合溶液、有机溶剂(如丙酮或苯等)等。
2. 将溴碘混合溶液加入玻璃容器中,并加入适量的有机溶剂。
3. 摇动容器或搅拌溶液,使溴或碘与有机溶剂充分接触和混合。
4. 静置一段时间,待溴或碘以及有机溶剂相分离。
5. 小心取出上层的有机相(含溴或碘的溶液),移至另一个容器中。
6. 通过蒸发、冷却等方法,可以得到溴或碘的纯净物质。
三、常见应用1. 化学分析:溴碘提取可以用于样品中溴、碘含量的分析测定。
通过比较提取后的溶液颜色、浓度等特征,可以得到样品中溴碘元素的含量。
2. 有机合成:溴碘提取在有机合成领域中也有广泛的应用。
通过提取溴、碘元素,可以获得对应的有机化合物,用于进一步合成目标产物。
3. 实验教学:溴碘提取作为常见且简单的实验技术,常被用于化学实验教学中。
通过亲自进行提取实验,学生能够更加直观地了解溴碘的提取原理和操作步骤。
4. 化学工业:在化学工业中,溴、碘常被用于制备一系列有机化合物,如溴丁烷、碘酒等。
而提取溴碘元素则是获得这些化合物的重要步骤之一。
总结:通过本文的介绍,我们了解了高一化学必修一中与溴碘提取相关的知识点。
了解了溴碘提取的基本原理、实验操作步骤以及常见应用。
这些知识将有助于我们更好地理解化学实验原理和应用领域,培养实验操作技能,为今后的学习和研究打下坚实的基础。


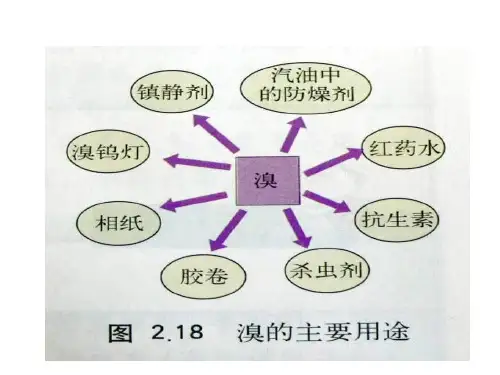
第四章化学与自然资源的开发利用第一节开发利用金属矿物和海水资源(第二课时海水资源的利用)【学习目标】1.通过阅读交流,知道海水资源的概况、海水淡化的过程。
通过实验探究知道从海水中提取溴、碘的原理和基本步骤。
2.通过海水资源的综合利用过程,认识化学方法在实现物质间转化中的作用。
初步形成面对低浓度混合物提取有用物质的策略。
进一步形成资源意识、环保意识和可持续发展意识。
【学习重点】海水的淡化;海水中碘元素和溴元素的提取【学习难点】海水中提取溴和碘的化学反应原理和实验方法【自主学习】旧知回顾:1.蒸馏实验的原理及所需主要仪器是什么?【温馨提示】蒸馏的原理是利用液体混合物中各组分挥发度(沸点)的差别,使液体混合物部分成分汽化并随之使蒸气部分冷凝,从而实现其所含组分的分离的方法;蒸馏实验的主要仪器名称为蒸馏烧瓶、酒精灯、温度计、冷凝管(含尾接管)、锥形瓶、铁架台等。
2.指出如下图所示分馏装置中的错误并加以改正。
【温馨提示】①温度计位置不正确。
改正:温度计不能插入液面下,水银求应与蒸馏烧瓶的支管口保持水平;②冷凝管中水的流向错误。
冷凝管中冷却水应从下口(a)进,上口(b)出;③接受器不能用烧杯。
将烧杯改为锥形瓶。
新知预习:1.海水水资源的利用:主要包括海水的淡化和直接利用海水进行循环冷却等。
通过从海水中提取淡水或从海水中把盐分离出去,都可以达到淡化海水的目的。
2.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
其中蒸馏法的历史最久,技术和工艺也比较成熟,但成本较高。
因此,海水淡化与化工生产结合、与能源技术结合,成为海水综合利用的重要方向。
3.从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。
【同步学习】情景导入:钓鱼岛是钓鱼岛列岛的主岛,位于中国东海,距温州市约356千米、福州市约385千米、基隆市约190千米,面积4.3838平方公里,周围海域面积约为17万平方公里。
太平洋黑潮流经这里,带来了大批鱼群,所以我国浙江、福建和台湾等地的渔民经常到这一带捕鱼。
促敦市安顿阳光实验学校第2课时溴碘及海水提溴1.了解氯、溴、碘单质的氧化性以及递变规律。
2.了解海水提溴的方法和工艺流程。
3.掌握溴单质的性质。
知识清单一、氯、溴、碘的性质1.物理性质。
物理性质氯气溴单质碘单质颜色黄绿色深红棕色紫黑色状态气体液体固体溶液颜色水中黄绿色橙色棕色酒精中橙红紫色四氯化碳中橙红紫红2.溴、碘的特性。
(1)溴的特性。
常温下为液体(唯一的液态非金属单质),易挥发。
(2)碘的特性。
性质特性用物理性质易升华分离和提纯碘化学性质遇淀粉溶液变蓝碘的检验1.室里如何保存液溴?答案:保存在棕色细口瓶里并加少量水,防止其挥发。
2.碘和食盐的混合物如何分离?答案:由于碘易升华,故可用加热法分离碘和食盐。
3.Cl2、Br2、I2氧化性的比较。
内容现象结论溶液由无色变为橙色,滴加CCl4,振荡后,溶液分层,下层液体呈橙化学方程式为:Cl2+2NaBr===2NaCl+Br2,说明Cl2的氧化性强于Br2 (续上表)溶液由无色变为深黄色,滴加CCl4,振荡后,溶液分层,下层液体呈紫色化学方程式为:Cl2+2KI===2KCl+I2,说明Cl2的氧化性强于I2溶液由无色变为深黄色,滴加CCl4,振荡后,溶液分层,下层液体呈紫化学方程式为:Br2+2KI===2KBr+I2,说明Br2的氧化性强于I2卤素单质的氧化性强弱顺序为:Cl2>Br2>I2,阴离子的还原性强弱顺序为:Cl-<Br-<I-4.萃取。
利用混合物中一种溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一溶剂组成的溶液中提取出来的分离方法叫萃取。
萃取后可以用分液漏斗把互不相溶的两种液体分开,从而达到分离的目的。
如用CCl4将溴或碘单质从它们的水溶液中提取出来。
3.能否用乙醇萃取溴水中的溴?为什么?答案:不能,因为乙醇和水互溶,不易分离。
二、海水提溴1.溴的存在。
99%的溴元素以Br-的形式存在于海水中,所以溴元素被人们称为“海洋元素”。
第5课时溴和碘的提取1.下列关于药品的保存方法正确的是()A.少量钠保存在汽油中B.固态碘盛在细口玻璃瓶中C.液溴保存在加有少量水的盖有玻璃塞的棕色细口瓶中D.浓HNO3盛在盖有橡胶塞的棕色瓶中2.把少量的溴水加到过量的KI溶液中,再加入CCl4振荡后静置,下列现象中正确的是()A.得到均匀的紫色溶液B.无色水层下有橙红色液体C.无色水层下有紫色油状液体D.无色水层上有紫色油状液体3.欲将食盐固体与碘的混合物分开,最好的方法是()A.溶解、过滤B.溶解、过滤、蒸发C.溶解、加AgNO3溶解、过滤D.加热使其升华4.将氯水注入KI溶液中充分反应后,再加入CCl4,振荡后静置,看到的现象是()A.液体均一,呈紫红色B.液体分两层,上层为紫红色,下层无色C.液体分两层,下层为紫红色,上层无色D.液体均一、无色5.能使溶液中的溴离子增加的是()A.把Cl2通入NaBr溶液中B.把溴水滴加到过量的AgNO3溶液中C.把溴水滴加到NaI溶液中D.把溴水滴加到CCl4中6.某同学为了测定加碘食盐中碘的含量,需要向食盐溶液中加入碘化钾溶液和稀硫酸,发生如下反应:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,然后用四氯化碳把碘单质提取出来,后一过程的操作叫做() A.蒸馏B.过滤C.萃取D.分液7.甲状腺肿大是边远山区常见的地方病,下列元素对该病有治疗作用的是()A.钠元素B.氯元素C.碘元素D.铁元素8.下列物质不能使潮湿的淀粉-KI试纸变蓝的是()A.碘水B.溴水C.碘化钾溶液D.氯气9.盛放液溴的试剂瓶中要加入确定量的水,其目的是()A.制得溴水B.比较水和液溴的密度C.将液溴隔绝空气D.防止液溴挥发10.将适量Cl2通入溴化钠溶液中,等反应停止后,从该溶液中提取溴通常所需的主要仪器和方法是() A.蒸发皿;蒸发后灼热B.烧杯;冷却;分液C.分液漏斗;结晶、过滤D.分液漏斗;加萃取剂,振荡静置后分液11.某溶液Cl-、Br-、I-三者物质的量之比是1∶2∶3,通入确定量的Cl2,当反应完后比值为3∶2∶1,则反应的Cl2和原溶液中I-的物质的量之比是()A.1∶2 B.1∶3 C.1∶4 D.1∶612.某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO-3的物质的量之比是1∶2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为()A.2∶3 B.4∶3 C.10∶3 D.11∶313.溴化碘(IBr)的化学性质与卤素单质相像,能跟大多数金属反应生成金属卤化物,能跟水反应,IBr +H2O===HBr+HIO。
学业分层测评(十一)(建议用时:45分钟)[学业达标]1.在盛有KI溶液的试管中,滴入氯水充分反应后,再加四氯化碳振荡,静置后观看到的现象是()A.上层紫红色,下层接近无色B.均匀、透亮、紫红色C.均匀、透亮、无色D.上层接近无色,下层紫红色【解析】2KI+Cl2===2KCl+I2,碘在四氯化碳中的溶解度大于在水中的溶解度且CCl4的密度比水大,故上层接近无色,下层紫红色(碘在CCl4中的颜色)。
【答案】 D2.从溴化钠中制取单质溴可接受的方法是() 【导学号:16380124】A.蒸发至干,灼烧固体B.滴入新制的氯水,用汽油萃取C.通入新制的氯气,用酒精萃取D.加入碘水,用四氯化碳萃取【解析】A不正确,由于NaBr同NaCl一样,是热稳定性良好的化合物,灼烧不易分解。
B正确,由于2Br-+Cl2===Br2+2Cl-,汽油为有机溶剂,Br2在汽油中的溶解度大于在水中的溶解度,且汽油与水不互溶。
C不正确,因酒精与水互溶。
D不正确,因碘单质的活泼性不如溴单质的活泼性强,不能发生置换反应。
【答案】 B3.稀的碘水和溴水的颜色格外浅,近乎无色。
检验稀碘水和稀溴水时,所用的最佳试剂是()A.淀粉溶液B.氯水C.NaOH溶液D.NaBr溶液【解析】氯水、NaBr溶液与溴水、碘水都不反应,NaOH溶液与二者都反应,二者都褪色,现象相同,不能区分,淀粉遇I2变蓝色。
【答案】 A4.从海带中提取碘的试验过程中,涉及下列操作,其中正确的是() 【导学号:16380125】【解析】海带灼烧成灰应在坩埚中进行;过滤时应用玻璃棒引流;碘的苯溶液在分液漏斗中位于上层,应待下层液体放出后从上口倒出;分别碘并回收苯应用蒸馏的方法,用水浴加热能把握温度不至于太高而防止碘升华。
【答案】 D5.从海水中可以提取溴,主要反应为2KBr+Cl2===Br2+2KCl,下列说法正确的是() A.溴离子具有氧化性B.氯气是还原剂C.该反应属于复分解反应D.氯气的氧化性比溴单质强【解析】Br-的化合价处于最低价态,只有还原性,A错;氯气在反应中作氧化剂,B错;该反应属于置换反应,C错;该反应中,氯气为氧化剂,溴为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,D正确。