高一化学碳的多样性2
- 格式:pdf
- 大小:1.05 MB
- 文档页数:8
第3章第1节碳的多样性第二课时碳及其化合物间的转化编制:王浩审核:高一化学组2016-12-05【学习目标】1.了解碳元素在自然界及生产、生活中的转化,能写出相关反应的化学方程式。
2.能从原理上解释溶洞、钟乳石的形成,能用化学方程式表示高炉炼铁、木炭燃烧过程的有关反应。
3.了解碳单质、碳的氧化物、碳酸盐、碳酸氢盐的性质及转化关系。
【学习重难点】碳单质、碳的氧化物、碳酸盐、碳酸氢盐的性质及转化关系【自主学习】一、自然界中碳及其化合物间1.转化过程2.溶洞的形成模拟溶洞形成的实验(1)实验目的:探究溶洞的形成原理。
(2)实验方案与记录:二、生产和生活中碳及其化合物间的转化1.高炉炼铁(1)设备:高炉(2)原料:、铁矿石(主要成分)。
(3)原理:将铁矿石还原成金属铁的过程。
(4)过程:写出下列方程式① CO的生成:②铁矿石被还原:【注意】高炉炼铁中实际的还原剂实是CO2.木炭的燃烧(1)燃烧过程中谈及其化合物的转化关系(2)转化过程中的反应方程式①②③④。
3.水垢的形成:(1)主要成分:CaCO3和Mg(OH)2(2)形成原理:①②Mg(HCO3)2=====MgCO3+H2O+CO2③MgCO3+H2O====Mg(OH)2+CO24.碳在有机物和无机物之间的转化1828年德国化学家维勒用无机化合物氰酸铵和合成出有机化合物尿素,由此突破了无机化合物与有机化合物之间的界限。
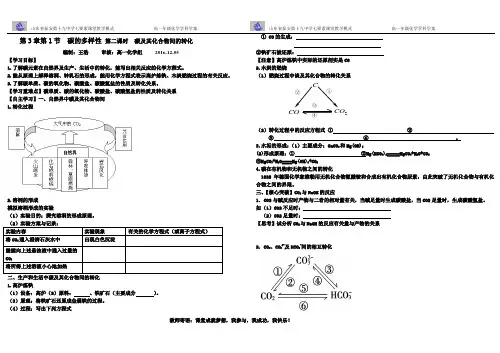
三、【核心突破】CO2与NaOH的反应1.CO2与碱反应时产物与二者的相对量有关,当碱足量时生成碳酸盐,当CO2足量时,生成碳酸氢盐。
如(1)CO2不足时:(2)CO2足量时:【思考】试分析CO2与NaOH的反应有关量与产物的关系2. CO2、CO32-及HCO3-间的相互转化CO2COC①②③④①与活泼金属氧化物反应:CO 2+Na 2O=Na 2CO 3 与过量碱反应:CO 2+2OH -=CO 32-+H 2O ②与过量酸反应:③与少量酸反应: 与CO 2、H 2O 反应: ④与碱反应: 受热分解: ⑤与酸反应: 受热分解: ⑥与少量碱反应: 与CO 32-、H 2O 反应:【随堂练习】1.(双选题)关于高炉炼铁的原理下列叙述中正确的是( ) A .铁矿石在高温下被还原成铁单质B .生铁中杂质被氧化C .铁矿石在高温下被焦炭还原成铁D .铁矿石在高温下被CO 还原成铁 2.下列有关碳及其化合物间的相互转化属于氧化还原反应的是( ) A .NaHCO 3+NaOH===Na 2CO 3+H 2O B .CO 2+Na 2CO 3+H 2O===2NaHCO 3C .3CO +Fe 2O 3=====高温2Fe +3CO 2D .Ca(HCO 3)2=====△CaCO 3+H 2O +CO 2↑ 3.要除去二氧化碳气体中的一氧化碳,常用的方法是( ) A .通过澄清石灰水 B .通过灼热炭C .通过水D .通过灼热的氧化铜粉末4.向NaOH 溶液中通入过量CO 2后,溶液中存在的主要离子是( )A .Na +、CO 2-3B .Na +、HCO -3C .HCO -3、CO 2-3D .Na +、OH -5.无色气体X 跟灼热的炭反应得到一种无色气体Y ,Y 跟灼热的氧化铜反应又得到无色气体X ,则X 、Y 分别是( ) A .O 2、CO 2 B .CO 2、CO C .CO 、CO 2 D .O 2、CO6.要除去CO 2气体中混有的少量HCl 气体,最好的方法是将混合气体通过( ) A .饱和NaHCO 3溶液 B .Na 2CO 3溶液 C .饱和石灰水 D .NaOH 溶液7. 某固体物质A 受热分解,生成B 、C 、D 三种物质。

3.1 碳的多样性一、多种多样的碳单质:1.同素异形体由同一种元素组成的性质不同的几种单质,如氧元素的同素异形体有氧气和臭氧,碳元素的同素异形体有石墨、金刚石、 C 60等。
2.碳的同素异形体注意事项:经常采用燃烧的办法来验证金刚石和石墨均由碳元素组成二、广泛存在的含碳化合物- 1 -- 2 -三、碳的化合物Na 2CO 3和 NaHCO 3性质的比较注意事项:Na 2CO 3溶液与盐酸作用时,滴加顺序不同,实验现象可能会有所不同,产生的 CO 2的量也可能不同(1把 Na 2CO 3溶液逐滴滴到盐酸中,开始时盐酸就已经相对过量,则发生反应:Na 2CO 3+2HCl===2NaCl+CO2↑ +H2O ,即一滴加就有 CO 2气体产生(2把盐酸逐滴滴到 Na 2CO 3中, 开始时 Na 2CO 3相对过量, 则发生反应 Na 2CO 3+ HCl=== NaHCO 3+CO2↑,继续滴加盐酸时,才发生反应 NaHCO 3+HCl=== NaCl+CO2↑,即一开始没有 CO 2气体,后来才有气体放出四、碳及其化合物间的转化1.自然界中的转化形式(1 自然界中 CO 2的产生和消耗⎪⎪⎪⎪⎪化石燃料燃烧—动物遗体分解—火山喷发—动植物呼吸—――→ 产生大气的CO2――→ 消耗⎪⎪⎪⎪—光合作用—溶解(2溶洞及钟乳石、石笋的形成 :A 、溶洞形成的化学方程式为 :CaCO3+CO2+H2O===Ca(HCO 3 2B 、钟乳石、石笋形成的化学方程式为: Ca (HCO 3 2===CaCO3+CO2↑ +H2O2、生产和生活中碳及其化合物间的转化(1高炉炼铁A 、原料:焦炭和铁矿石 (主要包括赤铁矿和磁铁矿。
B 、过程 (实际起还原作用的是 CO① CO的产生 :②铁矿石被还原(2木炭燃烧 (用化学方程式表示(3 水垢A 、主要成分:CaCO 3和 Mg(OH2B 、形成过程:Ca (HCO 3 2 ===CaCO3+CO2↑ +H2O(4 碳在无机物和有机物间的转化1828年, 德国化学家维勒用无机物氰酸铵 (NH4CNO 首次合成了有机物尿素[分子式为 CO(NH2 2], 开创了以含碳无机化合物合成有机化合物的先河。









第三章自然界中的元素第一节碳的多样性(第一课时)【教学目标】:1.通过介绍各种碳单质,使学生了解同素异形体的概念,知道碳常见的三种同素异形体,它们的物理性质有较大的差别,导致物理性质相异的主要原因是碳原子的排列不同。
2.通过活动探究认识碳酸钠和碳酸氢钠的重要性质,初步体会它们性质的差异。
【知识回顾】:1、实验室制备二氧化碳反应的化学方程式2、向澄清石灰水中逐渐通入二氧化碳至过量的化学方程式(注意分步书写) Ca(OH)2+CO 2= CaCO3 2O CaCO 3+H 2O+CO 2= Ca(HCO 3)2 【教学内容】一、多种多样的碳单质思考:由同种元素形成的不同单质为何性质差异很大?(结构不同)2、同素异形体:有同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。
(除此之外,还有氧气和臭氧是氧元素的同素异形体,白磷和红磷是磷元素的同素异形体。
)二、广泛存在的含碳化合物1、 碳酸钠和碳酸氢钠的性质比较注意:(1)、碳酸钠中逐滴滴加稀盐酸先生成碳酸氢钠,然后再继续反应生成二氧化碳,碳酸氢钠与盐酸反应比碳酸钠与盐酸反应剧烈的多。
(2)、碳酸钠与氯化钙反应产生白色沉淀,而碳酸氢钠不反应思考:1、如何鉴别碳酸钠和碳酸氢钠溶液?分别取少量溶液于试管中,加入氯化钙溶液,能产生白色沉淀的是碳酸钠溶液,没有变化的是碳酸氢钠溶液2、如何除去碳酸钠固体中碳酸氢钠?加热混合物至质量不再改变3、如何除去碳酸氢钠溶液中碳酸钠?在溶液中通入足量二氧化碳【巩固提高】1、金刚石、石墨、C60性质有所不同,是由于()A.构成原子不同B.原子的各自排列方式不同C. 具有不同的几何外形D. 硬度不同2、石墨炸弹爆炸时能在方圆几百米范围内撒下大量的石墨纤维,造成输电线、电厂设备损坏。
这是由于石墨()A.有放射性B.易燃、易爆C.能导电D.有剧毒3.下列说法中不正确的是()A.Na2CO3比NaHCO3易溶于水B.Na2CO3比NaHCO3稳定C.石灰水能与Na2CO3反应,而不能与NaHCO3反应D.与足量盐酸反应要得到同质量的CO2,用NaHCO3比Na2CO3的质量要少。