第七章化学动力学基础
- 格式:doc
- 大小:33.50 KB
- 文档页数:4




第七章化学动力学基础7-1:区别下列概念:(a) 碰撞理论和过渡态理论;(b) 有效碰撞与无效碰撞;(c) 活化能与反应热;(d) 均相催化剂与多相催化剂;(e) 催化剂、助催化剂与阻化剂;(f) 物理吸附与化学吸附;(g) 反应分子数与反应级数;(h) 单分子过程和双分子过程。
答:(a) 碰撞理论和过渡态理论是描述反应速率理论的两个不同理论:碰撞理论:1918 年Lewis 运用气体分子运动论的成果提出的一种反应速率理论。
它假设:①原子、分子或离子只有相互碰撞才能发生反应,即碰撞是反应的先决条件;②只有少部分碰撞能导致化学反应,大多数反应物微粒碰撞后发生反弹而与化学反应无缘。
过渡状态理论:20 世纪30 年代,在量子力学和统计力学发展基础上,由Eyring等提出的另一种反应速率理论。
它认为反应物并不只是通过简单碰撞就能变成生成物,而是要经过一个中间过渡状态,即反应物分子首先形成活化络合物,通常它是一种短暂的高能态的“过渡区物种”,既能与原来的反应物建立热力学的平衡,又能进一步解离变为产物。
(b) 在碰撞理论中,能导致化学反应的碰撞为有效碰撞,反之则为无效碰撞。
(c) 为使反应得以进行,外界必需提供的最低能量叫反应的活化能;反应热是反应过程(从始态至终态)的热效应(放出或吸收的热量)。
(d) 决定于是否与反应物同处一相。
(e) 催化剂是一类能改变化学反应速率而本身在反应前后质量和化学组成都没有变化的物质;助催化剂是能够大大提高催化剂催化效率的一类物质;阻化剂则是严重降低甚至完全破坏催化剂催化活性的一类杂质。
(f) 两者的区别在于催化剂与被吸附物之间作用力的本质不同。
如果被吸附物与催化剂表面之间的作用力为范德华力, 这种吸附叫物理吸附;如果被吸附物与催化剂表面之间的作用力达到化学键的数量级, 则叫化学吸附。
(g) 反应级数是描述速率方程的一个术语,不必考虑方程所描述的反应是否为元反应,它等于速率方程中浓度项指数的和;而只是元反应才能按反应分子数分类,参与元过程的分子的数目叫该元过程的分子数;(h) 单分子过程和双分子过程是元反应设计的术语,单分子过程前者涉及单个分子的解离;双分子过程则涉及两个分子的碰撞。

第七章化学反应动力学一.基本要求1.掌握化学动力学中的一些基本概念,如速率的定义、反应级数、速率系数、基元反应、质量作用定律和反应机理等。
2.掌握具有简单级数反应的共同特点,特别是一级反应和a = b的二级反应的特点。
学会利用实验数据判断反应的级数,能熟练地利用速率方程计算速率系数和半衰期等。
3.了解温度对反应速率的影响,掌握Arrhenius经验式的4种表达形式,学会运用Arrhenius经验式计算反应的活化能。
4.掌握典型的对峙、平行、连续和链反应等复杂反应的特点,学会用合理的近似方法(速控步法、稳态近似和平衡假设),从反应机理推导速率方程。
学会从表观速率系数获得表观活化能与基元反应活化能之间的关系。
5.了解碰撞理论和过渡态理论的基本内容,会利用两个理论来计算一些简单反应的速率系数,掌握活化能与阈能之间的关系。
了解碰撞理论和过渡态理论的优缺点。
6.了解催化反应中的一些基本概念,了解酶催化反应的特点和催化剂之所以能改变反应速率的本质。
7.了解光化学反应的基本定律、光化学平衡与热化学平衡的区别,了解光敏剂、量子产率和化学发光等光化反应的一些基本概念。
二.把握学习要点的建议化学动力学的基本原理与热力学不同,它没有以定律的形式出现,而是表现为一种经验规律,反应的速率方程要靠实验来测定。
又由于测定的实验条件限制,同一个反应用不同的方法测定,可能会得到不同的速率方程,所以使得反应速率方程有许多不同的形式,使动力学的处理变得比较复杂。
反应级数是用幂函数型的动力学方程的指数和来表示的。
由于动力学方程既有幂函数型,又有非幂函数型,所以对于幂函数型的动力学方程,反应级数可能有整数(包括正数、负数和零)、分数(包括正分数和负分数)或小数之分。
对于非幂函数型的动力学方程,就无法用简单的数字来表现其级数。
对于初学者,要求能掌握具有简单级数的反应,主要是一级反应、a = b的二级反应和零级反应的动力学处理方法及其特点。

第七章化学动力学主要内容1.化学动力学的任务和目的2.化学反应速率的定义3.化学反应的速率方程4.具有简单级数的反应5.几种典型的复杂反应6.温度对反应速率的影响7.链反应 重点1.重点掌握化学反应速率、反应速率常数及反应级数的概念2.重点掌握一级和二级反应的速率方程及其应用3.重点掌握复杂反应的特征,了解处理对行反应、平行反应和连串反应的动力学方法。
4.重点理解阿罗尼乌斯方程的意义并会应用。
明确活化能及指前因子的定义 难点1.通过实验建立速率方程的方法2.稳态近似法、平衡近似法及控制步骤的概念及其运用3.复杂反应的特征及其有关计算 教学方式1.采用CAI 课件与黑板讲授相结合的教学方式。
2.合理运用问题教学或项目教学的教学方法。
教学过程第7.1节化学动力学研究的内容和方法热力学讨论了化学反应的方向和限度,从而解决了化学反应的可能性问题,但实践经验告诉我们,在热力学上判断极有可能发生的化学反应,实际上却不一定发生。
例如合成氨的反应,223()3()2()N g H g NH g ,在298.15K 时,按热力学的结论,在标准状态下此反应是可以自发进行的,然而人们却无法在常温常压下合成氨。
但这并不说明热力学的讨论是错误泊,实际上豆科植物就能在常温常压下合成氨,只是目前还不能按工业化的方式实现,这说明化学反应还存在一个可行性的问题。
因此,要全面了解化学反应的问题,就必须了解化学变化的反应途径----反应机理,必须引入时间变量。
研究化学反应的速率和各种影响反应速率的因素,这就是化学动力学要讨论的主要内容。
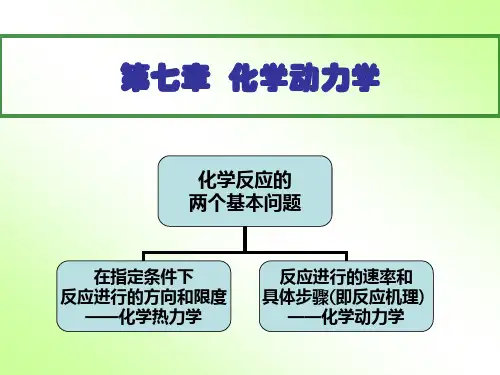
一、化学热力学的研究对象和局限性:研究化学变化的方向、能达到的最大限度以及外界条件对平衡的影响。
化学热力学只能预测反应的可能性,但无法预料反应能否发生?反应的速率如何?反应的机理如何?例如:热力学只能判断这两个反应都能发生,但如何使它发生,热力学无法回答。
二、化学动力学的研究对象 化学动力学研究化学反应的速率和反应的机理以及温度、压力、催化剂、溶剂和光照等外界因素对反应速率的影响,把热力学的反应可能性变为现实性。



第三章化学动力学基础
一、教学要求
1 .掌握化学反应速率的基本概念及表示方法。
2 .掌握反应机理概念,掌握有效碰撞理论,了解过渡状态理论,掌握活化能、活化分子的概念及其意义。
3 .掌握浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系:质量作用定律,化学反应的温度因子,熟悉阿仑尼乌斯方程及其应用。
4 .了解活化过度状态理论的要点;了解催化作用的特点,了解酶催化。
二、教学重点
1 .反应机理的概念,有效碰撞理论,过渡状态理论,活化能、活化分子的概念及其意义。
2 .浓度、温度、催化剂对化学反应速率的影响及浓度、温度对化学反应速率影响的定量关系:质量作用定律,化学反应的温度因子,阿仑尼乌斯方程及其应用。
三、教学难点
1 .有效碰撞理论,过渡状态理论,活化能、活化分子的概念。
2 .质量作用定律,阿仑尼乌斯方程。
四、教学时数 6 学时
五、教学内容
1 .化学反应速率的基本概念及表示方法:平均速率和瞬时速率,同一反应用不同物系表示速率时这些速率间的关系。
2 .反应机理(反应历程)概念:基元反应和非基元反应、反应分子数(单分子反应、双分子反应、三分子反应)。
3 .反应速率理论简介:有效碰撞理论的基本要点,有效碰撞的条件,有效碰撞、活化能、活化分子的概念,碰撞频率因子与化学反应临界能或阀能的关系公式,活化能、方位因子、碰撞频率因子与反应速率的关系,活化过渡状态理论的基本要点,活化络合物;实验活化能。
4 .浓度对化学反应速率的影响:质量作用定律、反应级数、化学反应速率方程式;温度对化学反应速率的影响:化学反应的温度系数(因子),阿仑尼乌斯方程式及其应用。
5 .催化剂基本概念及其基本特征,催化作用,催化剂对化学反应速率的影响机制,催化剂寿命、催化剂中毒、催化剂毒物、助催化剂、催化剂载体;酶催化及酶催化的特点。
7-1 化学反应速率
一、化学反应速率的定义:
例如:H2O2(aq) →H2O (l) + 1/2 O2(g)
数值见表
化学反应速率:
反应进度ξ随时间的变化率。
aA+bB===gG+dD
J = dξ/ dt
ξ:反应进度;t :时间
反应进度dξ与物质B 的物质的量的改变dn B 有关系
物质B 在反应式中的计量系数。
对于反应物,取负值,表示减少;
对于生成物,取正值,表示增加。
反应速率:
①某一时刻的反应速率、瞬时速率:
②平均速率
③用反应中的任何物质表示反应速率,数值上都是一样的;
④瞬时速率的测定可以由作图法得到。
影响反应速率的因素:
内因:反应的活化能大小
外因:浓度、温度、催化剂
7-2 浓度对化学反应速率的影响
•基元反应:对于简单反应,反应物分子在有效碰撞中经过一次化学变化就能转化为产物的反应。
•基元反应的化学反应速率方程式:可由质量作用定律描述,
k 称为反应的速率常数:
①k 可理解为当反应物浓度都为单位浓度时的反应速率;
②k 由化学反应本身决定,是化学反应在一定温度时的特征常数;
③相同条件下,k 值越大,反应速率越快;
④k 的数值与反应物的浓度无关。
3 .非基元反应:
反应物分子需经几步反应才能转化为生成物的反应。
4 .非基元反应的速率方程式
不能只根据反应式写出其反应速率方程,必须根据实验测定的结果及验证,推出反应的反应机理
复杂的非基元反应→分成若干个基元反应→反应最慢的一步作为控制步骤。
最慢的一个反应就控制了该复杂反应的反应速率
5 .反应级数
基元反应aA+bB = gG
反应对于物质A 是a 级反应,对物质B 是b 级反应。
a +
b 表示该反应级数。
6 .反应级数的意义:
①表示了反应速率与物质的量浓度的关系;
②零级反应表示了反应速率与反应物浓度无关
7 .速率常数的单位
零级反应: ;k 的量纲为mol·dm -3 ·s -1
一级反应: ;k 的量纲为s -1
二级反应: ;k 的量纲为mol -1 ·dm 3 ·s -1
三级反应: ;k 的量纲为mol -2 ·dm 6·s -1
8 .气体反应
可用气体分压表示
7-3 温度对化学反应速率的影响
1 .Arrhenius( 阿仑尼乌斯) 公式
A :反应的频率因子,对确定的化学反应是一常数,A 与k 同一量纲;
E a :反应活化能;
R :8.314 J·mol -1 ·K -1
T :热力学温度
2 .阿仑尼乌斯公式的应用
求出任一温度下该反应的k 值
①作图法
②根据二点进行计算
7-4 反应历程
一、零级反应
二、一级反应
相当于Y = aX + b 型直线方程;c—t ,得一直线,直线斜率的负值是速率常数k
三、二级反应
四、三级反应
五、反应机理的确定
7-5 碰撞理论和过渡状态理论
1 .碰撞理论(Collision Theory )
气体分子能量分布曲线E
2 .过渡状态理论
要点:在反应物相互接近时,要经过一个中间过渡状态,即形成所谓的活化络合物,活化络合物既可以分解为反应物分子,也可以分解为产物分子。
活化络合物和反应物( 或生成物) 存在能垒,这一能垒被称为正反应(或逆反应)的活化能
反应速率与碰撞频率Z ,分子有效碰撞分数f ,以及方位因子p 有关
讨论:比较过渡态理论的活化能与碰撞理论的活化能
Ea 正- Ea 逆= D rH
活化能是决定反应速率的内在因素
7-6 催化剂对化学反应速率的影响
正催化:加速反应速率;负催化:减慢反应速率
1 .催化剂改变反应速率的原因
降低了反应的活化能;不改变反应的自由能,也不改变平衡常数K r ;缩短平衡到达的时间,加快平衡的到来。
2 .催化类型
化学催化、均相催化、非均相催化;
生物催化:生命体中各种酶的催化;
物理催化、光催化、电催化。
例如:均相催化
CH3CHO →CH4 + CO Ea = 190 KJ·mol -1
例如:均相催化
CH3CHO →CH4 + CO Ea = 190 KJ·mol -1
以I2作催化剂
CH3 CHO →CH4 + CO Ea = 136 KJ·mol -1
CH3 CHO + I2 →CH3I + HI + CO
CH3I + HI →CH4 + I2
反应活化能大大降低
非均相催化
2N2O === 2N2 + O2
E a = 250 KJ·mol -1
用金粉做催化剂,金粉吸附形成N ≡N ×××Au 中间体
2N 2 O === N ≡N ? O ×××Au →2N 2 + O 2
E a = 120 kJ·mol -1
3 .催化剂的特征
催化活性、选择性、稳定性、再生性
4 .催化剂的选择性
C 2 H 5 OH =CH 3 CHO + H 2
C 2 H 4 + 1/2O 2 =CH 2 ? CH 2(Ag 催化)。