一、碳负离子的产生二、碳负离子的烃基化反应三、碳负离子的酰基化
- 格式:pdf
- 大小:911.87 KB
- 文档页数:11
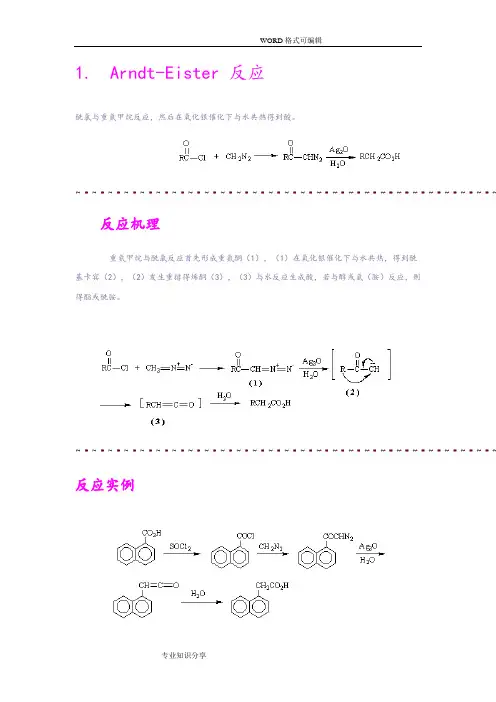
1.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
碳链增长反应的总结林剑锋罗祎迩洪宇浩张述熙吴明【摘要】本文主要总结了几个常见的有机合成中碳链增长的反应,阐述了其适应范围和优缺点。
【关键词】碳链增长有机合成有机合成中,碳骨架的构建是极其重要的一步,这就涉及到了碳链的增长。
有机化学的碳链增长的反应众多,适用场合不一,若无法很好的理解各个反应的优缺点,便很难得心应手的完成有机合成。
因此,我们对几个常见的碳链增长反应进行了总结。
1、自由基聚合烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。
改反应可制备高聚物,是合成塑料、橡胶的基础。
该反应无法合成特定碳链个数的小分子。
2、炔钠的应用缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。
炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代。
反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。
乙烯型卤也不与炔钠反应。
该反应是由低级炔制备高级炔的重要方法,之后可由炔烃的还原,制备立体专一的顺式烯烃或反式烯烃。
还可以直接水合成酮。
如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代。
3、炔烃的亲核加成反应由于炔烃与烯烃相比,采用的杂化不同,炔烃为SP杂化,其中S轨道占有的成分高,对电子的吸引能力强,所以炔烃可一发生亲核加成而烯烃不能,利用这个性质,可以用来延长碳链这里以乙炔为例。
Nu 为带有碳链的亲核基团利用炔烃可以进行亲核加成的特性可以让炔与羧酸反应制备无法用烯醇直接酯化制得的酸烯酯。
还可是让炔与氢氰酸生成烯腈,烯腈再水解就可以得到α,&不饱和酸,以此衍生制备各种α,&不饱和不饱和化合物。
4、狄-阿(Diels –Alder )反应共轭双烯与亲双烯体生成环己烯的反应。
狄尔斯-阿尔德反应可以合成带有不饱和键六元环和桥环化合物,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。
该反应条件所需条件不严格,只需加热便可进行。


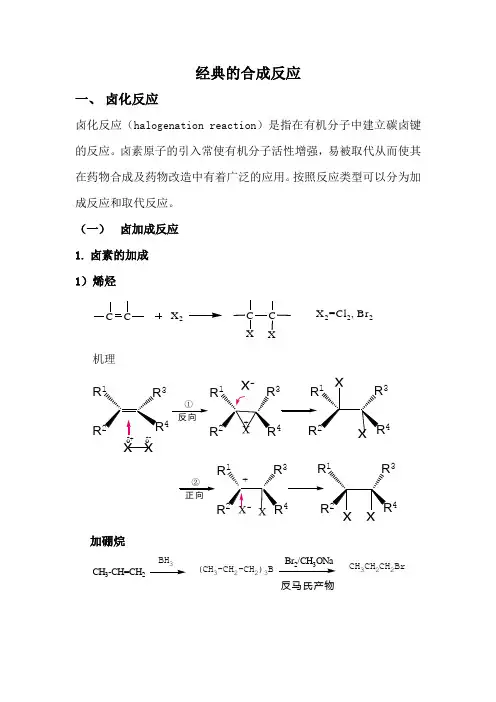
经典的合成反应一、 卤化反应卤化反应(halogenation reaction )是指在有机分子中建立碳卤键的反应。
卤素原子的引入常使有机分子活性增强,易被取代从而使其在药物合成及药物改造中有着广泛的应用。
按照反应类型可以分为加成反应和取代反应。
(一) 卤加成反应 1. 卤素的加成 1)烯烃CX 2C C XXX 2=Cl 2, Br 2机理x xR R 34RR 4334R R ①-R 1R4R 334R ②+加硼烷CH 3-CH=CH 2BH 3(CH 3-CH 2-CH 2)3B23CH 3CH 2CH 2Br反马氏产物C 6H 13C CHOBH O 70℃,2hC CC 6H 13HHO B 25℃,2hC CC 6H 13HHB(OH)2C CC 6H 13HHI90%I 2/NaOH/H 2O 2H 2O2)炔烃 得反式二卤烯烃C-CH 3CPh C-CH 3CPh C C PhC-CH 2OHCBr BrClClCH32LiBr Cl C C I H2OH I I 23)不饱和羧酸的卤内酯化反应CH 2COOHOOI2. 卤化氢的加成 1)卤化氢的亲电加成机理C R1R3+反向同向2)溴化氢的自由基加成反应CH 3CH=CH 2CH 3CHBrCH 3CH 3CH 2CH 2BrMarkovnikov 加成反Markovnikov 加成Ph-CH=CH 2HBrHBr H 2O 2或光照Ph--C-CH 3Ph-CH 2CH 2Br 反马氏规则3. 次卤酸(酯)、N-卤代酰胺加成1)次卤酸CCX 2CCX+H 2OHXX 2=Cl 2, Br 2+机理:C CR 1R 324C CR R 34 C CR 1R 34X OHXX-OHHBrOCl--OH2)N-卤代酰胺Ph-CH=CH 2Ph-CH - CH 2OHNBA(二) 卤代反应1.烃类 1)脂肪烃CH 2=CH-CH 3CH2=CH-CH 2Br NBSCH 2CH 2CH 32CH 3NBSBr2)芳烃 芳烃卤代反应 机理+E+Eπ-络合物HEE +H +σ-络合物HX X-H ++-σ-络合物举例:Cl CH 3+CH 3CH 3CH 3CH 3CH 3ClBr ++2.羰基化合物羰基化合物的卤代反应 机理OR R'δδC COHB COBHC C OCCOCC等于C O O HCOOHC O CHCOCH1)醛、酮α-H 卤代反应R- C - CH 3OR- C - CH 2Br O2亲电取代反应酸催化 CCHC CC CC CH OH碱催化C C H OH慢C C C C举例:O 2NC-CH 3O O 2NC-CH 2BrOHBrBr 2+氯霉素的制备溴对酮的加成C CH 2CH 2CH 3H 2C OHC CHCH 2CH 33COHCH 2CH 23BrH 2C OCH 2CH 2CH 3H Br HBr-Br 2C CH 2CH 2CH 32C OCHCH 2CH 3H 3C OBr+(1.5%)(58%)酮自由基反应(饱和烃、苄位和烯丙位的卤取代反应、某些不饱和烃的卤加成反应以及羧基、重碳基的卤置换反应) a-羰基自由基取代OCC O R'H R''R'''+Br 2+CC OR'Br R''R'''光Br 22Br光O +HBrOHBr2)羧酸衍生物的a 卤代反应CH 2COOHR CH COOHR3.醇、酚、醚的卤代反应 1)醇ROHRX HX(HI ﹥HBr ﹥HCl ﹥HF 叔﹥仲﹥伯)2)酚OHClBrClPh 3PBr 23)醚O 34ICH2CH2CH2CH2I4.羧酸1)羧羟基COOHNO2PCl5或 SOCl2COCl22)羧酸脱羧RCOOAg+X R-X CO2AgX Hundriecker反应++要求绝对无水RCOOH+HgO+x2R-X为特殊卤代烷提供制备方法O2N24O2N Br5.其他官能团的卤代反应1)卤化物ClCl2FCl22)磺酸酯R-OH H3C S ClOOHR O S CH3ONaI R-I3)芳香重氮盐化合物ArN2X 22Ar-X+N2 (X=Cl,Br)二、烃化反应(一)碳原子的烃化反应1.芳烃的烃化Friedel-Crafts 烷基化反应芳烃与卤代烃、醇类或烯类化合物在Lewis催化剂(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF等)存在下,发生芳环的烷基化反应。

反应中间体——碳负离子有些有机化学反应是属于一步完成的,例如:D-A反应;碳烯的插入反应等。
但更多的是多步反应,反应过程中至少包含有一个活性中间体的生成,例如叔丁基溴的SN1取代反应生成的活性中间体碳正离子;乙炔与氨基钠液氨溶液反应生成的乙炔碳负离子;亚硝酸酯光解产生的烷氧基自由基等都是活性中问体。
活性中间体在有机化学反应过程中虽然寿命不长且较难分离,但它非常活泼,在适当的条件和方法下是可以检测其存在,有些甚至可以分离。
碳正离子是有机化学反应中常见的活性中间体,对它的生成、结构和转变的研究对某些有机反应历程的阐明是十分重要的,同时对碳止离子稳定性的研究,有助于判断反应是按何种反应历程进行,有助于推断反应所生成的主要产物。
碳正离子是有机化学反应中常见的重要活性中间体,它的生成、结构、稳定性等对某些有机化学反应历程的阐明及反应产物的预测是十分重要的。
今天我们就说一说三种活性中间体之一碳负离子,碳负离子相对碳正离子来说在有机反应中出现的较少,但涉及到醛酮等羰基化合物的许多重要反应,在合成上的应用是非常重要的。
碳负离子是带负电荷的具有偶数价电子的粒子,其负电荷(未共用电子对)定域在一个碳原子上。
甲基负离子CH3- 可看作是一切碳负离子的母体,各碳负离子可以烷基负离子来命名。
由吸电子基共轭稳定化(-R 效应)的碳负离子,由于实际的共振结构中负电荷主要分布在氧原子上,这类离子叫做碳负离子的性质。
碳负离子的产生:含碳酸的脱质子作用:有机化合物中C-H 键的电离也应当看作是酸性电离:为了同含氧酸,氢卤酸等相区别,把这种酸称为含碳酸,含碳酸的共轭碱即为碳负离子。
比如炔烃失去一个质子所得的碳负离子为sp 杂化,s 成分很大,吸引电子的能力越强,相对的碱性越弱,而共轭酸的酸性越强,容易电离出质子而成碳负离子。
醛酮α氢的电离:醛酮在羰基的影响下(诱导效应与共轭作用),α氢有一定的酸性,可以电离出稳定的碳负离子。
例如丙酮电解生成共轭碱。


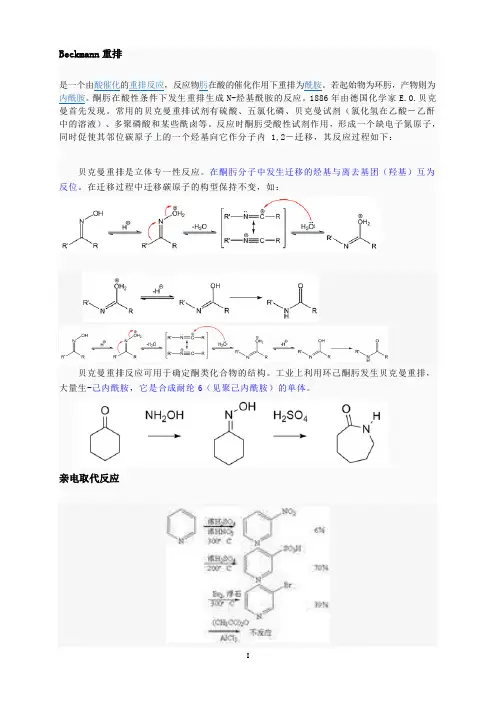
Beckmann重排是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
酮肟在酸性条件下发生重排生成N-烃基酰胺的反应。
1886年由德国化学家E.O.贝克曼首先发现。
常用的贝克曼重排试剂有硫酸、五氯化磷、贝克曼试剂(氯化氢在乙酸-乙酐中的溶液)、多聚磷酸和某些酰卤等。
反应时酮肟受酸性试剂作用,形成一个缺电子氮原子,同时促使其邻位碳原子上的一个烃基向它作分子内 1,2-迁移,其反应过程如下:贝克曼重排是立体专一性反应。
在酮肟分子中发生迁移的烃基与离去基团(羟基)互为反位。
在迁移过程中迁移碳原子的构型保持不变,如:贝克曼重排反应可用于确定酮类化合物的结构。
工业上利用环己酮肟发生贝克曼重排,大量生-己内酰胺,它是合成耐纶6(见聚己内酰胺)的单体。
亲电取代反应亲电取代反应一种亲电试剂取代其它官能团的化学反应,这种被取代的基团通常是氢,但其他基团被取代的情形也是存在的。
亲电取代是芳香族化合物的特性之一.芳香烃的亲电取代是一种向芳香环系,如苯环上引入官能团的重要方法。
其它另一种主要的亲电取代反应是脂肪族的亲电取代。
亲电加成反应亲电加成反应是烯烃的加成反应,是派电子与实际作用的结果。
派键较弱,派电子受核的束缚较小,结合较松散,因此的作为电子的来源,给别的反应物提供电子。
反应时,把它作为反应底物,与它反应的试剂应是缺电子的化合物,俗称亲电试剂。
这些物质又酸中的质子,极化的带正电的卤素。
又叫马氏加成,由马可尼科夫规则而得名:“烯烃与氢卤酸的加成,氢加在氢多的碳上”。
广义的亲电加成亲反应是由任何亲电试剂与底物发生的加成反应。
在烯烃的亲电加成反应过程中,氢正离子首先进攻双键(这一步是定速步骤),生成一个碳正离子,然后卤素负离子再进攻碳正离子生成产物。
立体化学研究发现,后续的卤素负离子的进攻是从与氢离子相反的方向发生的,也就是反式加成。
如丙烯与HBr的加成:CH-CH=CH+ HBr → CH-CHBr-CH2第一步,HBr电离生成H和Br离子,氢离子作为亲电试剂首先进攻C=C双键,形成这样的结构:第二步,由于氢已经占据了一侧的位置,溴只能从另外一边进攻。
(一)反应题的重要考点:(1)烷烃的卤代反应,反应活性:①氟氯溴碘(F2>Cl2>Br2>I2);②活泼H原子的类型3〫>2〫>1°>CH3。
注意:药大考研常考察碳正离子稳定性,也会考察环烷烃的卤代开环(2)单烯烃的主要反应:①加成反应:催化加氢(注意:顺式加成)、亲电加成(X2、HX、H2SO4、H2O、BH3)、自由基加成(药大考研常考:HBr/ROOR(唯一));②氧化烯烃的反应(常用氧化剂总结:KMnO4/OH-(OsO4,药大考研官网推荐王积套课本有此氧化剂)、KMnO4/H+、O3、过氧酸、O2/Ag);③ɑ-H卤代(自由基取代反应);④聚合反应。
中国药科大学考研辅导南药人研路提示:马氏比较常考,但是反马加成也常涉及。
(3)炔烃和二烯烃的主要反应:①加成反应(林德拉、NaNH2/NH3(l)、亲电加成、自由基加成、亲核加成,这些加成反应类似烯烃的加成);②氧化反应;③炔氢的反应(注意);④聚合(一般不会考察);⑤D-A反应(多年考研真题中出现,重点掌握);⑥周环反应(开环和关环相应的条件下的顺旋和对旋)。
中国药科大学考研辅导南药人研路提示:2019年710真题第一次出现此知识点考查,注意掌握(常考炔烃部分加氢、与H2O加成生成醛酮;D-A反应等)(4)芳烃的主要反应:①亲电取代(注意:卤代、磺化、硝化、傅克反应、氯甲基化反应);②氧化反应;③α-H卤代(自由基);④加成反应。
中国药科大学考研辅导南药人研路提示:芳环上亲电取代的定位效应在药大考研中常考察,这个主要根据环上的电子云密度来判断;还有α-H的卤代。
(5)卤代烃的主要反应:①亲核取代、AgNO3(SN1);SN2的瓦尔登转化是药大历年重点!);②消除反应(HX(扎伊采夫规则,E2反式消除【特变注意】)、X2);③与金属反应(烷基铜锂,注意位阻,是1,2加成还是1,4加成,非常重要!);④还原产物为烃,常用还原剂:LiAlH4、NaBH4、Zn+HCL,醋酸等。
基础有机化学反应总结一、烯烃1、卤化氢加成 (1)CHCH 2RHXCHCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH 2CH 33H 323H 32CH CH 2CH 32CH CH=CH (CH 3CH 2CH 2)3-H 3CH 2CH 2C22CH 3CH 2B OCH 2CH 2CH 3H 3CH 2CH 2C2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2BOC H 2CH 2CH 3CH 2CH 2CH 3H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH -CH 3HH OH3、X 2加成C CBr /CCl CC Br【机理】CC CC Br BrC Br +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
有机化学中碳链增长的反应有机化学中的碳链生长反应姓名:华英10(本1)王记伟100712024在有机化学反应的研究过程中,有机合成是一个必不可少的重要环节。
然而,碳骨架的构建是至关重要的一步。
碳链的生长是形成分子骨架的主要手段之一。
有机化学反应中有许多碳链生长反应。
不同的方法有不同的特点和适用范围。
因此,熟悉和掌握有机反应中各种碳链生长方法的机理、优缺点将有助于我们研究有机合成反应。
以下是几种常见碳链生长反应的总结。
关键词:碳链增长有机金属烃化亲核加成文本:首先,使用有机金属化合物来生长碳链哈龙可以与一些金属反应形成有机金属化合物。
有机金属化合物是指一类金属原子直接与碳原子相连的化合物。
使用有机金属化合物在有机反应中生长碳链是重要的手段之一。
1.与格氏试剂的反应“格氏试剂”是一种含卤化镁的有机金属化合物(常温下将镁废料置于无水乙醚中,滴加卤代烷烃,卤代烷烃与镁作用生成的有机镁化合物可直接用于有机合成反应,无需分离)。
它是一种亲核试剂,广泛用于有机合成。
(1)格氏试剂与醛、酮、酯和烯化氧发生亲核加成反应形成相应的醇;奥格XR’(H)RCR’’R’(H)高级驻地协调员’ ‘ R’(H)RMgXR’’H3O+如果在反应中生成仲醇,它也可以被氧化成酮,然后继续与格氏试剂反应生成叔醇。
(2)在格氏试剂和CO2的亲核加成后,通过水解可以制备多一个碳的羧酸。
具有碳链延伸的羧酸可以从卤代烃中获得,其适用于伯、仲和叔卤代烃、烯丙基和苯基卤代烃。
2.与二烃基铜锂的反应二烃基锂可以通过卤化亚铜分子与氮气和氩气在乙醚中低温反应而形成。
二烃基铜锂也是一种应用广泛的试剂。
RLi+CuX→RCu+LiX RCu+RLi→R2CuLi二烷基铜锂的烃基可以是甲基、伯烷基、仲烷基或烃基如烯丙基、苄基、乙烯基、芳基等,因此它可以被称为二烷基铜锂或有机锂试剂。
二烃基铜锂可以与卤代烃偶联,反应如下:卤代烃中的烃基可以是伯或仲烷基,或乙基烯烃、芳香烃、烯丙基和苄基。
碳正离子与碳负离子的对比李文峰 学号2013301040145 化基五班摘要:碳负离子和碳负离子都是有机化学中重要的活性中间体,但两者的形成和反应机理都不尽相同。
本文大体依据《有机化学》,结合相关文献。
对二者进行两相对比增益于化学的学习。
关键词:碳正离子 碳负离子 重排 一、碳正离子碳正离子的产生碳正离子可以认为是通过C-C 单键中一对电子的异裂形成的,式中X 代表卤素。
碳正离子中带正电荷的碳原子是sp 2 杂化,三个杂化轨道呈平面排列与其他原子或基团成键,键角约为120o ,有一个垂直于此平面的空p 轨道,这个空的P 轨道与化学性质密切相关。
B碳正离子很不稳定,需要电子来完成八隅体构型,因此任何给电子的因素都能使正电荷分散而稳定,任何吸电子的因素均能使正电荷集中而更不稳定。
故而R 的共轭效应,诱导效应和立体效应,以及烷基的超共轭效应都能对碳正离子起稳定作用。
碳正离子的稳定性烷基有给电子的诱导效应故带正电荷上的碳烷基越多,给电子的诱导效应越大,使正电荷越分散而稳定。
还有超共轭效应,也使得碳正离子更稳定。
P-π共轭也能使正电荷分散而稳定,一般是碳正离子与不饱和的烯或是芳基相连时,共轭体系越多,正碳离子越稳定。
(CH 3)3C +>(CH 3)2C +H>CH 3C +H 2>C +H 3 (CH 2=CH)3C +>(CH 2=CH)2C +H>CH 2=CHC +H 2由于碳正离子中带正电荷的碳原子是sp 2 杂化,桥头碳原子由于桥的刚性结构,不形成具有平面三角形的SP 2轨道的碳正离子,即使能形成也很不稳定。
碳正离子的反应1、与与亲核试剂结合R ++Nu —一 R —Nu2、消除邻位碳上的一个质子而形成烯烃RXR 3C+XoC +3C +2HC +H 2>>3、和烯烃加成形成更大的碳正离子4、使芳香环烷基化5、重排成为更稳定的碳正离子在有碳正离子的反应中例如S N 1中,其反应机理如下R 33C ++X _R 3C ++N u 3CNu由于碳正离子的平面结构,带正电的碳原子上有一个空的P 轨道,如果该碳原子上连接着三个不同的基团,由于亲核试剂从平面两边进攻的机会相等,因而可以得到“构型保持”和“构型翻转”两种化合物如下S N1反应中还包含了碳正离子的另一个重要的反应—重排反应如上面以给的图中,由一级碳正离子转变为三级碳正离子就是一个重排反应。
碳负离⼦在有机合成中的应⽤碳负离⼦在有机合成中的应⽤翟迈豪化基7班 2013301040201摘要:在某些有机化学反应中,经常遇到C-H键的断裂的情形,裂解出来的质⼦为反应体系中的碱或Lewis碱所接受,所留下来的+3价的碳原⼦像胺类化合物⼀样带有⼀对孤对电⼦,这就是碳负离⼦。
本⽂综述了碳负离⼦的各类反应,反应机理及其在有机合成中的应⽤,并对⼀些反应做出了必要的分析。
关键词:碳负离⼦反应有机合成应⽤⼀、碳负离⼦的形成1.碳氢酸脱质⼦作⽤2.亲核试剂对活性烯烃的加成作⽤3.活性烯烃亲核反应逆反应逆的Michael加成、逆羟醛缩合、逆的Claisen酯缩合,都是由碱引起了原来缩合反应的逆反应⽽重新⽣成反应物和碳负离⼦4.还原⾦属化作⽤烷基和芳基锂化物及格⽒试剂都象碳负离⼦那样起作⽤,在醚溶液中它们成离⼦对形式⽽存在5.溶解⾦属还原(⾃由基反应)⾦属溶解时就发⽣电⼦加成作⽤,⾸先形成负离⼦基,然后形成双负离⼦。
⼆、碳负离⼦的反应1.亲核加成反应(包括加成-消除反应)(1)羟醛缩合反应在碱的催化作⽤下,⼀分⼦带有α-氧的酸或酮失去质⼦形成碳负离⼦,与另⼀分⼦酸或酮发⽣亲核加成反应⽣成β-经基醛或酮,然后在⾼温或者强酸/碱条件下脱⽔⽽⽣成α,β-不饱和酸酮。
(2)普尔⾦(Perkin)反应由不含有α-H的芳⾹醛(如苯甲醛)在强碱弱酸盐(如碳酸钾、醋酸钾等)的催化下,与含有α-H的酸酐(如⼄酸酐、丙酸酐等)所发⽣的缩合反应,并⽣成α,β-不饱和羧酸盐,后者经酸性⽔解即可得到α,β-不饱和羧酸。
(3)脑⽂格(Knoevenagel)反应在Perkin反应的基础上进⾏了改进,把产⽣碳负离⼦的酸酐换成带有吸电⼦基的活泼亚甲基化合物,碱由羧酸盐改为有机碱(如吡啶、六氢吡啶、⼀级胺、⼆级胺等),溶剂⼀般为苯和甲苯,反应得到α,β-不饱和化合物。
弱碱的使⽤避免了醛、酮等化合物⾃⾝羟醛缩合副反应发⽣,因此优化条件后底物的范围得到极⼤的拓展,芳⾹醛,酮,脂肪醛均能够发⽣反应。