有机化学第三章
- 格式:doc
- 大小:122.00 KB
- 文档页数:6


第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。

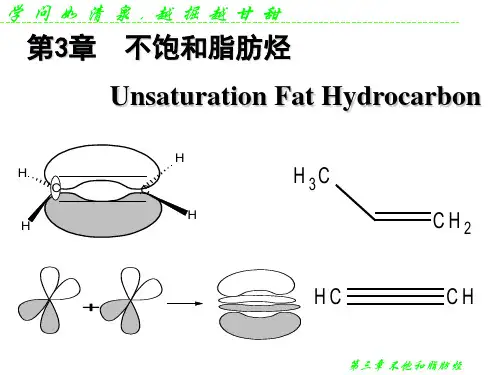




第三章 不饱和烃不饱和烃是指分子结构中含有碳碳双键或三键的烃。
不饱和烃中含有碳碳双键的叫烯烃,含有碳碳三键的称为炔烃。
含有两个或多个碳碳双键的不饱和烃称为二烯烃和多烯烃。
一个不饱和烃分子结构中同时含有碳碳双键和三键则称为烯炔。
不饱和烃的双键和三键不太牢固,容易发生亲电加成反应、取代反应及氧化反应。
烯烃是指含有碳碳双键的不饱和烃,包括链状烯烃和环状烯烃,其官能团为碳碳双键。
链状烯烃的通式为C n H 2n (n ≥2)。
相对于饱和烷烃,烯烃分子结构中每增加1个双键则减少2个氢原子。
一、烯烃的结构和异构现象 (一)烯烃的结构烯烃的结构中主要特征部分为碳碳双键,以最简单的烯烃-乙烯为例来了解双键的结构,乙烯的分子式为C 2H 4,乙烯的两个C 原子和四个氢原子均在同一个平面上,每个碳原子只和3个原子相连,为平面型分子。
碳碳双键由1个σ键和1个π键构成,而不是两个单键构成。
乙烯的平面构型如图3-1(a )所示,分子模型见图3-1(b )和3-1(c )。
CCH HH H121.7°117°0.108nm(a)乙烯的平面构型 (b)球棍模型 (c)比例模型图3-1 乙烯分子的结构拓展阅读碳原子的sp 2杂化和π键杂化轨道理论认为,乙烯分子中的碳原子在成键过程中,处于激发态的1个2s 轨道和2个2p 轨道进行杂化,形成3个能量相同的sp 2杂化轨道,称为sp 2杂化,其杂化过程可表示为:2s 2p激发sp 2杂化sp 2杂化轨道2p2s 2p基态激发态杂化态形成的3个sp 2杂化轨道中每个含有1/3的s 轨道成分和2/3的p 轨道成分,形状是一头大一头小;3个sp 2杂化轨道的对称轴分布在同一平面上,夹角为120°,呈平面三角形,每个碳原子还有一个2p z 轨道未参与杂化,其对称轴垂直于3个sp 2杂化轨道的对称轴所形成的平面,见图3-2。
由此可见,乙烯分子中碳碳双键是由1个σ键和1个π键组成的,π键是由2个p 轨道侧面重叠形成的,电子云分布于键轴上下,键能较小,同时由于π键电子云离核较远,受原子核束缚力较弱,容易被外电场极化,所以π键不稳定,比σ键容易断裂。

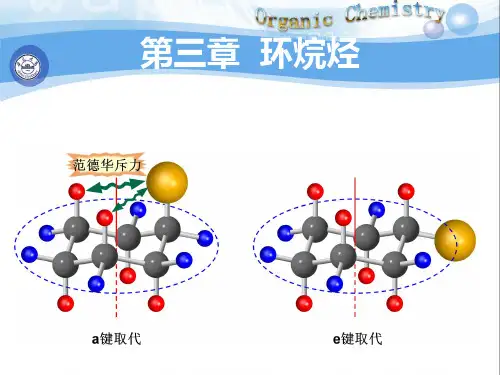
第三章环烷烃【基本要求】掌握环烷烃的通式、异构体和命名理解环烷烃的物理性质和化学性质理解环烷烃的Bayer张力掌握环己烷的构象以及取代环己烷的优势构象 熟悉其它环烷烃的构象,理解三元环的成键方式 掌握螺环烃和桥环烃的结构和命名【重点难点】环烷烃的Bayer张力与化学性质的关系环己烷的构象以及取代环己烷的优势构象三元环的成键方式❑环烷烃的通式:烷 环烷烃的通式: C n H 2n取代环烷烃的通式:C n H 2n这个化合物的分子式?❑环烷烃的异构:顺反异构体构造异构:原子的排列顺序不同产生的异构现象构象异构:化合物围绕单键在空间旋转产生的异构现象的不一样产生的异构现象 立体异构:原子或则基团在空间排列方式的不样产生的异构现象❑构型vs构象构型:原子在空间的排布方式称为化合物的构型,其中因为键的旋转而产生的异构体称为构象。
C6H12的环丁烷思考题:C6H12有哪些四元环构造异构体?同时请写出每个构造异构体可能的顺反异构体。
环烷烃的异构:C6H12的环丙烷CH3CH3CH3CH3CH3CH3CH3CH3CH3❑环烷烃的命名:烷根据环中的原子称为环某烷烃如果有取代基,则在母体环烃的名字前加上取代基的名称和位置如果有取代基则在母体环烃的名字前加上取代基的名称和位置如果有多个取代基,遵循取代基之和最小原则,优先的基团次序在后如果取代基为长碳链,则将环最为取代基,把烷烃作为母体来命名则将环最为取代基把❑环烷烃的命名:对于有顺反异构体的化合物,要在化合物的名称前加上顺反构型顺-1,4-二甲基环己烷反-1,4-二甲基环己烷烷烃的键线式键线式是一种常用的简便表达方法表示一个与之相连的❑烷烃的键线式: 顶点表示个碳,与之相连的氢常省略不写用加粗的实线表示伸向纸面前方键线式末端的点表示甲基❑命名下列化合物或者写出相应的结构:1141,1-二甲基-4-异丙基环癸烷1,2-二环丙基丁烷3-2 环烷烃的物理性质和化学性质:❑环烷烃的物理性质:与烷烃相似,环烷烃的熔点沸点随着分子量增大逐渐增加 环烷烃的熔点比相应分子量的链状烷烃高❑环烷烃的化学性质:三元环和四元环不太稳定,容易开环发生化学反应氢解(还原反应):)❑环烷烃的化学性质:加溴:三元环:开环取代反应❑环烷烃的化学性质:加溴化氢:Why?h?氧化:三元环对氧化剂比较稳定3-3 环的张力:环烃由于偏离了正常的成键角度,而像被压缩的弹簧一样,具有恢复形变的张力,这种张力即Bayer张力。
第三章
问题3-1 写出分子式为C 5H 10(戊烯)的链状单烯烃的同分异构体的构造式和键线式。
解: 构造简式 键线式
H 2C
CHCH 2CH 2CH
3
H 2C
CHCHCH 3
CH
3
H 2C CCH 2CH 3
CH 3
C C CH 2CH
3H H 3C
H
H
H CH 2CH 3
H 3C
C C
H 3CC
CHCH3
CH 3
问题3-2 试排列下列基团的优先次序:-CH=CH 2,-C(CH 3)3,-CH(CH 3)2,-C ≡CH 解:基团的优先顺序:
C
CH C(CH 3)3
CH
CH 2
CH(CH 3)2
>
>
>
问题3-3
1. 命名下列各烯烃,构造式以键线式表示之,键线式以构造式表示之。
(1)
(
CH 3)
3CCCH 2CH 3
CH 2
(2)
H C
CH 3
C 2H 5
C CH 3
(3)
(4)
2. 试判断下列化合物有无顺反异构,如果有则写出其构型和名称: 异丁烯 (2)4-甲基-3-庚烯 (3)2-己烯
解:(1) 3,3-二甲基-2-乙基-1-丁烯
(2) (Z )-3-甲基-2-戊烯
(3) 2,4-二甲基-1-己烯 CH 3
CH 3CCH 2CHCH 2CH 3H 2C
(4)
(E )-2,3-二甲基-3-己烯
CH 2CH 3
H 3C
(CH 3)2HC
H
C C
CHCH 2CH 3
HCC
)2(H 3C
2.
解:(1)无顺反异构。
H 2C
C CH 3
CH 3
(2)
CH 2CH 2CH 3
CH 3
H 3CH 2C
H
C
C CH 2CH 2CH 3
H
H 3C
H 2C C
CH 3
C (Z )-4-甲基-3-庚烯 (E )-4-甲基-3-庚烯
(3)
C
C
CH 2CH 2CH 3
H 3C H H
CH 2CH 2CH 3C
C
H 3C
H
H
(Z )-2-己烯 (E )-2-己烯 或 顺-2-己烯 或 反-2-己烯 问题3-4 为什么顺-2-丁烯的沸点比反-2-丁烯高?
解:液体沸点的高低决定于分子间作用力的大小,而分子间作用力即范德华引力包括了静电引力,诱导引力和色散力。
烯烃是弱极性或非极性分子。
引力主要由色散力所产生。
色散力是由于原子核和电子在不断运动过程中,产生一瞬间的相对位移,使分子的正电荷中心暂时不相重合,从而产生分子间的一种很弱的吸引力。
范-2-丁烯有较高的对称性,产生色散力的趋势较小,因此沸点比顺-2-丁烯低。
问题3-5 下列化合物与溴化氢起加成反应时,主要产物是什么? 异丁烯,3-甲基-1-丁烯,2,4-二甲基-2-戊烯
解:不对称烯烃与溴化氢加成,加成取向符合马氏规则:
H 2C
C CH 3
CH 3
HBr
H 3C
C CH 3
Br
CH 3
2-甲基-2-溴丙烷
H 2C
CHCHCH 3CH3
CH 3CHCHCH 3
Br CH
3 2-甲基-3-溴丁烷 H 3CC CHCHCH 3CH 3
CH 3
HBr
CH 3CCH 2CHCH 3
B CH 3CH3r
2,4-二甲基-2-溴戊烷
问题3-6 以上面几个不同的烯烃与硫酸加成反应的条件,比较不同烯烃与酸加成的相对活性。
解:乙烯,丙烯,异丁烯与硫酸加成反应,硫酸的浓度分别为98%,80%,63%,由此可见,烯烃相对反应活性是:异丁烯 > 丙烯 >乙烯.因为烯烃双键上的电子云密度越大,越有利于亲电加成反应。
异丁烯双键上有两个甲基推电子基,丙烯双键上有一个甲基推电子基,而乙烯则没有,双键上推电子基越多,其电子云密度越大,相对反应活性则越大。
问题3-7 为什么反式烯烃比顺式烯烃稳定?
解:反式烯烃分子对称性比顺式烯烃高。
双键电子云密度分布较均匀,不易极化,所以稳定。
问题3-8 有一化合物甲,分子式为C7H14,经臭氧化还原水解后得到一分子醛和一分子酮,推测化合物甲的结构。
(C 7H 14)甲 ( 1)O (2)Zn/H 2O
CH 3
C O
H
+
CH 3
CH C O CH 3
CH 3
解:根据臭氧氧化还原水解产物,可以回推烯烃的双键结构。
醛或酮的结构式 H 3C
C O
H
O C CH 3CH CH 3
CH
3
双键结构
CH 3
CH 3
CH 3
CH C H
C H 3C
甲(C 7H 14)的构造式
H 3CHC
CHCH 3
CH 3CH 3
问题3-9 试写出1-丁烯高温氯化反应历程。
解:
H 2C
CHCH 2CH 3
Cl 2
温
H 2C
CHCHCH 3Cl
1- 丁烯高温氯代反应为自由基取代反应,其反应历程如下: (1) 链引发: Cl Cl 2Cl
(2) 链传递:
Cl + H 2C
CHCH 2CH 3
HCl + H 2C
CHCHCH 3
H 2C
CHCHCH 3
+ Cl 2
H 2C
CHCHCH 3
Cl
+ Cl
······
(3) 链终止:
Cl + Cl Cl Cl H 2C
CHCHCH 3
+
Cl
H 2C
CHCHCH 3Cl
2H 2C CHCHCH 3
H 2C
CH 3CH3
CHCH
CHCH
CH 2
·······
问题3-10 下列原子或基团按照-I 效应的相对强度由大至小排序,并试总结规律。
(1)卤族元素;(2)-OR 、-NR2、-F ;(3)-SH 、-OH 、-CH3、-CH=CH2 解:(1)卤族元素-I 效应的强度:—F>-Cl>-Br>-I
周期表中同一主族元素从上至下,原子半径增大,原子核对核外电子的吸引力减弱,-I 效应的强度减弱。
(2)-I 效应强度:-F > -OR > -NR 2
周期表中同一周期元素从左到右,原子半径减小,原子核对核外电子的吸引力增大,-I 效应的强度增加。
(3)-I 效应强度:-OH > -SH >
CH
CH 2
>
CH 3
由于电负性越大,-I 效应越强,电负性: O>S>Csp2>Csp3 问题3-11 为什么H +与烯烃双键加成不能生成环状正离子? 解:因为氢原子半径很小,若形成环状正离子,则因轨道重叠度小,环张力较大而不稳定,破坏形成碳正离子。