课题2_原子的结构(2)
- 格式:ppt
- 大小:838.00 KB
- 文档页数:23



课题二原子的结构(2)【知识要点】1.元素(组成物质的基本成分)的化学性质与原子结构的关系(1)稀有气体的原子最外层电子数为8个(氦为2个),它们的化学性质比较稳定。
一般认为最外层电子数为个的结构为稳定结构(只有一个电子层的则为2个)。
(2)金属的原子最外层电子数一般少于个,在化学反应中易最外层电子,使次外层变成最外层,通常达到8个电子的稳定结构。
(3)非金属的原子最外层电子数一般个,在化学反应中易电子,使最外层达到8个电子的稳定结构。
(4)一般情况下,原子的最外层电子数相同,其化学性质相似。
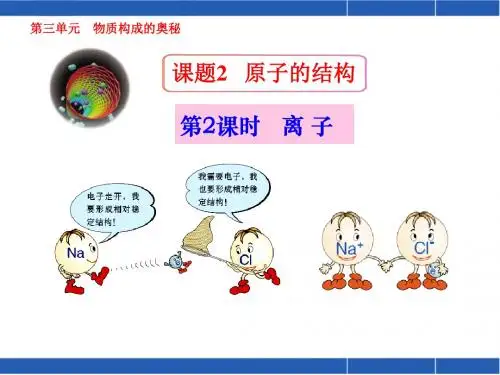
2.离子(1)带电的原子或原子团叫离子。
带电的离子叫阳离子,如Na+ 、NH+ ,带电的离子叫阴离子,如Cl-、CO32-。
(2)原子与离子的比较异:①原子一般(填“稳定”或“不稳定”),而离子比较。
②原子不显电性,而离子。
③表示方法不同,如钠原子表示为,钠离子表示为。
同:都是构成物质的粒子;质量、体积都很;在不停;有间隙。
(3)构成物质的粒子有、和。
3.相对原子质量。
(1)定义:以一种碳原子原子质量的为标准,其他原子的质量跟它相比较所得到的比值。
(2)计算公式:某原子的相对原子质量(Ar)=。
(3)原子的质量主要集中在原子核上。
相对原子质量≈+。
(4)相对原子质量是一个比值,其单位为“1”,而质量单位是“千克”。
【要点分析】例1 某粒子的结构示意图如下.下列对该粒子的判断中,错误的是()A. 原子核内有17个质子B. 该粒子是原子C. 在化学反应中易失去电子D. 该粒子属于非金属原子解析圆圈中数字17代表质子数,A选项正确;示意图中质子数与核外电子数相等,表示是原子结构,B选项正确;由于最外层有7个电子,所以容易得到电子,属于非金属原子,故C选项错误,D选项正确。
答案 C例2下列粒子结构示意图能表示原子的是_________;表示阳离子的是_________;表示阴离子的是_________。
解析 原子结构示意图中,弧线表示电子层,弧线上面的数字表示该层的电子数;当质子数=核外电子数时,为原子的结构示意图;质子数>核外电子数时,是阳离子的结构示意图;质子数<核外电子数时,是阴离子结构示意图。

课题2原子的结构(二)核外电子的排布教学设计木子店中学汪龙阶教学目标1.知识与技能(1)初步了解原子核外电子是分层排布的;并初步了解核外电子的排布规律;(2)了解原子结构的表示方法——原子结构示意图的含义,能画出原子序数从1——18的原子结构示意图;(3)了解原子结构与元素化学性质的关系;2.过程与方法(1)通过学生间相互讨论、交流,增强学生归纳知识、获取知识的能力;(2)运用多媒体动画片、课文插图等辅助手段,演示离子的形成过程,化抽象为直观,增强学习的效果。
3.情感、态度与付值观(1)初步体会物质构成的奥秘,培养学生的抽象思维能力、想像力和分析推理能力;(2)树立“结构决定性质”、“物质的粒子性”等辩证唯物主义观点。
教学重点难点重点:原子结构示意图。
难点:核外电子排布的规律。
教学手段:课件课时安排:1课时教学过程教与学互动设计一、创设情境,导入新课[复习]原子的结构[体验]看核外电子运动二、核外电子的排布活动1:[归纳]多电子的原子,电子在核外绕核分层运动——叫做分层排布。
[提示]核外电子运动经常出现的区域叫电子层。
[设问]核外所有电子是杏会不会相互改变运动区域?[点拨]核外电子就像人一样,小时候完全靠父母,随着年龄,对父母的依赖程度小。
那么电子由于能量各不同,所以其运动的区域离核有远有近。
[提示]能量低,离核近,能量高,离核远。
[提示]1.原子核外电子层最少的有1层,最多的有7层。
2.离核最近、能量最低的一层叫第一层,从内向外,依次为第二层,第三层.....离核最远,能量最高的电子层叫最外层,从外向内,依次为次外层,倒数第三层。
[说明]不同原子电子层结构不同。
[小结]电子层:一二三四五六七能量:低……→高离核:近……→远活动2:[动手]绘制原子结构示意图;[互动]原子结构示意图的含义理解。
[互动]告知同学原子序数(即核内质子数)1——20的原子,并记忆;【传授】原子核外电子排布的初步规律;[训练]画出原子序数28、38两原子结构示意图,举手查阅。

课题2:原子的结构(第二课时)【学习目标】1、知道原子核外电子排布的规律。
2、了解原子最外层电子数与元素性质的关系。
【重点】核外电子的排布。
【难点】原子结构示意图。
【教学方法】自主参与合作探究展示交流【教学过程】一、预习自学探究新知认真阅读课本54页1-3自然段。
观察图3-10和3-11,3分钟后完成下列问题:问题一:原子中核外电子运动有的特点?电子在原子中核外的空间里作高速。
问题二:原子中核外电子排布有的特点?排布,由里向外分别为一、二、三……七层。
问题三:怎样表示原子的结构?原子结构示意图中各部分表示什么意义?怎样画原子的结构图?二、小组合作相互研讨观察课本第54页图3-12,4分钟后,完成下列问题:问题四:核外电子排布有什么规律?①原子的第一层最多排个电子,第二层最多排个电子,最外层电子数最多不超过个(只有1层的不超过个)。
②核外电子总是先排在能量较低的电子层,排满第层个电子,再排第二层,排满第二层个电子,再排第层.(先排层,后排层)问题五:各类元素最外层电子数有什么特点?结论:原子决定元素的化学性质三、交流展示巩固知识四、反馈测评强化知识(1)、用原子结构示意图表示:1、比镁原子少1个质子的原子;2、原子核只有1个质子的原子;3、核电荷数为18的原子;(2)、某元素原子的核外电子排布为:第二层电子数是第一层与第三层电子数之和的2倍,则该元素是什么元素?(3)具有下列核电荷数的原子中,化学性质最稳定的是()A、11B、7C、18D、14五、归纳总结知识拓展本节课学到的知识主要有哪些?知识间存在哪些联系?六、作业布置:第57页第1题。

课题2原子的结构(二)核外电子的排布教学设计木子店中学汪龙阶教学目标1.知识与技能(1)初步了解原子核外电子是分层排布的;并初步了解核外电子的排布规律;(2)了解原子结构的表示方法——原子结构示意图的含义,能画出原子序数从1——18的原子结构示意图;(3)了解原子结构与元素化学性质的关系;2.过程与方法(1)通过学生间相互讨论、交流,增强学生归纳知识、获取知识的能力;(2)运用多媒体动画片、课文插图等辅助手段,演示离子的形成过程,化抽象为直观,增强学习的效果。
3.情感、态度与付值观(1)初步体会物质构成的奥秘,培养学生的抽象思维能力、想像力和分析推理能力;(2)树立“结构决定性质”、“物质的粒子性”等辩证唯物主义观点。
教学重点难点重点:原子结构示意图。
难点:核外电子排布的规律。
教学手段:课件课时安排:1课时教学过程教与学互动设计一、创设情境,导入新课[复习]原子的结构[体验]看核外电子运动二、核外电子的排布活动1:[归纳]多电子的原子,电子在核外绕核分层运动——叫做分层排布。
[提示]核外电子运动经常出现的区域叫电子层。
[设问]核外所有电子是杏会不会相互改变运动区域?[点拨]核外电子就像人一样,小时候完全靠父母,随着年龄,对父母的依赖程度小。
那么电子由于能量各不同,所以其运动的区域离核有远有近。
[提示]能量低,离核近,能量高,离核远。
[提示]1.原子核外电子层最少的有1层,最多的有7层。
2.离核最近、能量最低的一层叫第一层,从内向外,依次为第二层,第三层.....离核最远,能量最高的电子层叫最外层,从外向内,依次为次外层,倒数第三层。
[说明]不同原子电子层结构不同。
[小结]电子层:一二三四五六七能量:低……→高离核:近……→远活动2:[动手]绘制原子结构示意图;[互动]原子结构示意图的含义理解。
[互动]告知同学原子序数(即核内质子数)1——20的原子,并记忆;【传授】原子核外电子排布的初步规律;[训练]画出原子序数28、38两原子结构示意图,举手查阅。


课题2 原子的结构一、教学背景和地位:第三单元教材是"双基"的重要组成部分,本单元教材对于学生十分重要,它既是今后学习的理论基础,又是必不可少的化学学习工具,是初中能否学好化学的第一道"分水岭"。
通过本节课的学习,可为学生从微观的角度探究宏观物质变化的奥秘打开一扇窗口;使学生对物质的微观构成有一个大体轮廓。
二、教学课题物质构成的奥秘是初中化学的重要内容之一,原子的构成又是学生对微观世界的第二次接触。
本课题主要是在学生学习分子、原子的概念的基础上深入探究离子的形成及介绍相对原子质量。
为了对学生进行爱国主义教育,介绍为相对原子质量的测定做出卓越贡献的我国科学院院士X青莲教授。
三、教学设计思路原子核外电子的排布,特别是离子的知识,是为了进一步学习化合价和化学式打基础,特别是构成物质的粒子在前面我们学习的有分子、原子,在此基础上我通过原子结构的稳定性引出离子,从而引出构成物质的粒子还有离子。
我在教学中根据新课程标准,采取多种教学手段,课件、白板、视频动画等。
教学程序上采取老师提问--小组讨论--表达交流--老师和学生共同总结,最后通过测试反馈来完成教学。
处在网络时代的学生大多数很喜欢上网,于是我就投其所好,利用多媒体课件演示动画,模拟微观变化,帮助学生认识离子的形成过程和学会离子的符号表示。
这样不但能顺利突破本节课的难点,也促进了学生微观思维能力的发展。
四、教学目标【知识与技能】1、知道原子核外电子的分层排布规律,能画出1-18号元素的原子结构示意图。
2、以氯化钠为例,了解离子的形成的过程。
知道里是构成物质的一种粒子。
3、知道相对原子质量的含义,并学会查相对原子质量表。
【过程与方法】1、了解化学在宏观物质与微观粒子之间建立联系的途径和特点。
2、体验“发现问题(矛盾)——实验现象分析——建立模型——解释现象”过程,初步应用有现象到本质、宏观与微观相结合的思维方法。
【情感态度与价值观】1、逐渐树立世界是物质的、物质是可分的这一辩证唯物主义观点。