传质过程
- 格式:doc
- 大小:282.00 KB
- 文档页数:10
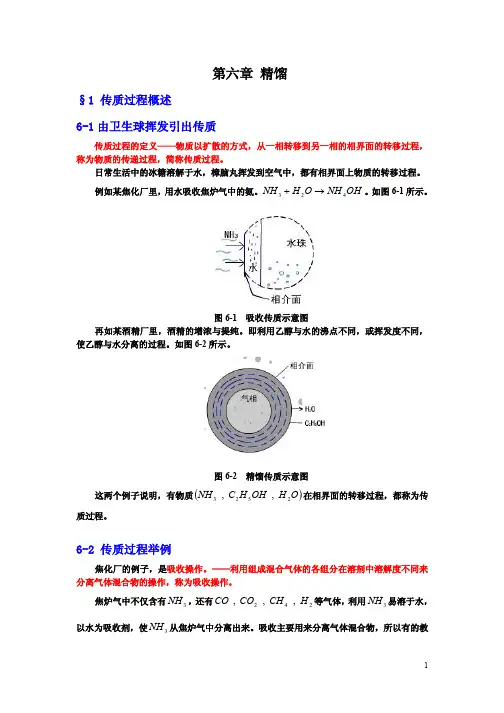
第六章 精馏§1 传质过程概述 6-1由卫生球挥发引出传质传质过程的定义——物质以扩散的方式,从一相转移到另一相的相界面的转移过程,称为物质的传递过程,简称传质过程。
日常生活中的冰糖溶解于水,樟脑丸挥发到空气中,都有相界面上物质的转移过程。
例如某焦化厂里,用水吸收焦炉气中的氨。
OH NH O H NH 423®+。
如图6-1所示。
图6-1 吸收传质示意图再如某酒精厂里,酒精的增浓与提纯。
即利用乙醇与水的沸点不同,或挥发度不同,使乙醇与水分离的过程。
如图6-2所示。
图6-2 精馏传质示意图这两个例子说明,有物质()O H OH H C NH 2523 , , 在相界面的转移过程,都称为传质过程。
6-2 传质过程举例焦化厂的例子,是吸收操作。
——利用组成混合气体的各组分在溶剂中溶解度不同来分离气体混合物的操作,称为吸收操作。
焦炉气中不仅含有3NH ,还有242 , , , H CH CO CO 等气体,利用3NH 易溶于水,以水为吸收剂,使3NH 从焦炉气中分离出来。
吸收主要用来分离气体混合物,所以有的教NH称为溶质,炉气中其他气体称为材称吸收为气体吸收。
如图6-3所示。
水称为溶剂,3(HCl,制备盐酸,也是一种吸收操作。
惰性组分。
用水吸收氯化氢气体)图6-3吸收塔局部示意图酒精厂的例子,是精馏操作。
——利用液体混合物各组分沸点(或挥发度)的不同,将物质多次部分汽化与部分冷凝,从而使液体混合物分离与提纯的过程,称为精馏操作。
精馏主要用来分离液体混合物,所以有的教材称精馏为液体精馏。
传质过程还有,萃取——利用混合物各组分对某溶剂具有不同的溶解度,从而使混合物各组分得到分离与提纯的操作过程。
例如用醋酸乙酯萃取醋酸水溶液中的醋酸。
如图6-4所示。
此例中醋酸乙酯称为萃取剂(A,水称为稀释剂)(B。
萃取操作能够进行的必要条件是:溶质在萃(S,醋酸称为溶质))取剂中有较大的溶解度,萃取剂与稀释剂要有密度差。

第一章:1,平衡分离:根据两相状态不同 , 传统平衡分离过程可分为如下几类:汽液传质过程 : 如液体的蒸馏和精馏。
液液传质过程 : 如萃取。
气液传质过程 : 如吸收、气体的增湿和减湿。
液固传质过程 : 如结晶、浸取、吸附、离子交换、色层分离、区域熔炼等。
气固传质过程 : 如固体干燥、吸附等。
,2,速率分离:膜分离、场分离在某种推动力(浓度差、压力差、温度差、电位差等)的作用下,有时在选择性膜的配合下,利用各组分扩散速率的差异实现组分的分离。
膜分离又包括超滤、反渗透、渗析、电渗析等。
速率分离过程特点:节能 环保第二章: 相平衡准则(条件):相平衡关系的表示方法1 相图2 相平衡常数K3 分离因子即相对挥发度相平衡常数的计算方法:一、状态方程:范德华方程 1维里方程 2 RK 方程 3 SRK 方程 4 PR 方程 5 BWRS 方程6 列线图法 3 4对RK 的修正,精度显著改善,简单方便,但对H 2 H 2S 等物系精度差;5 特别适用于H 2 H 2S 等气体混合物;6 轻烃类组分,仅考虑T P 对K 的影响,忽略了组成。
二、活度系数法:1 Vanlaar(范拉尔)方程、2 Margules(玛古斯)方程、3 Wilson(威尔逊)方程、4 NRTL(有轨双液)方程、5 UNIQUAC(通用拟化学活度系数)方程、S-H 方程1 2 数学表达式简单,容易从活度系数数据估计参数;适应性强,对于非理想性强的物系,包括部分互溶物系结果计算结果也能很满意。
多元物系需要多元的相互作用参数,如果没有,不能用于多元物系计算;都没有考虑T 、P 对模型的影响3 不能直接应用于液液平衡,但修正的T-K- Wilson 可以。
4 能很好地表示二元和多元系统的气液和液液平衡;特别对于含水系统,模型效果好;模型参数多,对每个二元物系都有三个参数。
5 所有表达式中,最复杂的;特别适用于分子大小相差悬殊的混合物。
气液平衡常数的各种简化:(1)汽相为理想气体,液相为理想溶液 适用物系:P<200kPa ,分子结构十分相近的组分溶液可按此类物系处理,如苯-甲苯二元混合物。









强化传质过程的途径强化传质过程是指增加物质传质速率和效果的方法。
传质过程一般包括传递物质的扩散、对流和反应。
强化传质过程的途径有以下几种:1. 提高溶质浓度梯度:溶质浓度差是影响传质速率的重要因素。
通过增加浓度差可以提高传质速率。
一种常用的方法是采用逆浓差传质操作,即在传质物质的两侧维持不同的浓度。
2. 增加相接触面积:相接触面积也是影响传质速率的重要因素。
增加相接触面积可以提高传质速率。
常见的方法是采用多孔介质、增加界面的不规则度和利用气泡或液滴等作为传质增强体。
3. 改变传质物质的物理性质:改变物质的物理性质可以影响传质速率。
例如,增加溶解度或降低粘度可以提高传质速率。
通过物理性质的改变,可以使传质过程更加有效。
4. 使用电场效应:电场可以改变物质的电荷分布,从而影响传质过程。
例如,电渗流传质可以通过施加电场来提高传质速率。
此外,电渗效应还可以改变传质体系的温度和浓度分布,从而进一步增强传质过程。
5. 增加传质过程的温度:传质过程的温度也是一个重要的影响因素。
提高传质过程的温度可以增加物质的扩散速率。
此外,温度的变化还可以影响传质体系的相平衡,从而进一步影响传质速率。
6. 使用化学反应增强传质:化学反应可以改变传质过程的速率和平衡。
通过引入化学反应,可以在传质体系中产生增强传质效应。
7. 引入辅助传质设备:使用辅助设备如搅拌器、超声波、微波、旋流器、膜分离等可以增加传质过程的强度。
这些设备可以增加传质物质的运动和混合程度,提高传质速率。
8. 优化传质设备的结构和布局:传质设备的结构和布局也会影响传质效果。
通过合理的结构和布局设计,可以优化传质过程,并提高传质速率和效果。
总结:强化传质过程的途径包括提高溶质浓度梯度、增加相接触面积、改变传质物质的物理性质、使用电场效应、增加传质过程的温度、使用化学反应增强传质、引入辅助传质设备以及优化传质设备的结构和布局。
这些方法可以单独或组合应用,以达到强化传质过程的目的。
气液传质过程气液传质是指气体和液体之间的物质传递过程。
在自然界和工业生产中,气体和液体之间经常发生物质传递,如氧气在水中的溶解、气体污染物在大气和水体之间的转化等。
了解气液传质过程对于环境保护和工业生产具有重要意义。
气液传质过程可以通过扩散、对流和反应来实现。
扩散是指物质由高浓度区向低浓度区的自发传递。
在气液传质过程中,气体和液体之间的浓度差是驱动扩散的主要因素。
当气体和液体的浓度差越大,扩散速率越快。
而对流是指物质通过流体的对流传递。
在气液传质过程中,对流可以通过气体和液体之间的流动来实现。
对流可以加快物质传递速率,但也会增加能量消耗。
反应是指气体和液体之间发生化学反应,产生新的物质。
反应可以改变气液传质过程的速率和方向。
气液传质过程的速率受到多种因素的影响。
首先是气体和液体之间的接触面积。
接触面积越大,传质过程的速率越快。
因此,增加气体和液体之间的接触面积可以提高传质速率。
其次是气体和液体之间的物质传递距离。
物质传递距离越短,传质过程的速率越快。
因此,减小气液传质过程的传递距离可以提高传质速率。
此外,温度、压力、浓度差等因素也会影响气液传质过程的速率。
在工业生产中,气液传质过程被广泛应用于化学工程、环境工程等领域。
例如,在化学反应中,气体通常需要与液体反应,而气液传质过程可以促进反应物的扩散和反应产物的分离。
在环境工程中,气液传质过程可以用于废气净化和水体污染控制。
通过将废气和液体接触,废气中的有害物质可以被吸附或溶解到液体中,从而实现废气的净化。
类似地,通过将污染水体和气体接触,污染水体中的有害物质可以被气体吸附或气泡带走,从而实现水体的污染控制。
气液传质过程是气体和液体之间物质传递的重要过程。
了解气液传质过程对于环境保护和工业生产具有重要意义。
通过调控气液接触面积、传递距离和其他相关因素,可以提高气液传质过程的速率,实现更高效的物质传递。
长沙学院教案(课时备课)
授课日期2007年10月10日第15次课 2 学时
第四章传质过程
§1传质分离过程概述
传质过程
在含有两个或两个以上组分的混合体系中,由于存在浓度差,某一或某些组分由高浓度区向低浓度区的传递过程,称为传质过程。
传质过程可以在一相中进行,也可以在两相间进行,两相间的传质是分离过程的基础。
1-1分离操作在化工生产中的作用
1.作用:分离设备费用和分离操作费用占总生产费的比例很大。
2.分类:
①机械分离:过滤、沉降
②传质分离:
两相间:利用混合物中各组分在两相中的溶解度或挥发性等物理性质的差异,使某一或某些组分在相间转移(如吸收、精馏、萃取)。
一相中:热扩散、膜分离。
1-2化工生产中常见的传质操作
1.蒸馏:分离液体混合物,利用各组分挥发性的差异
2.吸收与解吸:分离气体混合物,利用气体溶解度的差异
3.液-液萃取:分离液体混合物,利用各组分溶解度的差异
4.吸附:分离气体或液体混合物,利用各组分在固体上吸附程度的差异5.干燥:固、气分离
6.膜分离:分离气体或液体混合物
7.热扩散:由于温度梯度而引起的物质扩散。
§2 传 质 过 程 机 理
传质过程:
①扩散物质从一相主体向界面传递
②扩散物质在界面上从一相进入另一相
③扩散物质从界面向另一相传递
2-1单相中的传质
一.分子扩散与菲克定律
1.分子扩散
在一相内有浓度差异存在时,由于分子的热运动,而造成的物质传递现象。
分子扩散速率(通量)A,0N :单位时间内通过单位截面积而扩散的物质量。
2.费克(Fick )定律(只适用于双组分混合物) =-A A,0AB dc N D dl
(因A dc dl 为负值,加“-”使A,0N 为正) A,0N ——组分A 的分子扩散速率,)/(2s m kmol ⋅;
A dc dl
——组分A 在扩散方向的浓度梯度,4/m kmol ; AB D ——组分A 在组分B 中的分子扩散系数,s m /2。
AB D 的值由试验测定,可通过手册查取,见教材P183表5-2,5-3。
对理想气体混合物,由于RT p c A A
=,故有=-AB A A,0D dp N RT dl。
二、等物质的量反向定常态扩散
(等摩尔反向扩散)
1、概念:
如右图,两容器内,
A,1A,2c c >,B,1B,2c <c ,但T ,P 相同,两容器内
装有搅拌器,使容器内浓度处处相等,由于有浓差存在,故A 向右,B 向左扩散,容器大而连通管细,故认为1、2处A 、B 分压不变,故其中分子扩散是稳定的。
因为容器内总压相等,故A 分子向右和B 分子向左的扩散速度相等,为等物质的量反向扩散。
又 A A,0AB dc N D dl =-,B B,0BA dc N D dl
=- 而 A,0B,0N N =-
在压力不太高时,A A A n p c V RT ==,B B B n p c V RT
== M A B c c c =+=常量
∴ B M A A dc d(c c )dc =-=-
∴ AB BA D D D ==(对A 、B 两组分性质相似的液相也成立)
∴ A A,0B,0dc N N D dl
=-=- 如精馏操作属等物质的量反向扩散。
2、传质速率A N
①概念
在一固定的空间位置上,单位时间内通过单位面积传递的A 物质量。
②表达式:在单纯的定常态等物质的量反向扩散中:
A A A,0dc N N D dl
==- 定态扩散,A N 为定值,如
图,l 0=时,A A,1c c =,l l =时,
A A,2c c =,在1、2两截面间积分得:,,()A A 1A 2D N c c l
=- 当扩散的为理想气体时,,,()A A 1A 2D N p p RTl =
- 定常态传质过程,一定操作条件下,A N 、D 、R 、T 为定值,所以浓度分布为直线。
[例4-1]见教材P114。
三、单方向扩散(一组分通过另一停滞组分的扩散)
令A 、B 两组分混合气体与液相接触,
设相界面上只允许A 通过,操作条件下液相
不气化,此即为A 组分的单方向扩散过程
如图,单组分吸收过程即属此类。
在相界面上,由于A 的溶解,使得
A,i A p p <,所以组分A 从气相主体向相界面
扩散,同时,界面上气体总压略低于气相主体中的气体总压,将有A 、B 混合气体从气相主体向界面移动(称为整体流动或总体流动)。
对B 组分来说,B 在界面不溶解,而且
还随总体流动从气相主体向界面移动,使
得B B,i p <p ,所以组分B 会从相界面向气相
主体扩散。
在定常态扩散时,组分B 从相
界面向气相主体扩散的量与总体流动中从
气相主体向界面扩散的量相等,即B N 0=,
表观上没有B 的传递。
对A 组分来说,其扩散方向与气体总
体流动的方向相同。
由于 A,M
A B,M B
N p N p = ∴ A A,M B,M B
p N N p = A A A,0A,M A,0B,M
B p N N N N N p =+=+ 而 B,M B,0A,0N N N =-=(∵A B p p p +==常量,或A B c c c +==常量) ∴ ,()()()A A A A A A 0B B A p p dp dp D D p N N 11+p RT p dl RT p p dl
=+=-=-- 定态吸收、一定操作条件下,A N 、D 、R 、T 为定值,将上式分离变量积分得:,ln A i A A
p p Dp N RTl p p -=- 又 ,,A B A i B i p p p p p =+=+
∴ ,,,,ln ()A A i B i A A A i B,i B B B m
p p p Dp D p N p p RTl p p p RTl p -==-- 其中,,,,ln B i B B m B i B
p p p p p -= 与等摩尔反向扩散比较,多了,B m p
p 一项,称,B m p p 为漂流因子。
∵ ,B m p p >,所以同条件下,单方向扩散的A N 比等物质的量反向定常态扩散的大。
原因:出现了与扩散方向一致的总体流动。
[例4-2]见教材P118。
液相中的扩散速度远小于气体,一般为单方向扩散过程。
四.扩散系数D
1.影响因素
D 随介质种类、温度、压强及浓度和不同而变化,气相中,C 的影响可忽略,液相中,P 的影响可忽略。
(g l D D >)
2、D 值的确定
①由实验测定,或查手册(P120,表4-1,4-2)
②由某些经验、半经验公式估算 ③对气体体系:.175000p T D D p T ⎛⎫⎛⎫= ⎪ ⎪⎝⎭⎝⎭
[例4-3]见教材P121,[例4-4]见教材P122。
五.对流扩散
1.涡流扩散
湍流流体中,凭借流体质点的湍动和旋涡来传递物质的现象,称涡流扩散。
2.对流扩散
湍流流体与两相界面之间的分子扩散与涡流扩散两种传质作用的总称。
如右图所示湿壁塔内,吸收剂自上而下流动,混合气体自下而上流过液体表面,两者逆流流动;在湍流主体中,物质传递主要靠涡流扩散,分子扩散占的比例很小;在层流底层内,只有分子扩散;过渡层内,既有分子扩散,又有涡流扩散。
有效滞流膜层模型:
认为由气相主体到界面的
对流扩散过程相当于一个通过
有效滞流膜层的分子扩散过程。
故可按分子扩散过程写出
对流扩散的速率方程:
故在气相侧:
,,()A A A i G B m
D p N p p RTl p =- 液相侧:,()M A A,i A L B m c D N c c l c =
-
A N ——对流传质通量,-21mol m s -⋅⋅;
G l 、L l ——有效膜厚度,m ;
A p 、A c ——主体浓度;A,i p 、A,i c ——界面浓度;
,A A i p p -(A,i A c c -)——扩散过程的推动力。
令 ,G G B m D p k RTl p =, ,M L L B m
c D k l c = 则有A G A A i N k p p =,(-),()A L A,i A N k c c =-
G k ——气膜传质分系数,211mol m s Pa ---⋅⋅⋅
L k ——液膜传质分系数,1m s -⋅
2-2相际间传质
一、双膜理论的基本论点
1.相互接触的气、液两相界存在稳定的相界面,界面两侧各有—有效滞流膜
层,溶质以分子扩散的方式通过此两膜层。
2.在相界面上,气、液两相互成平衡
3.在膜层以外的气液两相主体内,由于流体充分湍动不存在浓度差。
即全部浓度变化都集中在两滞流膜内,故传质阻力也集中在气、液两滞流膜中。
所以双膜理论又称双阻力模型:传质总阻力=气膜阻力+液膜阻力。
三.双膜理论的成功与不足
1.成功
简化了复杂的相际传质过程,
对生产实际有指导意义,对具固定相界面的体系确定符合。
2.不足:对不具稳定相界面(如高度湍流)的体系不适合。
作业:P126:T1,T2。