电池电路工作原理
- 格式:pdf
- 大小:203.04 KB
- 文档页数:5

电池的工作原理及应用电池是一种将化学能转化为电能的装置,现在已经广泛应用于日常生活和各个领域。
本文将介绍电池的工作原理以及它在不同领域的应用。
一、电池的工作原理电池是由正极、负极和电解质组成的装置。
正极和负极之间通过电解质相连,形成了回路。
当正极和负极之间的回路被外部电路连接时,电池就开始工作了。
电池的工作原理是通过化学反应来产生电能。
正极和负极之间的化学反应会产生电荷,从而产生电势差。
正极的化学反应会释放出电子,而负极的化学反应则吸收电子。
当两极之间建立了电势差后,电子就会从负极流向正极,形成了电流。
二、电池的应用领域1. 电子产品电池在电子产品中得到了广泛的应用,如手机、平板电脑、手表等。
这些产品通常使用锂离子电池,因为它具有高能量密度、长寿命和轻量化等优点。
2. 交通工具随着环保意识的提高,电动交通工具逐渐普及。
电动汽车和电动自行车等交通工具使用电池作为能源,不仅减少了对化石燃料的依赖,还减少了尾气排放,对环境更加友好。
3. 家庭应用电池在家庭生活中的应用十分广泛。
常见的应用包括手电筒、遥控器、闹钟等。
此外,太阳能电池板也被用于家庭光伏发电系统,将太阳能转化为电能供家庭使用。
4. 医疗器械电池在医疗器械中起到了至关重要的作用。
例如,心脏起搏器和听觉设备等依赖电池提供稳定的电能,确保这些医疗设备的正常运行。
5. 军事领域电池在军事领域也有广泛的应用。
军用通信设备、便携雷达等依赖电池提供电能。
电池作为可靠的能源源泉,能够在恶劣的环境条件下工作。
三、电池的进一步发展随着科技的不断发展,电池的技术也在不断创新。
研究人员正在开发更高能量密度的电池,以提供更长的使用时间和更高的性能。
此外,可充电电池和太阳能电池等新技术也在推动电池领域的发展。
总结:电池基于化学反应的工作原理,将化学能转化为电能。
在电子产品、交通工具、家庭应用、医疗器械和军事领域等方面都有广泛的应用。
随着技术的进步,电池的性能将不断提高,为各个领域带来更多的便利和创新。

充放电电路工作原理
充放电电路是指用于控制电池充电和放电过程的电路。
其工作
原理涉及到电流流动、电压变化以及电池内部化学反应等多个方面。
首先,让我们从充电电路的工作原理开始。
当电池需要充电时,充电电路会提供一个恒定的电流或电压来驱动电池进行化学反应,
将电能转化为化学能存储起来。
在恒定电流充电中,充电电路会保
持一个恒定的电流值,直到电池达到设定的充电容量为止。
而在恒
定电压充电中,充电电路会保持一个恒定的电压值,直到电池充满
为止。
充电电路还会监测电池的电压和温度,以确保充电过程安全
可靠。
接下来是放电电路的工作原理。
当需要从电池中提取电能时,
放电电路会控制电流的流动,使电池内部的化学能转化为电能输出。
放电电路会根据需要提供不同的电流输出,以满足设备的功率需求。
放电电路还会监测电池的电压和电流,以确保放电过程稳定可靠。
总的来说,充放电电路的工作原理涉及到控制电流、电压以及
监测电池状态等方面,以确保电池充放电过程的安全和高效进行。
这些原理在各种电子设备和电动车辆中得到广泛应用,是保障电池性能和安全的重要组成部分。

电池的工作原理和分类电池是一种将化学能转化为电能的装置,广泛应用于日常生活和工业生产中。
电池的工作原理是通过化学反应产生电子流,从而实现电能的转换和储存。
根据不同的工作原理和化学成分,电池可以分为多种不同类型,每种类型的电池都有其特定的用途和优缺点。
一、工作原理电池的工作原理基本上都是利用化学反应来产生电子流,从而产生电能。
在电池中,通常会有两种电极,即正极和负极,它们之间通过电解质相连。
正极和负极之间的化学反应会释放出电子,这些电子会通过外部电路流动,从而产生电流。
当电池中的化学反应达到一定程度后,电池就会失去电能,需要进行充电或更换电池。
二、分类根据电池的工作原理和化学成分的不同,电池可以分为以下几种主要类型:1. 原电池:原电池是最常见的一种电池类型,它利用金属和非金属之间的化学反应来产生电能。
原电池通常包括干电池和碱性电池两种。
干电池是一种一次性电池,无法充电,适用于一次性使用的设备。
碱性电池则是一种可以充电的电池,适用于需要反复充电使用的设备。
2. 锂电池:锂电池是一种利用锂金属或锂化合物作为正极材料的电池。
锂电池具有高能量密度、轻量化和长循环寿命等优点,因此被广泛应用于移动电子设备、电动车辆和储能系统等领域。
锂电池主要包括锂离子电池、锂聚合物电池和锂硫电池等。
3. 镍氢电池:镍氢电池是一种利用镍氢化物和氢氧化镍作为正负极材料的电池。
镍氢电池具有较高的能量密度和循环寿命,适用于需要高性能电池的应用场合,如航空航天领域和混合动力汽车等。
4. 铅酸电池:铅酸电池是一种利用铅和铅二氧化物作为正负极材料的电池。
铅酸电池具有成本低、可靠性高和循环寿命长等优点,广泛应用于汽车起动、UPS电源和太阳能储能系统等领域。
5. 燃料电池:燃料电池是一种利用氢气、甲醇或其他燃料与氧气发生化学反应产生电能的电池。
燃料电池具有高效率、零排放和静音等优点,适用于需要长时间持续供电的应用场合,如无人机、船舶和移动基站等。

电池发电的原理电池是一种常见的能量存储装置,它通过化学反应将化学能转化为电能。
电池的工作原理涉及到离子的运动以及电子的传导,下面将详细介绍电池发电的原理。
一、电池的基本工作原理电池是由正极、负极和电解质组成的。
正极通常由一种氧化剂组成,负极通常由一种还原剂组成,电解质则用于维持正负极之间的离子传导。
当正极和负极通过电解质联系起来时,化学反应就开始了。
二、化学反应过程在充电之前,电池中的正极和负极物质都是稳定的,没有释放或吸收任何电荷。
当开始充电时,正极发生氧化反应,负极则发生还原反应。
正极的氧化反应示例:2MnO2 + 2H2O + 2e− → Mn2O3 + 2OH−负极的还原反应示例:Zn^{2+} + 2e− → Zn根据化学反应式,从正极到负极的离子流动会产生电荷,在电池的外部形成一个电流。
三、电池的闭合电路为了让电池发电,电池必须连接到一个闭合的电路中。
当电路闭合时,电流开始流动,并且可以用来驱动设备或存储在电池中。
在闭合电路中,电流从负极流出,通过外部电路经过设备,最终返回到正极。
在这个过程中,化学反应在电池中持续进行,不断地产生电荷。
四、电势差和电压电势差是指在电池的正极和负极之间产生的电位差。
它是电池的驱动力,可以推动电流的流动。
电势差通常用伏特(V)来衡量。
电压是电势差的另一种表达方式,它等于单位电荷通过电池时所获得的能量。
电压通常用伏特来表示。
五、电池的分类根据电解质的不同,电池可以分为原电池和蓄电池两大类。
原电池是一次性使用电池,例如碱性电池、锌银电池等。
当化学反应中全部的正负电荷耗尽后,原电池就不再工作。
蓄电池是可充电的电池,例如镍镉电池、锂离子电池等。
它们通过反向充电来恢复原始的正负离子配对。
六、电池的应用电池作为一种便携式的能量源广泛应用于日常生活和工业领域。
例如,电池被用于驱动手持设备(如手机、笔记本电脑)、电动车辆、太阳能系统的备用能源等。
此外,电池还是无线通信设备、灯具以及自动化设备的重要组成部分。

电池的工作原理通俗易懂
简单地说,电池就是把化学能、光能、热能、核能等直接转换为电能的装置。
如化学电池、太阳电池、温差电池、核电池等,其中化学电池通常简称电池。
化学电池在工作时,电池由正极经过外电路流到负极,而在电解液内,正负离子则分别向两极迁移,电流从负极流到正极,这叫做电池的放电。
放电时,电池的两个电极上都有化学反应,放电过程一直进行到电路断开或者一种化学反应物质耗尽。
电池的一个重要的性能参数是其电动势,电动势等于单位正电荷由负极通过电池内部移到正极时电池内非静电力(化学力)所作的功。
电动势取决于电极材料的化学性质,与电池大小无关。
电池放电后,由于电极上的化学反应,产生不导电的气体如氧等覆盖在电极表面上,电动势随即降低,这叫做电池的极化现象,可用去极化剂等法消除极化。
电池的另一个性能参数是它的内阻,电池的电极面积越大,内阻越小。
电池的能量储存有限,电池所能输出的总电荷量叫做它的容量,通常用安培小时作单位,它也是电池的一个性能参数。
电池的容量与电极物质的数量有关,即与电极的体积有关。


电池通电的原理电池通电的原理是化学能转化为电能。
电池由正极、负极和电解质组成,正极和负极间通过电解质相连,分别放置在电路中,电解质又称为电池液或电池浆,通常是由氧化物和还原物构成的。
当电池连接外电路时,正极会失去电子,变成带正电荷的离子,而负极会吸收电子,变成带负电荷的离子。
这时电解质中的正离子会向负极移动,负离子会向正极移动,并在外电路中形成一个电流,即电池产生了电能。
电池的核心技术是化学反应。
不同种类的电池有着不同的化学反应原理。
例如,干电池的电解质是氯化锌,正极是二氧化锰,负极是锌。
在正极上,二氧化锰接受负电荷,变成三氧化二锰,并同时释放出氧气和电子,同时在负极上,锌被氯化锌溶液的正离子氯化锌离子还原,失去电子,并形成锌离子和电。
锌离子在电解质中游走并向正极移动,同时氯离子向负极移动。
在负极和正极之间进行的化学反应即产生了电力,将能量转换成了电流。
类似的,镉镍电池和锂离子电池也用化学反应将化学能转化为电能。
在镉镍电池中,负极是由氢氧化镍和氢氧化钴组成,正极是由氢氧化镉组成,通过乙二醇金属镍反应发生电解质中电子在电路中流动。
在锂离子电池中,正极是由金属氧化物LixCmyOn组成,负极是由碳负极和锂离子组成的电解质,通过在正负极之间开放的电解液中将锂离子移动到负极上,并将电子移动到正极上来实现电能转换。
电池的性质是取决于正极和负极之间的化学反应原理。
普通镉镍电池最常见的失效原因是出现极膜,极膜是指在正极和负极之间形成非导电层的现象。
锂离子电池则会因为循环过度或充电不充分而降低容量和性能。
总之,电池的通电原理是将内部化学反应中产生的电能转化为外部电路中的电流,以供给电器设备的使用。

原电池的工作原理_原电池是一种将化学能转化为电能的装置,它由正极、负极和电解质构成。
当正负极之间连接一个外部电路时,电解质中的离子会在正负极之间迁移,从而产生电流。
原电池的工作原理可以分为化学反应、电子迁移和离子迁移三个方面。
1.化学反应:原电池中的正负极材料会发生化学反应。
正极材料负责接受电子,负极材料则负责放出电子。
这种正负极材料的选择与所用的电解质有关。
常见的原电池正极材料有金属氧化物、金属或活性碳,负极材料则通常是金属。
2.电子迁移:在原电池中,负极材料会释放出电子,而正极材料会吸收电子。
这种电子流动会产生一个电动势差(即电压),驱动电子流经外部电路。
3.离子迁移:原电池中的电解质含有可导电的离子。
在电解质中,正负离子会在电场力的作用下通过移动。
正离子会向负极迁移,负离子则会向正极迁移。
这种离子的运动也是原电池产生电流的重要原因之一当原电池的正负极连接一个外部电路时,电子会通过导线从负极流向正极,从而产生电流。
同时,正离子和负离子也会在电解质中分别向正极和负极迁移,以确保整个电池系统的电中性。
可以看到,原电池的工作原理主要涉及到化学反应、电子迁移和离子迁移。
这三个过程共同作用,将化学能转化为电能,并驱动电流在外部电路中流动。
不同的原电池类型,如干电池、锂电池、铅酸电池等,其具体的工作原理会有所不同,但整体的工作原理基本相似。
需要注意的是,原电池工作时会产生一些副产物,如气体、液体或固体,这些副产物可能会对电池的性能产生影响,逐渐降低电池的容量和效能。
因此,不可充电的原电池在使用一段时间后通常会耗尽,需要被更换。

简述锂电池的工作原理
锂电池是一种常见的充电式电池,广泛应用于移动设备、电动车辆和储能系统等领域。
它的工作原理基于锂离子在正负极材料之间的迁移和嵌入/脱嵌反应。
以下是简要的工作原理:
1. 正负极材料:锂电池的正极材料通常是氧化物,如锂钴酸锂(LiCoO2)、锂铁磷酸锂(LiFePO4)等;负极材料通常是碳材料,如石墨。
正负极材料具有高比容量和良好的电化学性能。
2. 锂离子嵌入/脱嵌:充放电过程中,锂离子从正极嵌入负极材料(充电过程),或从负极脱嵌回到正极材料(放电过程)。
这种锂离子的迁移是通过电解质中的锂离子进行的。
3. 电解质:电解质是正负极之间的介质,通常采用有机溶液,其中含有锂盐(如锂盐溴化物)和溶剂(如有机碳酸酯)。
电解质具有高离子导电性,能够促进锂离子的迁移。
4. 电化学反应:在充放电过程中,正极材料发生氧化反应,负极材料发生还原反应。
正极氧化反应的方程式通常表示为:LiCoO2 →
Li1-xCoO2 + xLi+ + xe-,其中x表示锂离子的嵌入/脱嵌程度。
负极还原反应的方程式通常表示为:6C + xLi+ + xe- → Li6C6。
5. 充放电过程:充电过程中,外部电源提供电流,通过正极和负极,使锂离子从正极嵌入负极,同时在负极上释放出电子,形成蓄电能状态。
放电过程中,电池内部的嵌入锂离子开始脱嵌回到正极,释放出电子供外部电路使用。
总体而言,锂电池的工作原理是通过锂离子在正负极材料之间的嵌入/脱嵌反应来实现充放电过程。
这种工作原理使得锂电池具有高能量密度、长寿命、低自放电率和较小的记忆效应等优点,因此得到了广泛的应用。

电路中的电动势电池与电源的原理电路中的电动势:电池与电源的原理电路是电流在闭合回路中流动的路径,而电动势则是电路中将电子流动驱动起来的力量。
在大多数电路中,电动势是由电池或电源提供的。
本文将探讨电路中的电动势,重点介绍了电池和电源的原理。
一、电动势的概念和作用电动势是指单位正电荷通过电源或电池从负极移动到正极所需的能量。
它通常用符号ε表示,单位为伏特(V)。
电动势不是一个电势差,而是单位正电荷被移动所需的能量。
它代表了电源或电池提供给电路中电子流动的推动力。
电动势在闭合回路中起到非常重要的作用。
它使电子在电路中发生流动,从而实现了电路的工作。
例如,在直流电路中,电池的电动势驱使电子从负极流向正极,从而形成电流。
而在交流电路中,电源的电动势则使电子按照周期性的方式在电路中来回流动。
二、电池的原理电池是一种将化学能转化为电能的装置。
根据其工作原理的不同,电池分为很多种类,例如干电池、碱性电池、锂离子电池等。
以下以干电池为例,介绍电池的原理。
干电池由一个正极、一个负极和一个电解质组成。
正极是由氧化剂和导电材料组成的,负极则是由还原剂和导电材料组成。
两种不同的材料通过电解质分隔开来,但它们之间可以通过离子交换进行化学反应。
当电池的正负极连接到一个外部电路时,化学反应开始发生。
在正极,氧化剂吸收了电子,并与负极的还原剂发生反应。
这个反应会产生一种称为电势差的差异,也就是电动势。
电势差会推动电子从正极流向负极,形成电流。
三、电源的原理电源是一种能够提供稳定电压和电流的设备。
它可以将其他形式的能量转换为电能,供电路中的电子流动使用。
电源的工作原理与电池类似,但电源通常通过其他方式提供连续稳定的电能。
常见的电源包括交流电源和直流电源。
交流电源将交流电能转换为电路中所需的电能。
它包括变压器、整流器等电子元件,能够将电网中的高压交流电转换为适合电路使用的低压交流电。
直流电源则通常通过变压器和整流器将交流电转换为直流电。
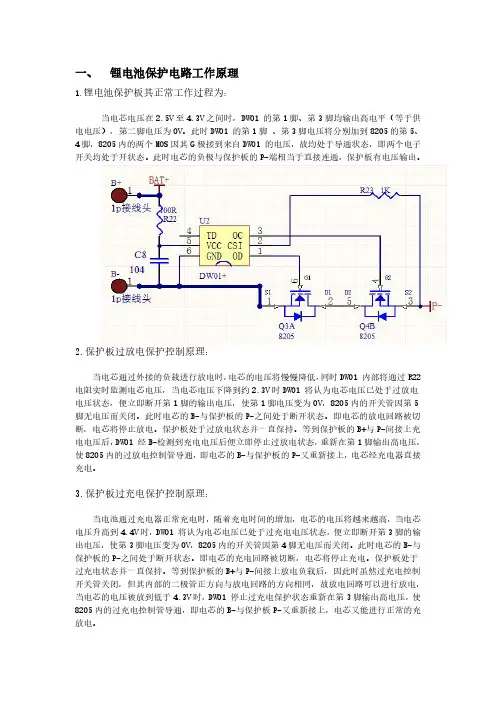
一、锂电池保护电路工作原理1.锂电池保护板其正常工作过程为:当电芯电压在2.5V至4.3V之间时,DW01的第1脚、第3脚均输出高电平(等于供电电压),第二脚电压为0V。
此时DW01的第1脚、第3脚电压将分别加到8205的第5、4脚,8205内的两个MOS因其G极接到来自DW01的电压,故均处于导通状态,即两个电子开关均处于开状态。
此时电芯的负极与保护板的P-端相当于直接连通,保护板有电压输出。
2.保护板过放电保护控制原理:当电芯通过外接的负载进行放电时,电芯的电压将慢慢降低,同时DW01内部将通过R22电阻实时监测电芯电压,当电芯电压下降到约2.3V时DW01将认为电芯电压已处于过放电电压状态,便立即断开第1脚的输出电压,使第1脚电压变为0V,8205内的开关管因第5脚无电压而关闭。
此时电芯的B-与保护板的P-之间处于断开状态。
即电芯的放电回路被切断,电芯将停止放电。
保护板处于过放电状态并一直保持。
等到保护板的B+与P-间接上充电电压后,DW01经B-检测到充电电压后便立即停止过放电状态,重新在第1脚输出高电压,使8205内的过放电控制管导通,即电芯的B-与保护板的P-又重新接上,电芯经充电器直接充电。
3.保护板过充电保护控制原理:当电池通过充电器正常充电时,随着充电时间的增加,电芯的电压将越来越高,当电芯电压升高到4.4V时,DW01将认为电芯电压已处于过充电电压状态,便立即断开第3脚的输出电压,使第3脚电压变为0V,8205内的开关管因第4脚无电压而关闭。
此时电芯的B-与保护板的P-之间处于断开状态。
即电芯的充电回路被切断,电芯将停止充电。
保护板处于过充电状态并一直保持。
等到保护板的B+与P-间接上放电负载后,因此时虽然过充电控制开关管关闭,但其内部的二极管正方向与放电回路的方向相同,故放电回路可以进行放电,当电芯的电压被放到低于4.3V时,DW01停止过充电保护状态重新在第3脚输出高电压,使8205内的过充电控制管导通,即电芯的B-与保护板P-又重新接上,电芯又能进行正常的充放电。
锂电池保护电路原理
锂电池保护电路的原理是通过控制电池的充放电过程,保证电池在安全范围内工作,预防过充、过放、过流等问题的发生,从而延长电池的使用寿命并确保使用过程中的安全性。
1. 过充保护:当锂电池充电到达允许的最高电压时,保护电路会切断电池与充电源的连接,防止继续充电,从而避免过充引起的安全隐患。
2. 过放保护:当锂电池电压降到允许的最低电压时,保护电路会切断电池与负载的连接,防止继续放电,以防止电池过放而损坏。
3. 过流保护:在使用过程中,如果负载产生过高的电流,保护电路会及时切断电池与负载的连接,防止过大电流对电池产生损害或引起过热、安全事故。
4. 温度保护:保护电路还会通过温度传感器实时检测电池的温度,当电池温度过高时,保护电路会切断电池与充电源或负载的连接,以防止温度过高引起的安全隐患。
5. 均衡充放电:在锂电池组中,不同单体电池之间的容量和电压可能存在差异,为了避免电池的过充或过放,保护电路还会实施均衡充放电策略,即通过调节电流,使各个单体电池的电荷状态维持在接近的水平。
综上所述,锂电池保护电路通过监测和控制电池的充放电过程,
有效地保护电池的工作安全,延长电池的使用寿命并提高使用时的安全性。
锂离子电池工作原理锂离子电池是一种常见的可充电电池,广泛应用于手机、笔记本电脑、电动车等电子设备中。
它的工作原理是通过锂离子在正负极之间的迁移来实现电荷的存储和释放。
锂离子电池由正极、负极、电解质和隔膜组成。
其中,正极材料通常采用锂化合物,如锂钴酸锂、锂铁磷酸锂等;负极材料则是碳材料,如石墨。
电解质是一种可导电的溶液或固体,常用的电解质是有机溶液或聚合物凝胶。
隔膜则起到隔离正负极的作用,防止短路。
在充电过程中,锂离子从正极材料中脱嵌,通过电解质和隔膜迁移到负极材料中嵌入。
同时,电子也从负极通过外部电路流向正极,完成充电过程。
这个过程是可逆的,因此锂离子电池可以重复充放电。
当需要使用电池供电时,锂离子从负极材料中脱嵌,通过电解质和隔膜迁移到正极材料中嵌入。
同时,电子从正极通过外部电路流向负极,驱动设备工作。
这个过程是不可逆的,因此电池的容量会逐渐减小。
锂离子电池的工作原理可以通过以下几个步骤来解释:1. 充电过程中,正极材料中的锂离子被氧化,释放出电子,电子通过外部电路流向负极材料。
同时,锂离子穿过电解质和隔膜,迁移到负极材料中嵌入。
2. 放电过程中,负极材料中的锂离子被氧化,释放出电子,电子通过外部电路流向正极材料。
同时,锂离子穿过电解质和隔膜,迁移到正极材料中嵌入。
3. 充放电过程中,电解质和隔膜起到了隔离正负极的作用,防止短路。
电解质中的溶液或凝胶能够导电,使得锂离子能够迁移。
4. 锂离子的迁移是通过离子扩散来实现的,即锂离子在电解质中的运动。
锂离子会沿着浓度梯度从高浓度区域向低浓度区域扩散。
5. 锂离子的迁移速度受到材料的性质、电解质的浓度和温度等因素的影响。
通常情况下,锂离子在电解质中的迁移速度较快,使得锂离子电池具有较高的充放电效率。
总结起来,锂离子电池的工作原理是通过锂离子在正负极之间的迁移来实现充放电过程。
正极材料在充电过程中脱嵌锂离子,放电过程中嵌入锂离子;负极材料则相反。
电解质和隔膜起到了隔离和导电的作用。
电池充电电路原理
电池充电电路的基本原理涉及电能转换为化学能的过程,即通过电化学反应将电能储存到电池中。
这个过程包括电子的转移,其中电池的电动势条件使得反应产物的能量大于反应物。
电池充电电路通常包括一个交流电源线,通过电流限幅电路和平波电路转换为直流电源。
这个直流电源为电源管理芯片提供启动电压,使其能够控制功率开关管的导通与关断,从而产生变化的电压和电流。
这些变化的电压和电流通过变压器传递,在变压器的副边感应出为待充电负载提供直流充电电源的电压和电流。
电源管理芯片根据采样电阻检测到的电流调整脉冲信号,控制功率开关管的导通与关断,以适应电压和电流的变化,实现对电池的充电。
在充电过程中,当电池电压低于 4.2V的上限时,电压采样电路会检测到一个较低的电压信号,导致稳压二极管处于截止状态,进而使三极管处于截止状态。
随着电池电压的上升,当电压超过4.2V时,稳压二极管开始导通,增加流经电阻的电流,驱动三极管导通,从而开始正常的充电过程。
锂电池电路板工作原理
主控芯片是锂电池电路板的核心部件,负责控制电池充电和放电过程中的电流、电压和温度等参数。
电池保护芯片则用于保护电池免受过充、过放、短路和过流等故障的影响。
电感器和电容器则负责稳压和滤波,以确保电路的稳定性和可靠性。
二极管和电阻器则用于保护电路免受反向电压和静电等干扰的影响。
锂电池电路板的工作原理可以简单概括为:在充电时,主控芯片监测电池电压,控制充电电流和电压,直至电池充满;在放电时,主控芯片监测电池电压,控制放电电流和电压,以保证电池安全、稳定地工作。
锂电池电路板的作用非常重要,能够有效保护锂电池,延长电池寿命,同时也能够为锂电池的应用提供安全的保障。
- 1 -。
动力电池的内部电路原理
动力电池的内部电路原理由电池单体、电池管理系统和电池控制单元组成。
1. 电池单体:动力电池一般由多个电池单体组成,每个电池单体通常由一个正极、负极和电解液组成。
正极和负极分别是电池的正负极,它们之间通过电解液进行电荷的传输。
2. 电池管理系统(Battery Management System,简称BMS):BMS是动力电池的核心部件,主要负责监测和管理电池的工作状态。
它通常包括电池监测单元、温度监测单元、电流监测单元和通信单元等功能模块。
BMS能够监测电池的电压、容量、温度和电流等参数,以保证电池的安全和性能。
3. 电池控制单元:电池控制单元与BMS相连,主要负责控制电池的充放电过程。
通过与车辆控制系统的通信,电池控制单元能够根据车辆的需求控制电池的输出电流和电压,以提供所需的动力。
总的来说,动力电池的内部电路原理是通过BMS监测和管理电池的工作状态,并通过电池控制单元根据车辆需求控制电池的充放电过程,以提供车辆所需的动力。
电池电路工作原理电池电路工作原理电池是一种将化学能转化为电能的装置,广泛应用于各种电子设备中。
它的工作原理主要涉及电化学反应和电路的基本原理。
一、电化学反应电池的工作原理基于电化学反应,其中最常见的是化学电池。
化学电池由两个半电池组成,每个半电池中都包含一个电解质溶液和一个电极。
半电池的两个电极被称为阳极和阴极。
当电池连接电路并开始工作时,化学反应在两个半电池之间发生。
在阴极上,还原反应发生,金属离子被电子还原成金属原子,并从溶液中析出。
在阳极上,氧化反应发生,金属原子转化为离子,并溶解到溶液中。
这些反应导致电子从阴极流向阳极,形成了电流。
二、电路的基本原理电路是电流在导体中流动的路径。
在电池电路中,电池被连接到其他电子设备或元件,形成一个封闭的回路。
电流从电池的阴极流出,通过电路中的负载(如灯泡、电机等)流动,然后回到电池的阳极。
在电路中,电流的流动受到欧姆定律的影响,即电流与电压和电阻之间的关系。
欧姆定律可以表示为I = V/R,其中I是电流,V是电压,R是电阻。
根据欧姆定律,电流的大小取决于电压的大小和电阻的大小。
在电池电路中,电池提供电压,而负载的电阻则决定了电流的大小。
在电池电路中,还存在一个重要的概念,即电动势。
电动势是电池提供的电压,它代表了电池电化学反应的能力。
电动势通常用符号E表示,单位是伏特(V)。
电动势可以看作是电池驱动电流流动的推动力。
三、电池电路的工作原理根据以上的电化学反应和电路的基本原理,可以总结出电池电路的工作原理。
当电池连接到电路中时,电池的电化学反应开始发生。
阴极上的还原反应产生电子,而阳极上的氧化反应接受电子。
这些电子沿着电路流动,从阴极流出,经过负载,然后回到阳极。
在电路中,电流的大小取决于电动势和电阻。
电动势决定了电流流动的推动力,而电阻则限制了电流的流动。
当负载电阻增加时,电流减小,而当负载电阻减小时,电流增加。
这是因为电阻越大,电流受到的阻碍越大。
因此,电池电路的工作原理可以总结为:电池提供电动势,推动电流在电路中流动,而负载的电阻则决定了电流的大小。
电池电路工作原理
电池电路工作原理
电路具有过充电保护、过放电保护、过电流保护与短路保护功能,其工作原理分析如下:
1、正常状态
在正常状态下电路中N1的“CO”与“DO”脚都输出高电压,两个MOSFET都处于导通状态,电池可以自由地进行充电和放电,由于MOSFET 的导通阻抗很小,通常小于30毫欧,因此其导通电阻对电路的性能影响很小。
7|此状态下保护电路的消耗电流为μA级,通常小于7μA。
2、过充电保护
锂离子电池要求的充电方式为恒流/恒压,在充电初期,为恒流充电,随着充电过程,电压会上升到4.2V(根据正极材料不同,有的电池要求恒压值为4.1V),转为恒压充电,直至电流越来越小。
电池在被充电过程中,如果充电器电路失去控制,会使电池电压超过4.2V后继续恒流充电,此时电池电压仍会继续上升,当电池电压被充电至超过4.3V时,电池的化学副反应将加剧,会导致电池损坏或出现安全问题。
在带有保护电路的电池中,当控制IC检测到电池电压达到4.28V(该。