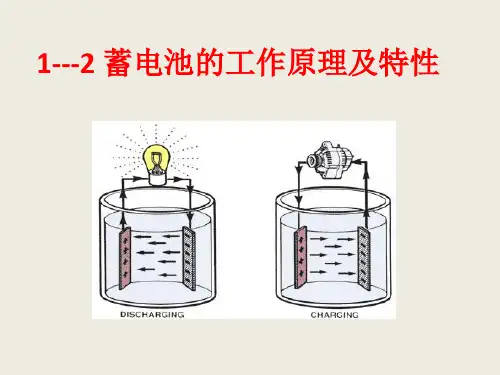
12蓄电池的工作原理及特性
- 格式:pptx
- 大小:1.29 MB
- 文档页数:8

汽车蓄电池的工作原理蓄电池,也称为电池,是一种可以将化学能转换成电能的电化学装置。
汽车蓄电池,通常指的是铅酸蓄电池,是汽车电源系统中的核心组件之一。
汽车蓄电池的作用是存储能量,提供给汽车发动机起动,以及发电机充电。
下面将介绍汽车蓄电池的工作原理。
1. 电化学原理汽车蓄电池是一种化学电源,它利用化学反应将化学能转化为电能。
汽车蓄电池的主要组成是阳极、阴极以及电解质。
阳极是由铅(Pb)和铅-钙合金组成的,阴极是由氧化铅(PbO2)和氧化镉(CdO)组成的。
电解质是一种浓度为1.275克/立方厘米的硫酸,它在阳极和阴极之间形成一个电路,以支持化学反应。
2. 充电和放电过程当汽车发动机启动时,发电机会把电能输送到蓄电池中进行充电。
充电过程中,发电机将直流电源(约14.4至14.8伏)输送到蓄电池正极,同时将电流从蓄电池负极流出。
这导致化学反应在阳极和阴极之间发生,从而将电能存储在蓄电池中。
当需要启动汽车时,启动电路会从蓄电池提取电能,并将电能输送到发动机启动器。
同时,化学反应从阴极开始,将化学能转化为电能,使蓄电池放电。
这种化学反应会在阳极和阴极之间产生电流,这将支持车辆的启动和发电机的运转。
3. 其他要考虑的因素在了解了汽车蓄电池充放电的基本过程之后,我们还需要考虑其他因素,这些因素可以影响蓄电池的寿命和性能。
- 温度:高温和低温都会损害蓄电池。
低温会导致反应速度减缓,高温则导致水分蒸发和电池容量降低。
因此,要避免在高温或低温环境下长时间停放汽车。
- 液面高度:液面低于蓄电池板的顶部会导致板氧化,从而损害蓄电池的性能和寿命。
因此,需要定期检查蓄电池的液位,并及时加注硫酸。
- 使用频率:蓄电池经常需要长时间停放,这会导致电池自行放电并减少容量。
因此,建议在停放期间定期充电蓄电池。
总之,汽车蓄电池的工作原理是将化学能转换为电能。
了解汽车蓄电池的工作原理有助于我们更好地维护它,延长其寿命,并确保我们的汽车在需要启动时可靠地启动。

蓄电池的工作原理
蓄电池是利用电解的原理来向电气设备提供电能的一种电源。
蓄电池的基本工作原理是,在其内部同时存在正极材料和负极材料,以及电解液,这三者在物理上相互独立,但在化学上却有着千丝万缕的联系。
正极材料和负极材料共同参与发生化学反应,形成电子的流动,从而实现电能的转化。
下面就来详细讲解一下蓄电池的工作原理:
1、充电:当正负极材料的反应产物析出时,正极材料就会向负极材料输出电子,电子从正极材料流向负极材料,当电子流经正极电路时,就会产生一定的电势差,电池就处于充电状态,电势差的大小越大,就表明蓄电池的充电量越多。
2、放电:当外部给定一定的电势差时,电子从负极材料流向正极材料,电路中的电子就会从负极材料流向外界,电子运动了就会产生电流,就可以给电路提供电能,发生放电的状态,如果外界加装的负载越大,电子流动的量就越多,蓄电池的放电量也就越大。
3、补充电解液:当电解液中的电解质用完了,那么电解液就会过低,会影响蓄电池的工作,甚至损伤其内部组件,所以应定期补充电解液,以保持正常工作状态。
以上就是蓄电池的基本工作原理,蓄电池在实际的应用中发挥着重要的作用,我们应该充分理解它的工作原理,以达到它的最大价值。
- 1 -。

12v蓄电池正常电压范围摘要:1.12v 蓄电池简介2.12v 蓄电池正常电压范围3.电压对蓄电池性能的影响4.如何保持蓄电池电压稳定正文:12v 蓄电池简介12v 蓄电池是一种广泛应用于汽车、摩托车、太阳能系统等领域的电源设备。
它的主要作用是在需要时提供电能,并在供电中断时储存电能。
12v 蓄电池的性能和寿命受到许多因素的影响,其中最重要的因素之一就是电压。
12v 蓄电池正常电压范围对于12v 蓄电池来说,其正常电压范围在12.4v 至12.7v 之间。
在这个电压范围内,蓄电池可以提供稳定的电能输出,并且能够较好地进行充电。
如果电压过低,蓄电池的性能将受到影响,可能导致设备无法正常工作。
而电压过高,虽然可以提供更大的电能输出,但会加速蓄电池的损耗,缩短其使用寿命。
电压对蓄电池性能的影响电压是衡量蓄电池性能的重要指标。
在正常电压范围内,蓄电池可以提供稳定的电能输出,保证设备的正常运行。
然而,如果电压过低,蓄电池的输出功率将降低,可能无法满足设备的需要。
此外,低电压还可能导致蓄电池内部的化学反应失衡,进一步损坏蓄电池。
相反,如果电压过高,蓄电池的输出功率虽然会增加,但会加速蓄电池的损耗,降低其使用寿命。
如何保持蓄电池电压稳定保持蓄电池电压稳定,不仅可以保证设备的正常运行,还可以延长蓄电池的使用寿命。
以下是一些建议:- 避免长时间不使用蓄电池:长时间不使用蓄电池会导致电压逐渐降低,因此,建议在长时间不使用蓄电池时,定期进行充电。
- 确保充电设备正常:使用质量可靠的充电设备,并定期检查充电线是否损坏。
- 控制负载:避免在蓄电池上连接过多的大功率设备,以免导致电压波动。
- 定期检查:定期检查蓄电池的电压,如果发现电压异常,及时采取措施进行调整。
总结12v 蓄电池的正常电压范围在12.4v 至12.7v 之间。
电压对蓄电池的性能有着重要影响,因此,保持电压稳定是保证蓄电池正常工作和延长使用寿命的关键。

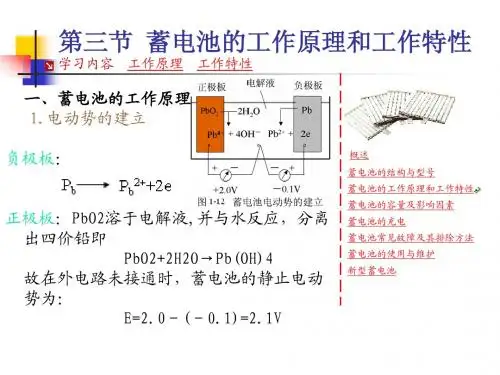
蓄电池的工作原理及特性一、蓄电池的工作原理蓄电池是由浸渍在电解液中的正极板(二氧化铅Pb02)和负极板(海绵状纯铅Pb)组成的,电解液是硫酸(H2S04)的水溶液。
当蓄电池和负载接通放电时,正极板上的Pb02 和负极板上的Pb都变成PbS04,电解液中的H2S04减少,相对密度下降。
充电时按相反的方向变化,正负极板上的PbS04分别恢复成原来的Pb02和Pb,电解液中的硫酸增加,相对密度变大。
如略去中间的化学反应过程,可用下式表示:Pb02+Pb十2H2S04=2PbS04+2H20 (1—1)1.电势的建立当极板浸入电解液时,在负极板处,金属铅受到两方面的作用,一方面它有溶解于电解液的倾向,因而有少量铅进入溶液,生成Pb2+,在极板上留下两个电子2e,使极板带负电;另一方面,由于正、负电荷的吸引,Pb2+有沉附于极板表面的倾向。
当两者达到平衡时,溶解便停止,此时极板具有负电位,约为-0.1V。
正极板处,少量Pb02溶入电解液,与水生成Pb(OH):,再分离成四价铅离子和氢氧根离子。
即Pb02+2H20---->Pb(OH)4Pb(OH)4=Pb4++4(OH)-由于Pb4+沉附于极板的倾向,大于溶解的倾向,因而沉附在正极板上,使极板呈正电位。
当达到平衡时,约为+2.0V。
因此,当外电路未接通,反应达到相对平衡状态时,蓄电池的静止电动势约为:E0=2.0-(-0.1)=2.1V2.铅蓄电池的放电当蓄电池接上负载后,在电动势的作用下,电流从正极经过负载流往负极(即电子从负极到正极),使正极电位降低,负极电位升高,破坏了原有的平衡。
放电时的化学反应过程如图1—3所示。
在正极板处,Pb4+和电子结合,变成二价铅离子Pb2+,Pb2+与电解液中的SO42-结合生成PbS04沉附于极板上。
即Pb4++2e----> Pb2+Pb2++ SO42-=PbSO4在负极板处,Pb2+与电解液中的SO42-结合也生成PbS04沉附在负极板上,而极板上的金属铅继续溶解,生成Pb2+和电子。

蓄电池原理图知识点总结
蓄电池原理图包括了电池的基本结构、工作原理和特性。
了解蓄电池原理图的知识点可以帮助我们更好地理解蓄电池的工作方式,以及如何正确地使用和维护蓄电池。
1. 蓄电池的基本结构
蓄电池通常由正极、负极、电解质和电解槽等部分组成。
其中,正极由正极板和活性物质组成,负极由负极板和活性物质组成,电解质则是连接正负极的重要组成部分。
电解槽则是用来封装正负极和电解质以及绝缘电池的空间。
2. 蓄电池的工作原理
蓄电池的工作原理主要是通过化学反应来储存和释放电能。
当蓄电池充电时,正极和负极发生化学反应,将化学能转化为电能储存在蓄电池中。
当需要使用电能时,蓄电池则将储存的电能释放出来,供各种设备使用。
3. 蓄电池的特性
蓄电池具有很多特性,其中最主要的特性包括容量、电压、充放电效率、循环寿命和自放电率等。
了解这些特性可以帮助我们更好地选择和使用蓄电池,以满足不同设备的电能需求。
总的来说,蓄电池原理图的知识点包括了电池的基本结构、工作原理和特性,这些知识点对于我们理解蓄电池的工作方式和正确使用蓄电池具有重要的意义。
希望以上知识点可以帮助大家更好地了解蓄电池原理图。


蓄电池工作原理详解蓄电池(或称为电池)是一种能够储存与释放电能的装置,广泛应用于各个领域,如汽车、电子设备、太阳能发电等。
本文详细介绍蓄电池的工作原理,包括其构造、充放电过程以及电化学反应等。
一、构造蓄电池的基本构造包括正极、负极、电解液以及隔膜。
其中正极通常由氧化物制成,负极由金属制成。
电解液则是催化正负离子在两极之间运动的介质。
隔膜则用于分隔正负极,同时允许离子通过。
二、充电与放电过程1. 充电过程在充电过程中,外部电源施加电压(通常低于电池的电压),正极吸收电子,负极则将电子释放至外部电路。
同时,电解液中的正离子会通过隔膜逆向移动至负极。
这一过程中,电池会储存电能。
2. 放电过程在放电过程中,连接到电池的外部电路中存在负载电阻。
负载电阻会导致电子从负极向正极移动,同时正离子通过隔膜流动至负极,从而使电池释放储存的电能。
三、电化学反应蓄电池工作的本质是一种电化学反应。
在充放电过程中,正极和负极之间会发生一系列的氧化还原反应。
以铅酸蓄电池为例,充电过程中,正极上的四价铅酸(PbO2)会被还原为二价的铅(Pb),负极上的二价铅酸(PbSO4)会被氧化为铅。
反之,在放电过程中,这些反应则会逆向进行。
四、性能特点蓄电池具有一些特殊的性能特点,包括以下几个方面:1. 电压稳定性:蓄电池能够提供相对稳定的电压输出,不受外界供电波动的影响。
2. 容量:蓄电池的容量决定了其可以存储与释放的电能数量,通常以安时(Ah)为单位。
3. 循环寿命:蓄电池的循环寿命指的是其能够进行多少次完整的充放电循环。
循环寿命取决于电池的材料与设计。
4. 自放电率:蓄电池在不使用时会发生自放电,即电荷会自行流失。
自放电率越低,蓄电池的续航能力越强。
5. 温度特性:蓄电池的性能受环境温度影响较大,一般来说,较高的温度会提高电池的输出能力,但同时也会加速电池的老化。
五、总结蓄电池是一种能够储存与释放电能的设备,其工作原理基于电化学反应。

蓄电池的工作原理蓄电池是一种能将化学能转化为电能的装置,它在我们日常生活中扮演着非常重要的角色。
蓄电池的工作原理涉及到化学反应和电能转换的过程,下面我们将详细介绍蓄电池的工作原理。
首先,蓄电池的工作原理基于化学反应。
一个典型的蓄电池由正极、负极和电解质组成。
正极和负极分别是两种不同的金属或化合物,它们之间通过电解质相互隔离。
当蓄电池接通电路时,正极和负极之间的化学反应开始进行。
在这个过程中,正极发生氧化反应,负极发生还原反应,产生电子流动,从而形成电流。
其次,蓄电池的工作原理还涉及到电能的转化。
当蓄电池放电时,化学能转化为电能,驱动电路工作。
而当蓄电池充电时,外部电源提供电能,使得蓄电池内部的化学反应发生逆反应,从而储存电能。
这种化学能和电能之间的相互转化是蓄电池能够实现长期储存和释放电能的关键。
此外,蓄电池的工作原理还与电解质的特性密切相关。
电解质是蓄电池中起着传递离子的作用的重要组成部分,它的种类和浓度会直接影响蓄电池的性能。
良好的电解质可以提高蓄电池的充放电效率和循环寿命,从而使蓄电池更加稳定可靠。
总的来说,蓄电池的工作原理是通过化学反应将化学能转化为电能,实现电能的储存和释放。
蓄电池在电动汽车、手机、笔记本电脑等设备中都有着广泛的应用,它的工作原理的深入理解对于提高蓄电池的性能和延长使用寿命具有重要意义。
通过对蓄电池工作原理的深入了解,我们可以更好地选择和使用蓄电池,同时也有助于未来蓄电池技术的发展和创新。
希望本文能够帮助大家更好地理解蓄电池的工作原理,为我们的生活和工作提供更多便利。
铅酸蓄电池充放电工作原理通过以前的介绍我们知道一个基本的铅酸蓄电池是由正、负极板浸润在它们之间的电解液中组成的。
说的更细致一点,正极板和负极板与电解液形成各自的‘半电池’。
在各自的半电池构造里正极板具有正电势、负极板具有负电势。
基本单电池可以看作上述两个‘半电池’按正极板-电解液——电解液-负极板组合而成,正、负相对电势为2V,6个单电池串联在一起就是电动车常用的12V电池。
铅酸蓄电池充满电时,正极板上的物质是二氧化铅(PbO2),负极板上的物质是绒状的铅(Pb),电解液硫酸(H2SO4)的密度约为1.33g/cm3(指电动车用铅酸蓄电池,其他用途铅酸蓄电池密度稍低)。
在放电过程中,通过放电回路正极板上的二氧化铅得到电子,负极板上的铅失去电子,分别产生二价铅(Pb2+)并且与电解液中的硫酸作用,在各自极板上沉淀为硫酸铅(PbSO4);析出的氧离子和氢离子化和成水。
随着放电的进行,电解液浓度下降,正、负极板上的硫酸铅逐渐积累。
当这个过程发展到一定的程度,放电极化现象越来越重,正极板的电势越来越趋向于负,负极板电势越来越趋向于正,电解液中硫酸的密度越来越低,电池的电压低到终止电压,放电就必须终止。
在充电过程中,溶液中的二价铅离子将电子传给外电路氧化为正四价铅(Pb4+),同时电解液水(H O2)中的氧离子和正四价铅进入正极板的二氧化铅晶格。
由于溶液中的二价铅被消耗,于是正极板上的硫酸铅不断溶解,二氧化铅不断生成;负极板上的硫酸铅先溶解成二价铅和硫酸根(SO4),二价铅接受充电回路传来的电子在负极板上还原成铅。
同时电解液中留下的氢和硫酸根合成硫酸。
随着充电的进行,极板上的硫酸铅逐步溶解,电解液浓度不断提高。
当这个过程进行到一定程度,充电极化现象越来越重,正、负极板先后分别析出氧和氢,充电电流越来越多的产生水解,电解液中硫酸密度越来越高,正极板电势趋向最正,负极板电势趋向最负,电池电压不断升高,最终恢复到上述充满电的状态。
12v电瓶充电器原理
12V电瓶充电器是一种用于给12V直流电瓶充电的设备。
它的原理是通过将交流电转换成直流电,并将电压降低到适合电瓶充电的水平。
在充电器内部,有一个电变压器用于将输入的交流电转换成所需的直流电。
电变压器由一个铁芯和绕组组成。
当交流电输入时,它会在铁芯中产生一个交变磁场。
接着,通过绕组产生的电感作用,将电流从交流电源中提供给电瓶进行充电。
充电时,电瓶的电压会逐渐升高,而充电器会根据充电电流和电瓶电压的关系来调整输出电流,以便保持在一个适当的水平。
此外,充电器通常还包括一些保护电路,用于监测电瓶的电压和电流,并在电瓶电压达到要求或超过安全限制时停止充电,以防止过充电或过充放电。
总之,12V电瓶充电器通过将交流电转换成适合充电的直流电并控制输出电流,实现对12V电瓶的充电。
蓄电池的充电和放电工作原理蓄电池是由正极、负极和电解液组成的封闭容器,可以将化学能转化为电能,并将电能转化为化学能,可以在放电过程中释放电能,在充电过程中储存电能。
它是家用、商用和工业生产过程中使用的重要能源储备器具之一。
蓄电池有两个运行状态,即充电和放电。
充电的过程是将外部的电能输入到蓄电池中,在蓄电池的正极上,电子从外部电源流向蓄电池,在负极上,氢离子及电解质由电解液中离子流向蓄电池,在负极氢离子与正极电子结合,通过化学反应生成水,这种过程叫做充电过程,在这个过程中蓄电池可以吸收到外部电能,从而使蓄电池的储存容量增大。
放电过程是蓄电池释放储存的电能。
在放电过程中,负极氢离子脱离,离开负极,氧离子流入电解液和负极,此时,负极气体离开,正极的电子离开,两者在空气中或其他介质中结合,形成氧气,这时蓄电池可以释放出储存的电能,此过程叫做放电过程。
蓄电池充电和放电时,会发生多重电化学反应,其原理是能量从电极流向电解液,而电解液内的电子流从另一个电极流出。
在充电过程中,电流通过电极,使正极氢离子及电解质从电解液中流入电极,并与负极的电子反应形成水,从而使储存的电能增加;在放电过程中,电流流过电极,使负极的氢离子感受到电场的力的作用及离子的活动,离开阴极,并与正极的电子反应回到电解液中,从而使储存的电能减少。
蓄电池在充电和放电过程中,会发生氧化-还原反应,以及水分子失去电子、氢离子与氧结合以及氢离子失去电子、氢离子与正极电子结合等作用,从而实现蓄电池的充电和放电。
蓄电池的充电和放电工作原理是一种复杂的电化学反应,这种反应可以轻松调节,也可以让蓄电池能够充电和放电,从而维持一定的能量消耗,使蓄电池的使用和应用更加便捷和安全。
蓄电池的充电和放电工作原理对于蓄电池的使用、维护和维修都有重要意义,它不仅可以提高蓄电池的耐用性,还可以更好地满足用户的需求,帮助用户实现能量的可持续利用。
蓄电池工作原理详解蓄电池是一种能够将化学能转化为电能,并在需要时进行反向转化的装置。
它广泛应用于汽车、电动车、UPS等领域,成为现代生活中不可或缺的电力储备设备。
本文将详细介绍蓄电池的工作原理以及其内部的化学反应过程。
一、蓄电池的构成和基本原理蓄电池由正极、负极、电解液和隔膜组成。
正极通常由过渡金属氧化物如二氧化铅(PbO2)、四氧化三锰(MnO2)等制成,负极通常由活性物质如海绵铅(Pb)等构建。
电解液由硫酸溶液或盐酸溶液组成,隔膜用于隔离正负极,防止短路。
蓄电池的基本原理是靠正负极之间的化学反应来产生电能。
正极上的金属氧化物可以从电解液中抽取电子,而负极上的活性物质则能够接收这些电子。
当外部电路处于闭合状态时,电子从正极顺着电路流向负极,同时在电解液中发生化学反应。
这种反应一部分将正极氧化物还原,而另一部分将负极活性物质氧化,产生的化合物将在电解液中溶解。
二、蓄电池的充放电过程1. 充电过程在充电过程中,外部电源的正极连接到蓄电池的正极,负极连接到负极,使电流从外部电源进入蓄电池。
这时,蓄电池的正负极发生了变化,负极变为正极,正极变为负极。
充电时,电解液中的SO4离子在正极被还原为SO2离子,与正极反应得到硫酸铅(PbSO4)。
同时,负极上的PbSO4被氧化为Pb2+离子并溶解在电解液中。
这个过程是可逆的,即在放电时可以逆转。
2. 放电过程在放电过程中,蓄电池的正负极与外部电路相连,并开始输出电能。
这时,通过外部电路的负载会从蓄电池的负极获取电子,使负极氧化为PbSO4并溶解在电解液中。
同时,正极上的PbSO4被还原为Pb2+。
这个过程是蓄电池提供电能的过程。
三、蓄电池的特点和应用1. 蓄电池具有可充电性和可重复使用性的特点。
它可以通过外部电源进行充电,然后释放储存的能量,在需要时再次进行充电。
2. 由于蓄电池的便携性和较长的使用寿命,它被广泛应用于汽车、电动车、手机和应急电源等领域。
3. 蓄电池的能量密度相对较低,储存的电能有限。
蓄电池结构及工作原理
蓄电池是一种能够将化学能转化为电能的设备。
它由正极、负极、电解液和隔板组成。
正极通常由二氧化铅制成,负极则由金属铅制成,电解液则是硫酸溶液,隔板则用来分隔正负极。
蓄电池的工作原理基于化学反应。
当蓄电池充电时,外部电源将直流电通过蓄电池,使得正极上的二氧化铅发生还原反应,变成了PbSO4并释放出氧气。
同时,在负极上的金属铅与硫酸根离子反应,形成了PbSO4和氢气。
当需要使用蓄电池时,它会被连接到一个外部回路中。
这时候,反应方向就会反转:在正极上发生氧化还原反应,生成二氧化铅和水,并释放出电子;在负极上发生还原反应,金属铅与硫酸根离子结合形成PbSO4,并吸收了从正极流过来的电子。
因此,在充电过程中需要消耗外部能量才能将化学能转换为储存起来的电能,在使用过程中则可以通过外部回路将储存的电能转化为其他形式的能量。
蓄电池的容量是指它能够储存多少电荷,通常用安时(Ampere-hour)来表示,即一个蓄电池在1小时内放出1安培电流所需要的时间。
蓄电池还有很多不同类型,例如铅酸蓄电池、镍氢蓄电池、锂离子蓄电池等。
它们各自有不同的结构和化学反应方式,但都基于相同的原理:将化学反应转化为储存起来的电能,并在需要时将其释放出来。
总之,蓄电池是一种非常重要的设备,广泛应用于各种场合中,例如汽车、UPS、太阳能发电等。
对于理解其工作原理和性能特点具有重要意义。