蓄电池的工作原理及特性PPT课件
- 格式:pptx
- 大小:1.73 MB
- 文档页数:10

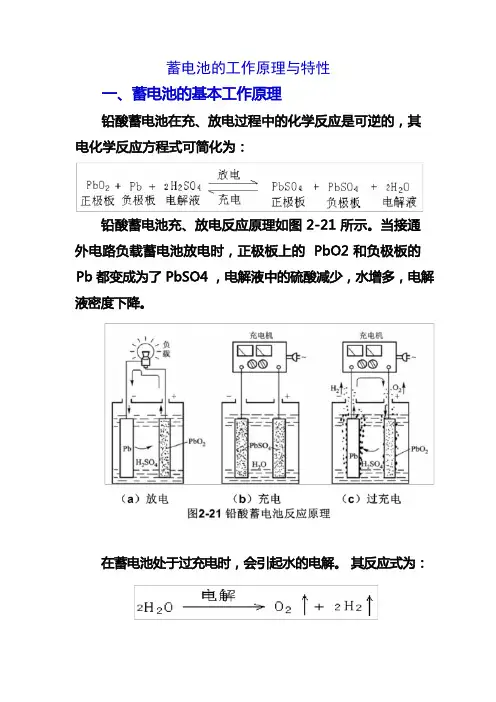
蓄电池的工作原理及特性一、蓄电池的工作原理蓄电池是由浸渍在电解液中的正极板(二氧化铅Pb02)和负极板(海绵状纯铅Pb)组成的,电解液是硫酸(H2S04)的水溶液。
当蓄电池和负载接通放电时,正极板上的Pb02 和负极板上的Pb都变成PbS04,电解液中的H2S04减少,相对密度下降。
充电时按相反的方向变化,正负极板上的PbS04分别恢复成原来的Pb02和Pb,电解液中的硫酸增加,相对密度变大。
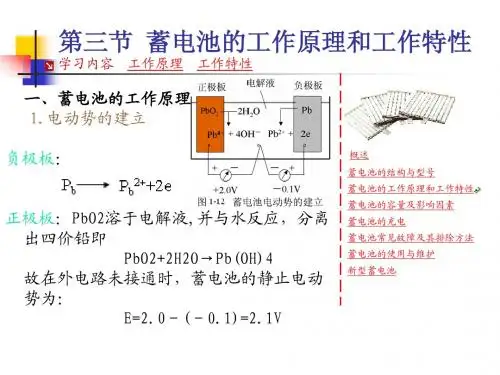
如略去中间的化学反应过程,可用下式表示:Pb02+Pb十2H2S04=2PbS04+2H20 (1—1)1.电势的建立当极板浸入电解液时,在负极板处,金属铅受到两方面的作用,一方面它有溶解于电解液的倾向,因而有少量铅进入溶液,生成Pb2+,在极板上留下两个电子2e,使极板带负电;另一方面,由于正、负电荷的吸引,Pb2+有沉附于极板表面的倾向。
当两者达到平衡时,溶解便停止,此时极板具有负电位,约为-0.1V。
正极板处,少量Pb02溶入电解液,与水生成Pb(OH):,再分离成四价铅离子和氢氧根离子。
即Pb02+2H20---->Pb(OH)4Pb(OH)4=Pb4++4(OH)-由于Pb4+沉附于极板的倾向,大于溶解的倾向,因而沉附在正极板上,使极板呈正电位。
当达到平衡时,约为+2.0V。
因此,当外电路未接通,反应达到相对平衡状态时,蓄电池的静止电动势约为:E0=2.0-(-0.1)=2.1V2.铅蓄电池的放电当蓄电池接上负载后,在电动势的作用下,电流从正极经过负载流往负极(即电子从负极到正极),使正极电位降低,负极电位升高,破坏了原有的平衡。
放电时的化学反应过程如图1—3所示。
在正极板处,Pb4+和电子结合,变成二价铅离子Pb2+,Pb2+与电解液中的SO42-结合生成PbS04沉附于极板上。
即Pb4++2e----> Pb2+Pb2++ SO42-=PbSO4在负极板处,Pb2+与电解液中的SO42-结合也生成PbS04沉附在负极板上,而极板上的金属铅继续溶解,生成Pb2+和电子。



蓄电池工作原理
蓄电池是一种能够将化学能转化为电能并存储起来的装置。
它由一个或多个电池单元组成,每个单元内部又由两个电极(正极和负极)以及浸泡在电解质中的介质组成。
蓄电池的工作原理基于电化学反应,通过化学反应将能量转化为电能。
每个电池单元内部的正负极和电解质之间会发生一系列的化学反应。
正极上的化学物质会失去电子,形成正电荷离子,同时负极上的化学物质会吸收这些电子,形成负电荷离子。
这个过程会产生一个电势差,也就是蓄电池的电压。
当蓄电池处于放电状态时,电子会从负极通过外部电路流向正极,从而产生电流。
这时蓄电池内部的化学物质会逐渐消耗,电压也会逐渐降低。
当化学物质完全消耗,电池无法再提供足够的电子时,电流停止流动,蓄电池耗尽。
当蓄电池处于充电状态时,外部电源会提供电流,从而将电子从正极转移到负极,使得化学反应逆转。
这个过程会使蓄电池内部的化学物质再次恢复,电池重新充满能量。
蓄电池的容量取决于化学反应的种类和电池的设计。
一般来说,容量越大的蓄电池能够存储更多的电能,提供更长时间的电力供应。