四种晶体比较表
- 格式:doc
- 大小:1.55 MB
- 文档页数:2

四种晶体性质比较1.晶体⑴晶体与非晶体⑵得到晶体的途径①熔融态物质凝固。
②气态物质冷却不经液态直接___________________ 。
③溶质从溶液中析出。
⑶晶胞①概念描述晶体结构的基本单元。
②晶体中晶胞的排列一一无隙并置a. _______________________________ 无隙:相邻晶胞之间没有。
b•并置:所有晶胞________ 卡列、取向相同。
⑷晶格能①定义:气态离子形成1摩离子晶体释放的能量,通常取正值,单位:__________________ 。
②影响因素a.离子所带电荷数:离子所带电荷数越多,晶格能越大。
一b. ____________________________ 离子的半径:离子的半径晶格能越大。
③与离子晶体性质的关系晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度_________________ 。
2.四种晶体类型的比较3•晶体熔沸点的比较⑴不同类型晶体熔、沸点的比较①不同类型晶体的熔、沸点高低的一般规律:______________________________ >离子晶体〉_____________________________________ 0②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
⑵同种晶体类型熔、沸点的比较①原子晶体:原子半径越小」—>1键长越短②离子晶体:a•—般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO ____ MgCI 2 ______ N aCl _____ CsCI。
b.衡量离子晶体稳定性的物理量是晶格能。
晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
③分子晶体:a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。
女口H20> H2Te> H2Se> H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,女口Sn H4> GeH4 > SiH4> CH4。

四种晶体的熔沸点
晶体是一种具有有序排列的分子、原子或离子结构的固体。
它们具有一定的熔沸点,也就是在一定的温度下能够融化或沸腾。
以下是四种常见晶体的熔沸点。
1. 钠氯化物晶体:钠氯化物晶体是一种由钠离子和氯离子组成的离子化合物。
它的熔点约为801℃,沸点约为1413℃。
2. 碳晶体:碳晶体是由碳原子组成的晶体,包括金刚石和石墨。
金刚石的熔点非常高,约为3927℃,而石墨的熔点相对较低,约为3730℃。
3. 冰晶体:冰晶体是由水分子组成的晶体。
它的熔点在标准大气压下约为0℃,沸点约为100℃。
4. 硫晶体:硫晶体是由硫原子组成的晶体。
它的熔点约为115℃,沸点约为444℃。
这些晶体的熔沸点与它们的化学结构、分子大小、相互作用力等有关。
熔沸点的知识在材料科学、化学工程等领域中有着广泛的应用。
- 1 -。


高中化学四种晶体熔沸点比较在化学的世界里,晶体的熔点和沸点可真是个有趣的话题,嘿,咱们今天就来聊聊高中化学里那四种晶体的熔沸点比较,听起来是不是很有意思?想象一下,咱们的晶体就像各个性格各异的朋友,有的热情似火,有的冷漠孤傲,有的则温和如水。
好啦,先从离子晶体说起吧。
这种晶体的熔点通常很高,就像不轻易被感动的老顽固,离子之间的静电吸引力可不是盖的。
想象一下,钠和氯一见面就火花四溅,合成了美味的盐,熔点高得让人咋舌,一般得超过800度呢,这可不是一般的朋友关系,真是让人佩服。
咱们再来看看分子晶体,哎呀,这一类就有趣了。
分子晶体像是朋友圈里那种温柔善良的姑娘,平时可爱得不得了,熔点嘛,通常就低得多,像冰淇淋在阳光下融化,唰唰的变得越来越软。
比如说冰,想想看,零下几度就能化成水,真是个容易感动的家伙。
不过,别看她熔点低,分子间的弱相互作用也有她的独特魅力,让人忍不住想要多了解她。
然后,咱们说说金属晶体,这个可真是大块头,铸铁般的坚硬,熔点可高得很,真是威风凛凛。
金属晶体就像个在沙滩上晃荡的大汉,越热越兴奋,熔点动辄就几百度,铁、铜都在其中,热情得让人无可奈何。
金属原子们团结得紧紧的,像兄弟一样,彼此之间的金属键牢不可破,真是让人羡慕的友情。
别忘了网络的主角,晶体管的化学朋友们,网络中的共价晶体。
它们就像一群极为聪明的书呆子,熔点超高,像钻石一样耀眼,硬得让人无从下手。
碳的同素异形体,嘿,真是牛得不要不要的,熔点高得惊人,达到几千度,简直像天上掉下来的明星,闪闪发光。
共价晶体的强大,让人想要一探究竟,真是难得一见的奇珍异宝。
所以说,四种晶体熔沸点的比较就像是一次聚会,大家各显风采,有的高冷、有的温柔、有的热情,还有的闪耀。
每种晶体都有自己的特色,就像每个人都有自己的个性。
这不禁让人思考,化学其实就是这样一个奇妙的世界,各种元素和分子在这里交织碰撞,构成了我们眼前的一切,真是美妙啊!相信只要咱们深入探索,就能发现更多的奥秘和乐趣,化学的魅力无穷无尽,真是让人乐此不疲。


化学中四种典型晶体的判断
晶体是由原子、分子或离子等有规则排列而成的固体物质,是化学中的重要概念之一。
在化学实验中,判断晶体的种类十分重要,下面介绍四种典型晶体的判断方法。
1. 硫酸铜晶体
硫酸铜晶体为蓝色斜方晶系,容易溶于水,且有强烈的蓝色。
判断硫酸铜晶体的方法是将少量硫酸铜溶于水中,加入一点氢氧化钠或氢氧化铵,若出现深蓝色沉淀,则为硫酸铜晶体。
2. 氯化钠晶体
氯化钠晶体为无色正方晶系,有一定的溶解度,且味道咸。
判断氯化钠晶体的方法是取一小部分样品,加入少量硫酸银,若出现白色沉淀,则为氯化钠晶体。
3. 硝酸银晶体
硝酸银晶体为白色菱形晶系,容易溶于水,且有毒。
判断硝酸银晶体的方法是将少量硝酸银溶于水中,加入一点氯化钠,若出现白色沉淀,则为硝酸银晶体。
4. 碘晶体
碘晶体为闪亮的黑色六方晶系,不溶于水,但可以溶于氯仿、二硫化碳等有机溶剂。
判断碘晶体的方法是将少量碘溶于氯仿中,加入一点氢氧化钠或氢氧化铵,若溶液变成蓝色,则为碘晶体。
通过以上四种典型晶体的判断方法,可以帮助化学实验者更准确、快速地判断出实验中所用晶体的种类。


第2课时分子晶体混合晶体【学习目标】1.熟知分子晶体的概念、结构特点及常见的分子晶体。
2.能够从范德华力、氢键的特征,分析理解分子晶体的物理特性。
3.了解石墨晶体的结构,会比较不同类型的晶体熔、沸点。
【新知导学】一、分子晶体1.干冰晶胞结构如图所示,观察分析其结构模型,回答下列问题:(1)构成干冰晶体的结构微粒是______,微粒间的相互作用力是__________。
(2)从结构模型可以看出:干冰晶体是一种____________结构——每8个CO2分子构成立方体,在六个面的中心又各占据1个CO2分子。
每个CO2分子周围,离该分子最近且距离相等的CO2分子有______个。
每个晶胞中有______个CO2分子。
2.冰晶体的结构如下图所示,根据冰晶体的结构,回答下列问题:(1)构成冰晶体的结构微粒是__________,微粒间的相互作用力是________________。
(2)在冰的晶体中,由于水分子之间存在有________性的氢键,迫使在四面体中心的每个水分子与四面体顶角方向的________相邻水分子相互吸引,这样的排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙。
3.由以上分析可知:(1)分子间通过________________构成的固态物质叫分子晶体。
如:干冰、碘晶体、冰等。
构成分子晶体的微粒是________。
(2)根据分子晶体的结构特征,推测其具有的物理特性:分子晶体中的微粒间是以范德华力或范德华力和氢键而形成的晶体,因此,分子晶体的熔、沸点__________,密度________,硬度________,较易熔化和挥发。
【归纳总结】四种晶体物理性质的比较1.根据下列性质判断所描述的物质可能属于分子晶体的是()A.熔点1070℃,易溶于水,水溶液能导电B.熔点1128℃,沸点4446℃,硬度很大C.熔点10.31℃,液态不导电,水溶液能导电D.熔点97.81℃,质软,导电,密度0.97g·cm-32.水分子间可通过氢键彼此结合而形成(H2O)n,在冰中n值为5,即每个水分子被其他4个水分子包围形成变形四面体,如图所示为(H2O)5单元,由无限个这样的四面体通过氢键构成一个庞大的分子晶体,即冰。
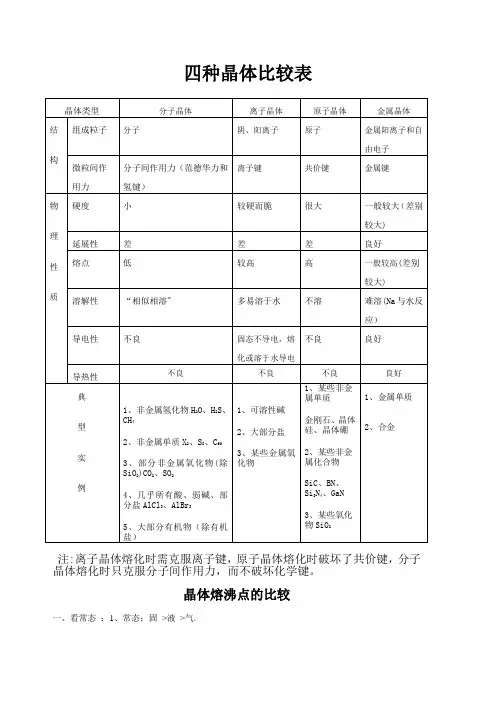
四种晶体比较表注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。
晶体熔沸点的比较一、看常态:1、常态:固>液>气.2、一般情况下,原子晶体〉离子晶体(金属晶体)〉分子晶体。
3、原子晶体:共价键(取决于原子半径).4、离子晶体:离子键(取决于离子半径和离子电荷)5、金属晶体:金属键(取决于金属原子半径和价电子数)6、分子晶体:①结构相似,分子量越大, 熔沸点越高。
②分子量相等,正>异〉新。
③氢键反常二、看类型三、分类比较18.请完成下列各题:(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为。
在GaN晶体中,每个Ga 原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。
在四大晶体类型中,GaN属于晶体.(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
19.生物质能是一种洁净、可再生的能源。
生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为.。

四种晶体一.原子晶体1.定义:相邻的原子之间以共价键相结合而形成空间网状结构的晶体。
2.构成晶体的微粒:原子3.微粒间的相互作用:共价键①概念:原子间通过共用电子对所形成的相互作用。
②分类:极性共价键﹑非极性共价键③特征:有方向性﹑有饱和性④影响强度的因素:成键原子半径越小,键长越短,键能越大,共价键越稳定⑤对物质性质的影响:共价键的键能越大,分子稳定性越强4.物理性质:熔沸点高,难溶于水,硬度大,固态时不导电(熔点:金刚石﹥碳化硅﹥晶体硅)一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,熔沸点越高5.实例:某些非金属单质,如:B、Si、Ge 等;某些非金属化合物,如:SiC、BN、SiO2 二.金属晶体1.定义:通过金属键结合而形成的晶体2.构成晶体的微粒:金属阳离子和自由电子3.微粒间的相互作用:金属键4.物理性质:导热性、导电性、延展性,熔沸点较高,硬度较大一般来说,金属原子的价电子数越多,原子半径越小,金属晶体内部作用力越强,离子的熔沸点越高5.实例:金属、合金6.金属晶体的四种堆积模型简单立方:代表金属Po;配位数6;晶胞占有的原子数1体心立方(钾型):代表金属Na、K、Fe;配位数8;晶胞占有的原子数2面心立方(铜型):代表金属Cu、Ag、Au;配位数12;晶胞占有的原子数4六方最密堆积(镁型):代表金属Mg、Zn、Ti;配位数12;晶胞占有的原子数2 三.分子晶体1.定义:分子间以分子间作用力结合而成的晶体2.构成微粒:分子3.微粒间的相互作用力:①范德华力:特征:无方向性、无饱和性影响强度的因素:随着分子极性的增大而增大组成和结构相似的物质,相对分子质量越大,范德华力越大对物质性质的影响:影响物质的熔沸点、溶解度等物理性质组成和结构相似的物质,随着相对分子质量的增大,物质的熔沸点增大②氢键:分类:分子间氢键、分子内氢键特征:有方向性、有饱和性影响强度的因素:对A—H…B,A、B的电负性越大,B原子半径越小,键能越大对物质性质的影响:使物质的熔沸点升高,在水中的溶解度越大4.物理性质:熔沸点较低,硬度较小;“相似相溶”原理汽化或熔融时,克服分子间作用力不破坏化学键在固态或熔融状态下不导电5.实例:非金属氢化物、部分非金属单质、部分非金属氧化物、几乎所有的酸、绝大多数有机物四.离子晶体1.定义:离子间通过离子结合而形成的晶体2.构成微粒:阴离子和阳离子3.微粒间的相互作用:离子键4.物理性质:具有较高的熔沸点,难挥发,硬而脆,固态不导电,熔化或溶于水后能导电大多数易溶与极性溶剂(如水中),难溶于非极性溶剂(如汽油煤油)一般来说,阴阳离子所带的电荷数越多,离子半径越小,则离子键越强,离子晶体的熔沸点越高6.实例:强碱、活泼金属氧化物、绝大多数盐五.得到晶体的途径:熔融状态物质凝固气态物质冷却不经液态直接凝固(凝华)溶质从溶液中析出。

3四种重要晶体的结构特点1.氯化钠晶体(1)Na+、Cl-在晶体中按确定的比例和一定的规则排列,使整个离子晶体不显电性且能量最低。
离子晶体中无单个分子存在。
(2)离子的配位数为6。
(3)在每个结构单元(晶胞)中,处于不同位置的微粒在该单元中的份额也有所不同,一般规律是顶点上的微粒属于该单元的份额是1/8;棱上的微粒在该单元中所占的份额为1/4;面上的微粒在该单元中所占的份额为1/2;中心位置上的微粒完全属于该单元,即份额为1。
例如:氯离子数:1/8×8+1/2×6=4钠离子数:1/4×12+1=4因此,钠离子数与氯离子数之比为1∶1,氯化钠的化学式为NaCl。
2.金刚石晶体(1)碳原子间通过共价键相结合而形成空间网状结构的原子晶体,整个晶体中无单个分子。
(2)微观构型:正四面体,每个碳原子与4个碳原子成键,每个碳原子上的任意两个C—C键的夹角都是109°28′。
(3)最小的环:六元环。
(4)每个C原子参与形成六元环的总数:12个。
3.干冰晶体(1)干冰晶体中分子之间通过范德华力相结合,当熔化时,分子内的化学键并不断裂。
(2)每个二氧化碳分子周围与之相邻且等距的二氧化碳分子数为12。
(3)每个结构单元中含二氧化碳分子数为1/8×8+1/2×6=4。
4.石墨晶体(1)晶体结构:平面层状结构。
(2)最小的环:六元环。
(3)由于每个碳原子为三个六元环所共用,即每个六元环拥有的碳原子数为6×1/3=2。
(4)碳碳键数为二个六元环所共用,每个六元环拥有的碳碳键数为6×1/2=3。
键角为120°。
(5)该晶体介于原子晶体、分子晶体、金属晶体之间,因而具有各种晶体的部分特点。
如熔点高,硬度小,能导电。
【典例5】判断下列晶体类型:(1)SiI4:熔点120.5 ℃,沸点271.5 ℃,易水解。
属__________________________。
晶体的四种基本类型和特点
晶体是一种有序的固体结构,其分为四种基本类型:离子晶体、共价晶体、分子晶体和金属晶体。
每种晶体类型都有其独特的结构和特点。
离子晶体是由正负离子通过电子静电力相互吸引而形成的晶体。
其具有高熔点、高硬度和脆性等特点。
常见的离子晶体包括氯化钠、硫酸钠等。
共价晶体是由共价键相互连接而形成的晶体。
其具有高熔点、高硬度和脆性等特点。
常见的共价晶体包括金刚石、石英等。
分子晶体是由分子通过范德华力相互吸引而形成的晶体。
其具有较低的熔点、硬度和脆性较小等特点。
常见的分子晶体包括葡萄糖、萘等。
金属晶体是由金属离子通过金属键相互连接而形成的晶体。
其具有高导电性、高热传导性和良好的延展性等特点。
常见的金属晶体包括铜、银等。
总之,不同类型的晶体具有不同的结构和特点,这些特点也决定了它们在实际应用中的不同用途和作用。
- 1 -。
四种晶体性质比较1.晶体(1)晶体与非晶体(2)得到晶体的途径①熔融态物质凝固。
②气态物质冷却不经液态直接_______________。
③溶质从溶液中析出。
(3)晶胞①概念描述晶体结构的基本单元。
②晶体中晶胞的排列——无隙并置a.无隙:相邻晶胞之间没有____________。
b.并置:所有晶胞______排列、取向相同。
(4)晶格能①定义:气态离子形成1摩离子晶体释放的能量,通常取正值,单位:_________________。
②影响因素a.离子所带电荷数:离子所带电荷数越多,晶格能越大。
b.离子的半径:离子的半径________,晶格能越大。
③与离子晶体性质的关系晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度___________。
2.四种晶体类型的比较3.晶体熔沸点的比较(1)不同类型晶体熔、沸点的比较①不同类型晶体的熔、沸点高低的一般规律:________________>离子晶体>____________。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
(2)同种晶体类型熔、沸点的比较①原子晶体:原子半径越小―→键长越短―→键能越大―→熔沸点越高②离子晶体:a.一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO____MgCl2______NaCl______CsCl。
b.衡量离子晶体稳定性的物理量是晶格能。
晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
③分子晶体:a.分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常地高。
如H2O>H2Te>H2Se>H2S。
b.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
c.组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点____________,如CO>N2,CH3OH>CH3CH3。
四种晶体比较表議体貓只化服分克间服离力键'而不晶体瞬破坏了共价键,分晶体熔沸点的比较、看常态:1、常态:固>液>气。
般情况下,原子晶体>离子晶体(金属晶体)>分子晶体。
二、看类型三、分类比较18•请完成下列各题:(1 )前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第川A、V A原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。
Ga原子的电子排布式为 ______________ 。
在GaN晶体中,每个Ga原子与________ 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为____________ 。
在四大晶体类型中,GaN属于___________ 晶体。
(3)在极性分子NCI3中,N原子的化合物为一3, CI原子的化合价为+ 1,请推测NCI3水解的主要产物是______________ (填化学式)。
19 •生物质能是一种洁净、可再生的能源。
生物质气(主要成分为H2混合,催化合成甲醇是生物质能利用的方法之一。
(2)根据等电子原理,写出CO分子结构式______________________(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH) 2的碱性溶液反应生成①甲醇的沸点比甲醛的高,其主要原因是 ________________ ;甲醛分子中碳原子轨道的杂化类型为__________________ 。
②甲醛分子的空间构型是____________ ; 1mol甲醛分子中b键的数目为 ______③ _________________________________________________________________ 在1个CU2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________(1 )上述反应的催化剂含有Cu、Zn、Al等元素。
在前面我们分别介绍了分子晶体、原子晶体、金属晶体、离子晶体,今天我们将四种晶体放在一起进行总结比较。
1.四种晶体类型的比较
2.晶体熔沸点的比较
对于不同种类型的晶体,一般而言,熔沸点:
原子晶体>离子晶体>分子晶体
金属晶体(少数除外)>分子晶体
对于同种类型的晶体:
(1)分子晶体
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高。
②相对分子质量相同的分子晶体,分子极性越大,熔沸点越高。
③分子中存在氢键的分子晶体,熔沸点反常的高。
(2)原子晶体
原子晶体熔沸点的高低,取决于共价键的强弱和成键原子半径的大小。
(3)金属晶体
金属阳离子电荷数越多,离子半径越小,金属键越强,熔沸点越高。
(4)离子晶体
离子电荷数越多,离子半径越小,离子键越强,熔沸点越高。
四种晶体熔沸点高低排序晶体是物质的一种形态,具有规则的排列和周期性的结构,是固态物质的一种。
晶体的熔沸点是指晶体从固态转变为液态或气态时所需的温度,也是晶体的物理性质之一。
本文将介绍四种常见的晶体,按照它们的熔沸点从高到低进行排序。
1. 金刚石(熔点约为3550℃)金刚石是一种由碳原子构成的晶体,是自然界中最硬的物质之一。
它的晶体结构是由每个碳原子与四个相邻的碳原子形成四面体结构,形成了一种密集的、连续的晶体网络。
由于其晶体结构的紧密性,金刚石的熔沸点非常高,约为3550℃。
这也使得金刚石是一种非常耐高温的材料,可以被用于制造高温炉、高温热处理工具等。
2. 石英(熔点约为1713℃)石英是一种由硅氧原子构成的晶体,是自然界中最常见的矿物之一。
它的晶体结构是由每个硅原子与四个相邻的氧原子形成四面体结构,形成了一种紧密的、连续的晶体网络。
由于其晶体结构的紧密性,石英的熔沸点也非常高,约为1713℃。
石英在工业上有广泛的应用,可以用于制造玻璃、陶瓷、光学仪器等。
3. 盐(熔点约为801℃)盐是一种由氯化钠分子构成的晶体,是一种常见的食盐。
它的晶体结构是由每个钠离子与六个相邻的氯离子形成八面体结构,形成了一种密集的、连续的晶体网络。
由于其晶体结构的紧密性,盐的熔沸点也比较高,约为801℃。
盐可以用于烹饪、腌制、制造化学品等。
4. 冰(熔点约为0℃)冰是一种由水分子构成的晶体,是一种常见的物质。
它的晶体结构是由每个水分子与四个相邻的水分子形成六面体结构,形成了一种密集的、连续的晶体网络。
由于其晶体结构的紧密性,冰的熔沸点也比较高,约为0℃。
冰可以用于制冷、制造雪、制造冰雕等。
总结晶体的熔沸点是晶体的物理性质之一,它与晶体的结构密切相关。
不同的晶体具有不同的晶体结构和熔沸点,金刚石、石英、盐和冰是四种常见的晶体,它们的熔沸点从高到低依次排列为金刚石、石英、盐和冰。
这些晶体在工业、生活中都有广泛的应用。
四种晶体比较表
注:离子晶体熔化时需克服离子键,原子晶体熔化时破坏了共价键,分子晶体熔化时只克服分子间作用力,而不破坏化学键。
晶体熔沸点的比较
一、看常态:1、常态:固>液>气。
2、一般情况下,原子晶体>离子晶体(金属晶体)>分子晶体。
3、原子晶体:共价键(取决于原子半径)。
4、离子晶体:离子键(取决于离子半径和离子电荷)
5、金属晶体:金属键(取决于金属原子半径和价电子数)
6、分子晶体:①结构相似,分子量越大,熔沸点越高。
②分子量相等,正>异>新。
③氢键反常
二、看类型
三、分类比较
18.请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。
Ga原子的电子排布式为。
在GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为。
在四大晶体类型中,GaN属于晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是(填化学式)。
19.生物质能是一种洁净、可再生的能源。
生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。
写出基态Zn原子的核外电子排布式。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子
中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数
目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。