高中化学四种晶体类型的比较
- 格式:doc
- 大小:28.00 KB
- 文档页数:3

高中化学四种晶体类型的比较TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-四种晶体类型的比较物质熔沸点高低的比较方法物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。
例如:NaBr(固)>Br2>HBr(气)。
2、不同类型晶体的比较规律一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。
原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。
例如:金刚石>食盐>干冰3、同种类型晶体的比较规律A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,原子半径越小,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。
如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C<C—Si<?Si—Si,所以熔沸点高低为:金刚石>碳化硅>晶体硅。
B、离子晶体:熔、沸点的高低,取决于离子键的强弱。
一般来说,①离子所带电荷越多,②离子半径越小,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
KF>KCl>KBr>KI,CaO>KCl。
C、金属晶体:金属晶体中①金属价电子数越多,②原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。
如:Na<Mg<Al,Li>Na>K。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。

晶体的常识分子晶体与原子晶体【学习目标】1、初步了解晶体的知识,知道晶体与非晶体的本质差异,学会识别晶体与非晶体的结构示意图;2、知道晶胞的概念,了解晶胞与晶体的关系,学会通过分析晶胞得出晶体的组成;3、了解分子晶体和原子晶体的特征,能以典型的物质为例描述分子晶体和原子晶体的结构与性质的关系;4、知道分子晶体与原子晶体的结构粒子、粒子间作用力的区别。
【要点梳理】要点一、晶体与非晶体【分子晶体与原子晶体#晶体与非晶体】1、概念:①晶体:质点(分子、离子、原子)在空间有规则地排列成的、具有整齐外型、以多面体出现的固体物质。
晶体具有的规则的几何外形源于组成晶体的微粒按一定规律周期性的重复排列。
②非晶体:非晶态物质内部结构没有周期性特点,而是杂乱无章地排列,如:玻璃、松香、明胶等。
非晶体不具有晶体物质的共性,某些非晶态物质具有优良的性质要点诠释:晶体与非晶体的区分:晶体是由原子或分子在空间按一定规律周期性地重复排列构成的固体物质。
周期性是晶体结构最基本的特征。
许多固体的粉末用肉眼是看不见晶体的,但我们可以借助于显微镜观察,这也证明固体粉末仍是晶体,只不过晶粒太小了。
晶体的熔点较固定,而非晶体则没有固定的熔点。
区分晶体和非晶体最可靠的科学方法是对固体,进行X—射线衍射实验,X射线透过晶体时发生衍射现象。
特别注意:一种物质是否晶体,是由其内部结构决定的,而非由外观判断。
2、分类:说明:①自范性:晶体能自发性地呈现多面体外形的性质。
所谓自范性即“自发”进行,但这里要注意,“自发”过程的实现仍需一定的条件。
例如:水能自发地从高处流向低处,但若不打开拦截水流的闸门,水库里的水不能下泻;②晶体自范性的条件之一:生长速率适当;③晶体自范性的本质:是晶体中粒子微观空间里呈现周期性的有序排列的宏观表象。
4、晶体形成的途径:①熔融态物质凝固,例:熔融态的二氧化硅,快速冷却得到玛瑙,而缓慢冷却得到水晶。
②气态物质冷却不经液态直接凝固(凝华);③溶质从溶液中析出。


高中化学常见晶体结构
高中化学常见晶体结构
1、六方晶系
六方晶系是最常见的晶体结构形式,它是比较复杂的立方晶系的一种特殊晶系结构。
它有六个面对称,每个晶体晶面都与等边三角型对称,比如金刚石的晶体结构。
2、立方晶系
立方晶系结构是一种具有八个面对称的晶体结构,每个晶体晶面都与等边正方形对称,比如氯化钠的晶体结构。
3、非六方晶系
非六方晶系是指其他晶体体系,如柱晶系、针晶系、釉晶系等,这些晶体的晶面并不都与等边三角形或等边正方形对称,比如电镀银的晶体结构。
- 1 -。

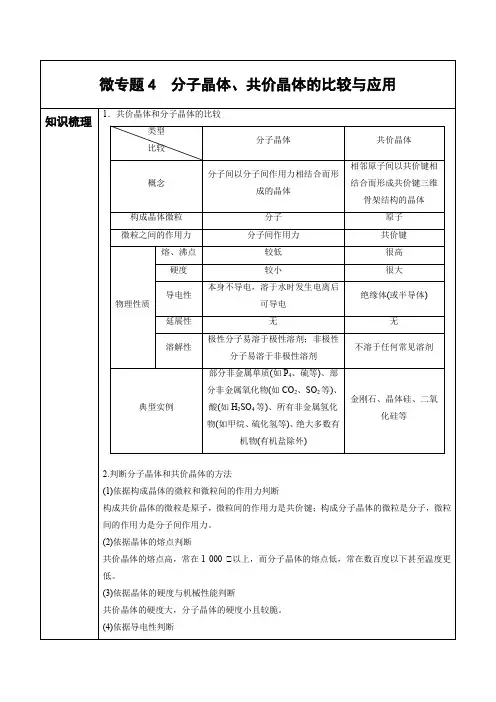
跟踪训练1.现有四种晶体的晶胞,其微粒质点排列方式如图所示,其中化学式正确的是A.AB2B.EF2C.XY3Z D.AB3 A.A B.B C.C D.D2.AB型物质形成的晶体多种多样,下列图示的几种结构最有可能是分子晶体的是A.℃℃℃℃B.℃℃℃℃C.℃℃D.℃℃℃℃3.铜和氧形成的一种离子化合物晶胞、C60晶胞和C60分子如下图所示,下列说法中错误..的是A.铜和氧形成的离子化合物,铜离子的电荷数为+1B .在C 60晶胞中含有14个C 60分子C .C 60与F 2在一定条件下,发生加成反应生成C 60F 60D .1molC 60分子中,含有的δ键数目约为2390 6.0210⨯⨯4.硫化锌有两种常见的晶体,分别是六方硫化锌(晶胞结构如图甲所示)和立方硫化锌(晶胞结构如图乙所示)。
下列说法错误的是A .可用X -射线衍射实验鉴别硫化锌是否属于晶体B .每个六方硫化锌晶胞中含2个S 原子C .立方硫化锌中锌的配位数为4D .氧化锌的熔点低于六方硫化锌和立方硫化锌5.类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其正确与否。
下列几种类推结论正确的是A .金刚石中C—C 键的键长为154.45pm ,C 60中C—C 键的键长为140~145pm ,所以C 60的熔点高于金刚石B .CO 2晶体是分子晶体,SiO 2晶体也是分子晶体C .从CH 4、NH 4+、SO 24-为正面体结构,可推测CC14、PH 4+、PO 34-也为正四面体结构 D .C 2H 6是碳链为直线形的非极性分子,可推测C 3H 8也是碳链为直线形的非极性分子6.根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法不正确的是A .氮化碳属于共价晶体B .氮化碳的分子式为C 3N 4C .该晶体中的碳、氮原子核外都满足8电子稳定结构D .每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连7.硫酰氯(SO2Cl2)常用作药剂的合成、染料的制造,熔点为-54.1℃,沸点为69.1℃。



不同类型的晶体晶体:具有规则几何外形的固体.构成晶体的微粒可以是分子、原子、离子.1.离子晶体阴、阳离子按一定方式有规则排列形成的晶体.如NaCl晶体(结构如图)NaCl晶体的结构特点:(1)每个Na+的周围有6个Cl-;每个Cl-的周围有6个Na+;(2)NaCl晶体中不存在单个的NaCl分子;(3)Na+,Cl-离子个数比为1∶1.微粒间作用力:离子键.物理性质:熔沸点较高,硬度较大.2.分子晶体由分子构成的物质形成的晶体.如干冰晶体(结构如图)干冰晶体的结构特点:(1)干冰晶体中存在单个2CO 分子(2)C 、O 原子间存在共价键,而2CO 分子间存在着分子间作用力 (3)干冰晶体发生化学变化时,需克服的作用力是共价键(4)干冰晶体发生物理变化时,需克服的作用力是分子间作用力 微粒间的作用力:分子间作用力物理性质:熔沸点低,硬度小,在水溶液中有些会导电3.原子晶体相邻原子通过共价键结合而形成空间网状结构的晶体.如2SiO 晶体(结构如图)2SiO 晶体的结构特点:(1)每个Si 原子与相邻的4个O 原子以共价键相结合,每个O 原子与2个相邻的Si 原子以共价键相结合(2)2SiO 晶体中不存在单个的2SiO 分子(3) 化学式为2SiO 中的1:2代表的是晶体中Si 、O 原子的数目比 微粒间的作用力:共价键物理性质:熔沸点很高,硬度很大,一般不导电.4.金属晶体 金属在常温下(除汞外)都是晶体.如Ne 、Fe. 微粒间作用力:金属键物理性质:有金属光泽,能导电、传热,具有延展性.5.几种晶体比较①NaCl:离子晶体,每个Na+同时吸引着6个Cl—,每个Cl—也同时吸引着6个Na+.②CsCl:离子晶体,每个Cs+同时吸引着8个Cl—,每个Cl—也同时吸引着8个Cs+.③金刚石:原子晶体,是天然存在的最硬物质.每个碳原子被相邻的4个碳原子包围,处于4个碳原子的中心,以共价键与这4个碳原子结合,成为正四面体结构,这些正四面体向空间发展,构成彼此联结的立体网状晶体.晶体硅结构与金刚石相似.④SiO2:原子晶体,1个Si原子与4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合.即SiO2晶体是由Si原子和O原子按1 :2的比例而形成的立体网状结构的晶体.⑤石墨:过渡型或混合型晶体,为层状结构,每一层内,碳原子排成六边形,每个碳原子都与其他3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间作用力相结合的.熔点很高,但硬度小,是电的良导体.7.物质熔沸点的比较及规律①不同的晶体:原子晶体>离子晶体>分子晶体②同类型晶体a.原子晶体熔沸点取决于原子半径,原子半径越小,熔沸点越高,如:金刚石>SiC>晶体硅b.离子晶体熔沸点高低取决于离子半径和离子所带电荷,半径越小,电荷越多,熔沸点越高,如:KCl<NaCl③分子晶体与分子间作用力有关,组成和结构相似的物质,分子量越大,熔沸点越高.④金属晶体中离子半径越小,电荷越多,熔沸点越高,如Na<Mg<Al,碱金属单质随元素原子序数递增,熔沸点降低.例1.关于晶体的下列说法正确的是 ( )A .在晶体中只要有阴离子就一定有阳离子B .晶体中只要有阳离子就一定有阴离子C .原子晶体的熔点一定比金属晶体的高D .稀有气体原子序数越大,沸点越高 答案:AD解析:含有阴离子的晶体只有离子晶体,离子晶体是由阴离子和阳离子构成的,所以A 对.离子晶体和金属晶体中都含有阳离子,但金属晶体中没有阴离子,而含有自由电子,所以B 不对.原子晶体的熔点较高,但有些金属晶体的熔点也很高如W 的熔点高达3410℃,高于SiO 2(2230℃),所以C 错.稀有气体分子间作用力随分子量增大而增大,所以沸点随原子序数升.例2.下列物质的晶体中不存在分子的是( ) A.二氧化硅 B.二氧化碳 C.二氧化硫 D.二硫化碳 答案:A例3.晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞.NaCl 晶体结构如图所示.已知Fe x O 晶体晶胞为NaCl 型,由于晶体缺陷,x 值小于1.测知Fe x O 晶体密度ρ为5.71 g·cm -3,晶胞边长为4.28×10-10 m(铁相对原子质量为55.9,氧相对原子质量为16).求:(1)Fe x O 中x 的值.(2)晶体中的铁分别为Fe 2+、Fe 3+,在Fe 2+和Fe 3+的总数中,Fe 2+所占的质量分数(用小数表示精确到0.001).(3)确定此晶体的化学式(化学式中表示出Fe 2+和Fe 3+的个数). (4)在该晶体中,铁元素的离子间的最短距离为多少米?解答:考查晶体结构常以新情境(或信息题)的形式出现,要求考生在解题时展开丰富的空间想象、结合化学概念、充分运用数学或物理的思维方法,以及旋转、翻转、分割、延伸等手段解题.本题应抓住晶体中的电中性原则,充分利用数学知识,展开空间想象.(1)1个晶胞中含4个Fe x O6.02×1023×(4.28×10-8)3×5.71=4 MM =67.4 g·mol -1 55.9x +16=67.4 故x =0.92(2)设Fe 2+为y 个、则Fe 3+为(0.92-y )个 2y +3×(0.92-y )=2 y =0.7692.076.0×100%=82.6% (3)19 FeO·2Fe 2O 3;(4)221028.410-⨯=3.03×10-10 m.。
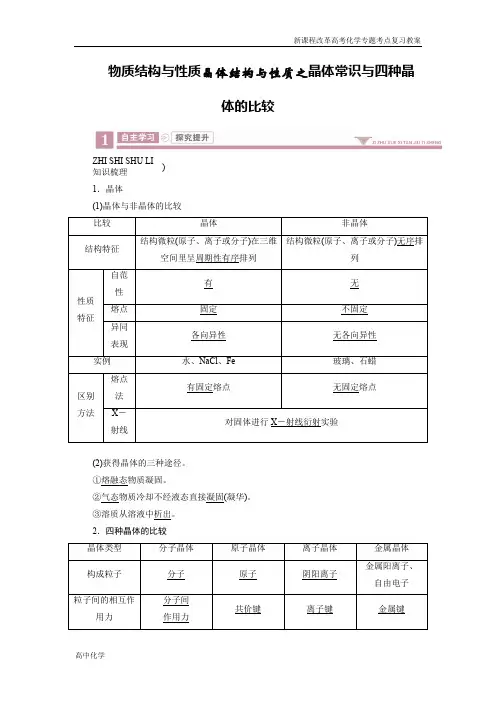
物质结构与性质晶体结构与性质之晶体常识与四种晶体的比较ZHI SHI SHU LI知识梳理 )1.晶体(1)晶体与非晶体的比较(2)获得晶体的三种途径。
①熔融态物质凝固。
②气态物质冷却不经液态直接凝固(凝华)。
③溶质从溶液中析出。
2.四种晶体的比较3.晶体类型的5种判断方法(1)依据构成晶体的微粒和微粒间的作用判断。
①离子晶体的构成微粒是阴、阳离子,微粒间的作用是离子键。
②原子晶体的构成微粒是原子,微粒间的作用是共价键。
③分子晶体的构成微粒是分子,微粒间的作用为分子间作用力。
④金属晶体的构成微粒是金属阳离子和自由电子,微粒间的作用是金属键。
(2)依据物质的分类判断。
①金属氧化物(如K2O、Na2O2等)、强碱(NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅等)、非金属氢化物、非金属氧化物(除SiO2外)、几乎所有的酸、绝大多数有机物(除有机盐外)是分子晶体。
③常见的单质类原子晶体有金刚石、晶体硅、晶体硼等,常见的化合物类原子晶体有碳化硅、二氧化硅等。
④金属单质是金属晶体。
(3)依据晶体的熔点判断。
①离子晶体的熔点较高。
②原子晶体的熔点很高。
③分子晶体的熔点低。
④金属晶体多数熔点高,但也有少数熔点相当低。
(4)依据导电性判断。
①离子晶体溶于水及熔融状态时能导电。
②原子晶体一般为非导体。
③分子晶体为非导体,而分子晶体中的电解质(主要是酸和强极性非金属氢化物)溶于水,使分子内的化学键断裂形成自由移动的离子,也能导电。
④金属晶体是电的良导体。
(5)依据硬度和机械性能判断。
①离子晶体硬度较大、硬而脆。
②原子晶体硬度大。
③分子晶体硬度小且较脆。
④金属晶体多数硬度大,但也有硬度较小的,且具有延展性。
4.晶体熔、沸点的比较(1)不同类型晶体熔、沸点的比较。
①不同类型晶体的熔、沸点高低的一般规律:原子晶体>离子晶体>分子晶体。
②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
第二节分子晶体和共价晶体一、分子晶体1.概念:只含分子的晶体。
2.粒子间的作用分子晶体中相邻的分子间以分子间作用力相互吸引。
3.常见分子晶体及物质类别【注】稀有气体为的分子为单原子分子,因此,有稀有气体单质形成的晶体也是分子晶体。
4.物理特性(1)分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发,部分分子晶体易升华,(如干冰、碘、红磷等)。
(2)一般是绝缘体。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)溶解性符合“相似相溶规律”。
【注】分子晶体熔、沸点高低的比较规律①分子晶体中分子间作用力越大,物质熔、沸点越高,反之越低。
②具有氢键的分子晶体,熔、沸点反常高。
5.分子晶体的常见堆积方式6.常见分子晶体的结构分析(1)冰①水分子之间的主要作用力是氢键,当然也存在范德华力。
②氢键有方向性,它的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子互相吸引。
(2)干冰①干冰中的CO 2分子间只存在范德华力,不存在氢键。
②每个晶胞中有4个CO 2分子,12个原子。
每个CO 2分子周围等距离紧邻的CO 2分子数为12个。
【注】冰晶体中,每个水分子与其他4个水分子形成氢键,每个水分子平均形成2个氢键(每个氢键由2个水分子均摊,故4×21=2)二、共价晶体1.定义:所有原子都以共价键相互结合形成共价键三维骨架结构的晶体叫共价晶体。
2.构成微粒及微粒间的作用力共价晶体⎩⎨⎧ 构成粒子:原子粒子间作用力:共价键【注】①共价晶体中不存在单个分子,因此,共价晶体的化学式不代表其实际组成,只表示其组成的原子个数比。
①共价晶体融化时被破坏的作用力是共价键。
①共价晶体中只有共价键,但含有共价键的晶体不一定是共价晶体。
如CO2、H2O等分子晶体中也含有共价键。
3.常见的共价晶体4.共价晶体的物理性质(1)熔点很高。
第2课时过渡晶体与混合型晶体、晶体类型的比较[核心素养发展目标] 1.从化学键变化上认识过渡晶体,理解纯粹的典型晶体在自然界中是不多的。
2.从结构和性质上认识典型的混合型晶体——石墨。
一、过渡晶体与混合型晶体1.过渡晶体(1)四类典型晶体是分子晶体、共价晶体、金属晶体、离子晶体。
(2)离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。
离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
(3)Na2O、MgO、Al2O3、SiO2、P2O5、SO3、Cl2O7七种氧化物中从左到右,离子键成分的百分数越来越小,其中作为离子晶体处理的是Na2O、MgO;作为共价晶体处理的是Al2O3、SiO2;作为分子晶体处理的是P2O5、SO3、Cl2O7。
2.混合型晶体——石墨(1)结构特点——层状结构①同层内,碳原子采用sp2杂化,以共价键相结合形成平面六元并环结构。
所有碳原子的p 轨道平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。
②层与层之间以范德华力相结合。
(2)晶体类型石墨晶体中,既有共价键,又有金属键和范德华力,属于混合型晶体。
(3)物理性质:①导电性,②导热性,③润滑性。
(1)纯粹的典型晶体是没有的()(2)离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小()(3)在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中()(4)四类晶体都有过渡型()(5)石墨的二维结构内,每个碳原子的配位数为3()(6)石墨的导电只能沿石墨平面的方向进行()(7)石墨晶体层与层之间距离较大,所以石墨的熔点不高()答案(1)×(2)×(3)√(4)√(5)√(6)√(7)×1.石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。
(1)熔点:石墨________(填“>”“<”或“=”)金刚石。
安徽安徽高中化学竞赛无机化学第六章晶体结构基础6. 0. 01 晶体的四种差不多类型:依照晶体中微粒之间相互作用的性质,能够将晶体分成4种差不多类型:离子晶体、金属晶体、分子晶体和原子晶体。
6. 1. 01 分子晶体及其物理性质:分子之间以分子间作用力结合成的晶体称为分子晶体。
由于熔、沸点较低,因此分子晶体一样要在较低的温度下才能形成,而在常温时多以气体形式存在。
分子晶体的硬度较小,导电性能一样较差,因为电子从一个分子传导到另一个分子专门不容易。
6. 1. 02 极性分子:分子的正电荷重心和负电荷重心不重合,则为极性分子。
6. 1. 03 偶极矩:极性分子的极性能够用偶极矩m 来度量。
若正电荷(或负电荷)重心上的电荷量为q,正、负电荷重心之间距离即偶极长为d,则偶极矩m = q d6. 1. 04 偶极矩的单位:当d = 1.0 ´10-10 m,即d 为 1 ,q = 1.602 ´10-19 C,即q 为电子的电荷量时,偶极矩m = 4.8 D。
D 为偶极矩单位,称为德拜。
在国际单位制中,偶极矩m以C•m(库仑•米)为单位,当q = 1 C,d = 1 m时,m = 1 C•m。
C•m 与D 这两种偶极矩单位的换算关系为= 3.34 ´10-30 C•m6. 1. 05 永久偶极:极性分子的偶极矩称为永久偶极,偶极矩的矢量方向由正极指向负极。
多原子分子中的大p 键及孤电子对,有时也阻碍分子的偶极矩。
6. 1. 06 诱导偶极:非极性分子在外电场的作用下,能够变成具有一定偶极矩的极性分子,如下面左图所示。
而极性分子在外电场作用下,其偶极矩也能够增大,如下面右图所示。
在电场的阻碍下产生的偶极称为诱导偶极。
6. 1. 07 阻碍诱导偶极的因素:诱导偶极强度大小与电场强度成正比,也与分子的变形性成正比。
所谓分子的变形性,即分子的正、负电荷重心的可分程度。
分子体积越大,电子越多,变形性越大。
四种晶体类型的比较
物质熔沸点高低的比较方法
物质的熔沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下:
1、在相同条件下,不同状态的物质的熔、沸点的高低是不同的,一般有:固体>液体>气体。
例如:NaBr (固)>Br2>HBr(气)。
2、不同类型晶体的比较规律
一般来说,不同类型晶体的熔沸点的高低顺序为:原子晶体>离子晶体>分子晶体,而金属晶体的熔沸点有高有低。
这是由于不同类型晶体的微粒间作用不同,其熔、沸点也不相同。
原子晶体间靠共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间靠离子键结合,一般熔、沸点较高;分子晶体分子间靠范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。
例如:金刚石>食盐>干冰
3、同种类型晶体的比较规律
A、原子晶体:熔、沸点的高低,取决于共价键的键长和键能,原子半径越小,键长越短,键能越大共价键越稳定,物质熔沸点越高,反之越低。
如:晶体硅、金刚石和碳化硅三种晶体中,因键长C—C<C—Si< Si—Si,所以熔沸点高低为:金刚石>碳化硅>晶体硅。
B、离子晶体:熔、沸点的高低,取决于离子键的强弱。
一般来说,①离子所带电荷越多,②离子半径越小,离子键就越强,熔、沸点就越高,反之越低。
例如:MgO>CaO,NaF>NaCl>NaBr>NaI。
KF>KCl>KBr>KI,CaO>KCl。
C、金属晶体:金属晶体中①金属价电子数越多,②原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低。
如:Na<Mg<Al,Li>Na>K。
合金的熔沸点一般说比它各组份纯金属的熔沸点低。
如铝硅合金<纯铝(或纯硅)。
D、分子晶体:熔、沸点的高低,取决于分子间作用力的大小。
分子晶体分子间作用力越大物质的熔沸点越高,反之越低。
(具有氢键的分子晶体,熔沸点反常地高)
如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3。
(1)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
如:CH4<SiH4<GeH4<SnH4。
(2)组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。
如:熔沸点 CO>N2,CH3OH>CH3—CH3。
(3)在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。
如:C17H35COOH硬脂酸>C17H33COOH油酸。
(4)烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高,如C2H6>CH4, C2H5Cl >CH3Cl,CH3COOH>HCOOH。
(5)同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。
如:CH3(CH2)3CH3 (正)>CH3CH2CH(CH3)2(异)>(CH3)4C(新)。
芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低沸点按邻、间、对位降低)
【通过文字判断晶体类型】。